Gießkannenschimmel
Die Gießkannenschimmel (Aspergillus) sind eine über 350 Arten umfassende Gattung von Schimmelpilzen mit aspergillförmigen Sporenträgern. Sie sind weltweit verbreitete Saprobionten, die überwiegend in toter, sich zersetzender organischer Substanz leben und einen erheblichen Anteil am Stoffkreislauf im Ökosystem der Erde haben. Einige Arten sind jedoch Krankheitserreger, die den Menschen, verschiedene Tiere oder Pflanzen befallen können.
| Gießkannenschimmel | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Elektronenmikroskopaufnahme des Sporenträgers von Aspergillus fumigatus | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Aspergillus | ||||||||||||
| P. Micheli ex Link |
Die Gattung Aspergillus wurde lange Zeit zu den Fungi imperfecti gezählt, die sich von anderen Pilzen dadurch unterscheiden, dass sie sich nur asexuell fortpflanzen. Inzwischen ist aber bei einigen Arten bekannt, dass sie einen pleomorphen Entwicklungszyklus durchlaufen, in dem sich eine asexuelle Form (Anamorphe) und eine sexuelle Form (Teleomorphe) abwechseln. Bislang werden provisorisch die asexuellen Formen weiterhin als Aspergillus bezeichnet, während die bekannten sexuellen Formen unter anderen Gattungsnamen zu den Schlauchpilzen (Ascomycota) gerechnet werden.
Der Name Aspergillus geht auf den italienischen Priester und Botaniker Pier Antonio Micheli zurück, den die Form des Pilzes an ein Aspergill (Weihwassersprenger) erinnerte. Der deutsche Name entstand durch die Ähnlichkeit mit dem Brausekopf einer Gießkanne.
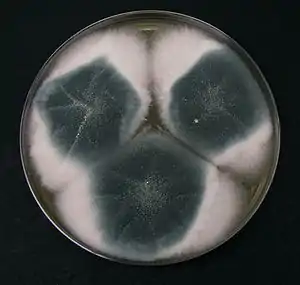
Beschreibung


_-Osterloh-_-Brendel_10f-.jpg.webp)
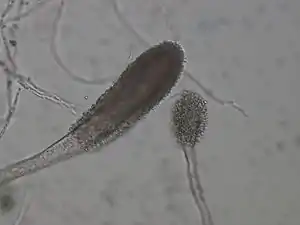
Gießkannenschimmel bilden weißliche, grünliche, schwarze, rote, braune, gräuliche oder gelbe Pilzrasen, die in sogenannten Kolonien wachsen. Diese Kolonien bestehen zunächst aus einem dichten Hyphengeflecht, das Myzel genannt wird. Die Hyphen durchmessen zwischen 3 und 5 Mikrometer und sind in der Länge sehr variabel. Bei A. nidulans sind sie zwischen 110 und 160 Mikrometer lang und in 30 bis 60 Mikrometer lange Kompartimente unterteilt. Dies kann bei anderen Arten, Mutanten oder veränderten Umweltbedingungen aber erheblich abweichen.[1] Das Myzelwachstum ist zunächst exponentiell, verlangsamt sich dann aber fortschreitend. Mit zunehmendem Wachstum verzweigen sich die Hyphen an ihren Spitzen und das typische weitverzweigte Myzel entwickelt sich.[2] Im Alter werfen sich die Kolonien zunehmend auf und Furchen bilden sich. Dabei kann es innerhalb der Kolonie zu Bereichen mit anaerobem Stoffwechsel oder Bereichen, in denen keine Nährstoffe mehr vorliegen, kommen.
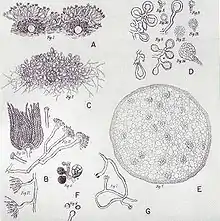
Bei der Fruktifikation bilden sich aspergillartige Konidienträger, die der Vermehrung dienen und an denen Konidiosporen (Konidien) reifen. Die Konidienträger bestehen aus Fußzelle, Konidiophor, Vesikel und Phialiden. Der Begriff Konidiophor wird allerdings uneinheitlich verwendet und gelegentlich synonym zum gesamten Konidienträger verwendet.
Fußzellen
Das erste Anzeichen der Konidiogenese ist das Anschwellen von Zellen innerhalb des Myzels, die dann konidogener Ort genannt werden. Anschließend bilden diese Zellen ein Septum (eine starke Verdickung der Zellwand). Aus jeder dieser sogenannten Fußzellen wächst als Verzweigung senkrecht zur Längsachse der Zelle und üblicherweise annähernd in ihrer Mitte ein einziger Konidiophor. Beim fortschreitenden Wachstum des Konidienträgers verbiegt und verwindet sich die Fußzelle zunehmend. Ihre Verbindung zu den vegetativen Hyphen wird mehr und mehr unscheinbar. Fußzellen können sich sowohl innerhalb des Substrats als auch an Lufthyphen entwickeln. Das Vorhandensein von Fußzellen ist ein recht deutliches Merkmal für die Gattung Aspergillus, allerdings finden sie sich auch in wenigen anderen Gattungen wie etwa Sterigmatocystis.
Konidiophor
Die senkrecht aus der Fußzelle herauswachsende Struktur wird Konidiophor oder einfach Stiel genannt. Er bildet den Konidienkopf aus. Bei nahezu allen Arten ist der Konidiophor unverzweigt, wenige Ausnahmen finden sich allerdings in den Sektionen Aspergillus, Cervini, Sparsi und Cremei. Die Zellwand des Konidiophors ist gleichmäßig oder zur Basis hin zunehmend verdickt. Der Stiel ist häufig unseptiert (ohne innere Trennwände), kann bei einigen Arten aber auch septiert sein. In diesem Fall sind die Septa nur schwach ausgebildet. Die Außenwand des Konidiophors ist glatt oder rau, die Innenwand zeigt häufig unregelmäßige Verdickungen. Bricht ein Konidiophor, ähnelt die Bruchkante meist gebrochenem Glas. Die Farbe variiert zwischen den Arten und die Spanne reicht von grün über gelb bis braun.
Vesikel
Im Fortschreiten der Konidiogenese verdickt sich der Konidiophor an seiner Spitze und bildet ein kugeliges, halbkugelähnliches, ellipsoides oder länglich keulenförmiges Vesikel (auch Blase genannt). Bei einigen Arten aus den Sektionen Cervini, Restricti und Fumigati steht das Vesikel nicht senkrecht zum Konidiophor, sondern ist abgeknickt, bei einigen dieser Arten ist das Vesikel auch gabelförmig. Die Färbung des Vesikels ist häufig intensiver als die des Stiels.
Phialiden
Am Vesikel wachsen kegelförmige Auswüchse, Phialiden genannt. Diese sind zumeist hyalin oder in derselben Farbe wie die Blase. Häufig belegen sie nicht die ganze Oberfläche des Vesikels, sondern wachsen nur auf bestimmten fertilen Flächen. Ihre Zellen haben entweder sehr dünne oder aber stabile Zellwände, die beim Abfallen der Phialiden am Ende der Konidiogenese eingedrückte Spuren im Vesikel hinterlassen.
Die Phialiden stehen entweder nur in einer Lage, oder übereinander in zwei Schichten. In letzterem Fall wachsen aus jedem primären Phialidus, Prophilalidus genannt, zwei oder mehrere sekundäre Phialiden. Diese sitzen kronenförmig, gabelförmig oder wirtelig an der Spitze des Prophilalidus. Ein Phialidus ist an der Basis mehr oder minder zylindrisch und verengt sich dann kegelförmig zu einer Spitze, an der sich ein enger konidienproduzierender Tubus befindet.
Bei fast allen Arten enthält das Vesikel nur einen Zellkern. In den Phialiden entstehen durch Kernteilung mehrere Zellkerne, die dann, falls vorhanden, an die sekundären Philaliden weitergereicht werden. Eine Ausnahme stellt A. brunneus dar, wo die Zellkerne vom Vesikel an die Phialiden weitergegeben werden. Die Zellkerne werden dann in den konidienproduziernden Tubus geschoben und dort nacheinander abgeschnürt. Im Ergebnis entspringt an jedem Tubus eine einzelne, unverzweigte Kette von Konidien.
Konidien
Bei fast allen Aspergillus-Arten enthält jede Konidie nur einen Zellkern. Einige Arten der Sektion Aspergillus produzieren jedoch Konidien mit bis zu 12 Zellkernen. Zumindest bei A. brunneus und A. reptans entstehen diese zusätzlichen Zellkerne durch fortgesetzte Teilung in der jungen Konidie. Für andere Arten ist dies unklar. Auch die bereits abgeschnürten Konidien werden immer noch vom Vesikel mit Nährstoffen versorgt, bis sie vollständig gereift sind. Die Farbe der reifen Konidien variiert über oliv-braun, rot-braun bis hell-grün oder fast gelb, abhängig von der Art. Innerhalb der Kette sind die einzelnen Konidien durch sehr feine Brücken verbunden.
Verbreitung
Gießkannenschimmel sind kosmopolitisch verbreitet. Eine Metaanalyse aus dem Jahr 2002, die 250 andere Studien ausgewertet hatte, kam zu dem Schluss, dass die meisten Arten bevorzugt zwischen dem 26. und dem 35. Breitengrad leben, also in den Subtropen. Dabei scheint sich die Sektion Aspergillus vor allem auf Wüsten spezialisiert zu haben. Die Sektion Ornati hingegen hat ihren Verbreitungsschwerpunkt näher an den gemäßigten Zonen bis zum 45. Breitengrad.[3] Generell gilt, dass die Gießkannenschimmel tropisches Klima bevorzugen, wohingegen Pinselschimmel stärker in den gemäßigten Breiten anzutreffen sind.[4]
Dennoch sind Gießkannenschimmel nicht auf warme Gegenden beschränkt. In Permafrostboden und Eisproben aus der Antarktis wurden mehrere Aspergillus-Arten isoliert. Viele Arten sind auch extrem salztolerant und können gut mit osmotischem Stress umgehen (vergleiche Halophile).[5] A. sydowii lebt sogar als Pathogen auf karibischen Hornkorallen im Meer.[6]
Aspergillus-Konidien sind Bestandteil des Aerosols in der Luft. Eine Langzeitstudie von 1963 bis 1991 in Cardiff maß im Mittel eine Konidienkonzentration zwischen 45 und 110 Sporen pro Kubikmeter Luft. Die gemessene Maximalkonzentration lag bei über 100.000 Sporen in einem Kubikmeter. Dabei ist die Konzentration im Sommer niedriger als im Winter.[7]
Die Sporen können sehr hoch verweht werden. Eine Studie fand Sporen von A. calyptratus noch in 4.100 Meter Höhe. A. niger-Sporen fanden sich bis zu 3.200 Meter, A. glaucus-Konidien bis zu 2.200 Meter und die Sporen von A. fumigatus und A. flavus noch in 1.400 Meter Höhe.[8] Durch den Wind können die Sporen auch sehr weit verweht werden, so wurden beispielsweise Sporen aus der Sahara bis in die Karibik getragen.[6]
Lebenszyklus und Ökologie
Das Leben eines Gießkannenschimmels beginnt in der Regel als Konidie. Selten ist aber auch eine Ascospore von einer zugeordneten Teleomorphe der Ursprung eines Aspergillus. Wenn die Konidien auf eine feste oder flüssige Oberfläche treffen, setzen sie sich dort fest und beginnen dort in Abhängigkeit von Temperatur, Feuchtigkeit, pH-Wert und anderen Verhältnissen zu keimen. Dabei schwillt die Konidie zunächst an und ein Keimfaden wächst aus. Bei den Ascosporen verhält es sich analog. Durch Zellteilung entstehen mehrere verkettete längliche Zellen, die eine Hyphe darstellen. Beim weiteren Wachstum verzweigen sich die Hyphen. Ein Hyphengeflecht in seiner Gesamtheit heißt Myzel. Ist das Wachstum weit genug fortgeschritten und sind genügend Nährstoffe vorhanden, beginnt die Fruktifikation und die Sporenträger entstehen, an denen asexuell Konidien reifen.
Von etlichen Aspergilli ist ein pleomorpher Entwicklungszyklus bekannt, das heißt, dass sie über eine sexuelle Form (Hauptfruchtform, Teleomorphe) und eine asexuelle Form (Nebenfruchtform, Anamorphe) verfügen. Viele Arten sind sogenannte Fungi imperfecti, das heißt, dass unbekannt ist, ob sie sich ausschließlich asexuell vermehren oder die Phase der sexuellen Vermehrung noch unentdeckt ist. Die Bezeichnung einer pleomorphen Pilzart mit all ihren Fruktifikationsformen, Anamorphe und Teleomorphe, ist Holomorphe. Für die Holomorphen soll üblicherweise der Name der Teleomorphe verwendet werden.
Unter bestimmten Umweltbedingungen beginnen einige Aspergillus-Arten mit der sexuellen Vermehrung. Sie bilden Cleistothecien (nahezu runde Ascomata), in denen sich Ascosporen entwickeln. Diese Cleisthotecien sind dann streng genommen keine Organe eines Aspergillus mehr, da die Art nun den Namen der Teleomorphe trägt. Da die anamorphe Gattung Aspergillus zu verschiedenen teleomorphen Gattungen gehört, ist die Gestalt dieser sexuellen Organe sehr verschieden. Zum Beispiel ist bei A. alliaceus das Cleistothecium der Teleomophe Petromyces alliaceus in ein dickwandiges Sklerotium eingebettet. In der Gattung Eurotium, die die teleomophe Gattung zur Sektion Aspergillus ist, sind die Cleistothecien klein, nackt, gelb und sitzen an stielartigen Hyphen. In der Gattung Sektion Emericella (Teleomorphe zur Sektion Nidulantes) sind sie dunkel purpurn und von dickwandigen Hülle-Zellen umgeben.
Die Frage, ob alle Aspergilli über Teleomorphen verfügen, ist ungeklärt und umstritten. Zum Beispiel gehörte A. fumigatus zu den am besten erforschten Gießkannenschimmeln überhaupt, dennoch war es in über 100 Jahren Forschung nicht gelungen, die Hauptfruchtform zu isolieren. Dies nahmen viele Forscher als Hinweis darauf, dass ausschließlich die Nebenfruchtform existiert. Als Céline M. O’Gorman, Hubert T. Fuller und Paul S. Dyer dann im Jahr 2009 die Teleomorphe Neosartorya fumigata entdeckten, relativierte sich dieses Argument aber.[9] Ob wirklich alle Aspergilli der sexuellen Vermehrung fähig sind, ist dadurch aber nicht geklärt.
Ernährung

Eines der hervorstechendsten Charakteristika des Reichs der Pilze (Fungi) ist die Art und Weise, Nährstoffe aufzunehmen. Sie sezernieren Säuren und Enzyme in ihre Umwelt, die die dort vorhandenen Makromoleküle zu einfacheren Verbindungen zersetzen, die dann von den Pilzen aufgenommen werden können. Vereinfacht heißt das, dass Pilze ihre Nahrung erst verdauen und dann aufnehmen. Gießkannenschimmel durchwachsen potentielle Nahrung mit ihrem Hyphengeflecht und zersetzen sie dann zunehmend. Typische Bezeichnungen für diesen Prozess sind Schimmel und Fäulnis.
Viele menschliche Nahrungsmittel sind auch für Aspergillus-Arten attraktiv. Dabei werden auch schwierige Habitate besiedelt. So wurden zum Beispiel Aspergilli der Sektion Aspergillus aus gesalzenem Trockenfisch isoliert.[10] Ein anderer, bislang nicht identifizierter Gießkannenschimmel ist sogar in der Lage, auf gering inkohlter Kohle zu wachsen.[11]
Natürliche Feinde
Eine Vielzahl von Insekten, vor allem Käfer (Coleoptera), fressen Pilze. Dabei haben sich einige Arten auf Gießkannenschimmel als Nahrung spezialisiert. Auf der anderen Seite sind viele Sekundärmetabolite, vor allem Aflatoxine, die von Aspergilli produziert werden, für Insekten stark giftig.
Der Tropische Schimmelplattkäfer (Ahasverus advena) frisst die Konidienköpfe von A. glaucus, meidet jedoch die Ascomata der Teleomorphe. Der Glanzkäfer (Nitidulidae) Carpophilus freemani hat sich ganz auf Aspergillus spezialisiert und frisst kaum etwas anderes.[12] Der Leistenkopfplattkäfer (Cryptolestes ferrugineus) frisst A. fumigatus, A. niger, A. versicolor und A. ochraceus, verschmäht aber A. flavus, der viele Aflatoxine produziert.[13] Der Backobstkäfer Carpophilus hemipterus hingegen hat sich gerade auf solche sehr giftigen Aspergilli spezialisiert. Er ist immun gegen 25 ppm Aflatoxine.[14]
Mykoviren
Eines der ersten Mykoviren überhaupt wurde 1970 in A. foetidus entdeckt. Es handelte sich um ein doppelsträngiges RNA-Virus. Im selben Jahr wurde auch die Übertragung von Virus-like particles in A. niger beschrieben.
Mykoviren können ihre Wirte beeinträchtigen. So wurde beobachtet, dass infizierte A. niger- und A. tubingensis-Kolonien unter stark reduziertem Hyphenwachstum leiden und die Sporenproduktion abnimmt. Infizierte Individuen der Sektion Flavi oder infizierte A. nidulans Kolonien wirkten allerdings wenig beeinträchtigt.
Inzwischen wurden in über 25 verschiedenen Arten von Aspergilli Mykoviren nachgewiesen, dabei traten zwölf verschiedene Viren aus neun Familien auf.[15]
Pathogenität

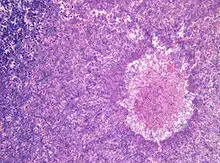
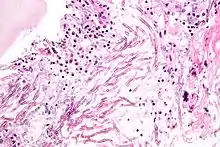
Die Fähigkeit der Gießkannenschimmel, auf vielen verschiedenen Substraten unter einem breiten Spektrum von Umweltbedingungen zu leben, führt dazu, dass einige Arten auch lebende oder tote Gewebe von Menschen oder Tieren bewachsen können. Der Befall von lebendem Gewebe ist der Auslöser verschiedener Krankheiten. Ein solcher Befall ist aber immer zufällig, da alle Aspergillus-Spezies eigentlich Saprobionten sind. Neben dem direkten Befall von Gewebe produzieren viele Aspergillus-Arten giftige oder allergene Sekundärmetabolite.
Historisch
Im Jahr 1748 entdeckte William Arderon einen Pilz, der auf einem lebenden Fisch wuchs. Geoffrey Clough Ainsworth nennt dies die erste Aufzeichnung über einen Pilz als Pathogen auf einem Wirbeltier.[16] Réaumur fand im Jahr 1815 einen ihm unbekannten Schimmel im Luftsack einer Bergente (Aythya marila). Den ersten pathogenen Pilz in einem Menschen entdeckte Franz Unger im Jahr 1833, als er Soor untersuchte. Er hielt den Pilz aber für einen Effekt der Erkrankung und nicht für ihre Ursache.
Im Jahr 1842 entdeckten Rayer und Montagne eine A. candidus-Kolonie im Luftsack eines Gimpels (Pyrrhula pyrrhula). Abbildungen eines Pilzes aus dem Luftsack derselben Art von Deslongchamps aus dem Jahr 1841 (ein Jahr früher) lassen jedoch vermuten, dass es sich um eine Aspergillus-Art handelt. Robin entdeckte 1852 A. fumigatus im Luftsack eines Fasans (Phasianus colchicus).
Der erste Bericht über Aspergillose bei Säugetieren stammt wahrscheinlich bereits aus dem Jahr 1841, als Rousseau und Serrurier Pilze in der Lunge eines Axishirsches (Axis axis) fanden. Leider ist die Beschreibung des Pilzes aber kurz und ungenau. Aspergillose als Erkrankung des Menschen wurde erstmals von Rudolf Virchow im Jahr 1856 beschrieben. Diese Aspergillosen wurden wahrscheinlich durch A. fumigatus verursacht.
Erkrankungen durch A. niger wurden erstmals von Cramer 1859 beschrieben, Erkrankungen durch A. nidulans und A. flavus von Siedemann 1889. A. terreus wurde als Erreger 1922 von Langeron identifiziert.
Infektionen
Infektionen durch Aspergillus-Arten entwickeln sich oft in den Lungen von Säugetieren oder Vögeln. Der bedeutendste Erreger in der Gattung ist Aspergillus fumigatus. Bei gesunden Organismen kann sich als akute Erkrankung ein Aspergillom bilden. Dies ist eine kugelige Kolonie in den Lungen oder den Nasennebenhöhlen, vergleichbar mit einem Pilzball, der sich in das Organ einnistet. Menschen sind vor allem dann gefährdet, wenn Lungenkavernen oder vernarbtes Gewebe aus vorhergegangenen Erkrankungen vorhanden sind, wie zum Beispiel nach einer Tuberkulose. Bei Nutztieren sind Aspergillome häufig.
Wachsen eingeatmete Aspergillus-Sporen in der Lunge aus und sind nicht auf eine kompakte Kolonie beschränkt, entwickelt sich eine akute Aspergillose. In der Lunge bilden sich Hyphen und anschließend Myzel, das schließlich über die Blutbahn im gesamten Körper streut. Es bilden sich Metastasen an den Organen und im zentralen Nervensystem. Bei erwachsenen Menschen mit intaktem Immunsystem kommen akute Aspergillosen nicht vor, bei Kindern sind sie sehr selten. Immunsupprimierte Patienten, zum Beispiel nach einer Knochenmark- oder Stammzelltransplantation oder AIDS-Patienten erkranken aber nicht selten daran. Die invasive Aspergillose ist eine gefährliche Infektion mit einer hohen Letalität im Bereich zwischen 50 % und 95 %.[17] Vor allem Vögel erkranken häufig an akuten Aspergillosen. Bei Küken von Haushühnern wird die Erkrankung Aspergillus-Pneumonie genannt und führt immer wieder zu Massensterben in Zuchtanlagen. Auch bei Wildvögeln treten immer wieder Epidemien auf und wurden unter anderem bei Afrikanischen Straußen (Struthio camelus) und Silbermöwen (Larus argentatus) beobachtet. Bei Papageien (Psittaciformes) treten durch Aspergillus verursachte Lungen- und Luftsackmykosen auf.[18] Unter Säugetieren sind Erkrankungen bei Lämmern häufig, bei Hausrind-Kälbern dagegen sehr selten. Epidemien traten bei Kaninchen und Meerschweinchen (Caviidae) auf. Bei Pferden (Equus) sind vor allem Luftsackmykosen gefürchtet. Diese werden zumeist durch A. fumigatus, aber auch durch andere Aspergilli oder Pilze der Gattungen Penicillium oder Mucor verursacht.[19]
Neben der akuten Aspergillose kann sich auch eine chronische Form der Krankheit entwickeln. Diese folgt entweder einem überstandenen akuten Krankheitsverlauf oder entwickelt sich langsam, ohne zunächst Symptome zu zeigen. Chronische Aspergillosen treten sporadisch bei Pferden, Schafen (Ovis) oder Affen auf. Bei Vögeln sind solche chronischen Formen häufig und insbesondere bei Wasservögeln verbreitet. Bei Pinguinen (Spheniscidae) hat diese Erkrankung erheblichen Einfluss auf den Bruterfolg.
Es gibt keinen Hinweis, dass Aspergillus-Spezies auf Keratin wachsen können. Aus diesem Grund kommen sie als Hautpilze nicht in Frage. Selten wurden bei Haushühnern subkutane Kolonien von A. glaucus gefunden. Bedeutender sind Erkrankungen des Ohres. Aspergillus-Arten können auf Ohrenschmalz, Epithelablagerungen oder Exsudat wachsen und dann das Innenohr schädigen.[20][21] Auch Erkrankungen des Auges sind nicht selten. Dort können Aspergillus-Arten Keratitis, eine Entzündung der Hornhaut, verursachen. Solche Erkrankungen sind vor allem bei Hühnern sehr verbreitet.
Auch Infektionen im Genitaltrakt kommen vor. Bei Rindern und Pferden kann es zu Fehlgeburten durch Aspergillus-Infektionen im Genitalbereich kommen. Beim Menschen wurde nur ein einziger Fall aus dem Jahr 1959 bekannt. Bei Vögeln befallen Aspergillus-Spezies die Eier und zersetzen diese. Bei Hühnereiern stirbt der Embryo in der Regel nach dem sechsten Tag nach der Infektion des Eis.
Einige Aspergillus Arten können als fakultative Endoparasiten in Insekten leben und dabei wahre Tierseuchen auslösen. Die Pilze dringen dabei in die Insekten ein und ernähren sich von der Hämolymphe. A. flavus beispielsweise befällt Schmetterlingsarten wie den Maiszünsler (Ostrinia nubilalis) oder Hyalophora cecropia, wurde aber auch schon in Springschrecken (Orthoptera) nachgewiesen, die wiederum auch regelmäßig von A. parasiticus befallen werden. Wirtschaftlichen Schaden verursachen vor allem A. fumigatus und A. ochraceus, die Honigbienen (Apis) befallen. Auch durch den Befall von Seidenspinnern (Bombyx mori) durch verschiedenen Aspergillus-Arten entsteht immer wieder wirtschaftlicher Schaden.
Zur Behandlung von Infektionen mit Aspergillus-Arten werden verschiedene antimikrobielle Medikamente (Antimykotika) eingesetzt (unter anderem Voriconazol, Caspofungin, Posaconazol oder Itraconazol).[22]
Allergien
Einer der wichtigsten Aspekte der Pathogenität der Aspergilli ist, dass fast alle Arten Allergene produzieren. In Konsequenz kann das Einatmen von Sporen allergische Reaktionen auslösen.
Durch Aspergillus ausgelöste Allergien betreffen fast ausschließlich den Atmungsapparat, sehr selten wird aber auch von leichten Hautreaktionen berichtet. Eine leichte Form wird Aspergillus Asthma genannt. Schwerere Formen sind die Allergische bronchopulmonale Aspergillose, bei der die Lunge stark von eosinophilen Granulozyten besiedelt wird.
Eine chronische Form ist die sogenannte Farmerlunge, die zu einer Vernarbung des Lungengewebes (Lungenfibrose) führen kann.
Toxikosen
.JPG.webp)
Aspergillus-Arten bilden sowohl Endotoxine als auch Exotoxine. Diese sind für Menschen und Tiere von großer Bedeutung, weil die saprobiontischen Pilze auch auf Nahrung gedeihen können und so in den Organismus gelangen. Solche Vergiftungen werden Aspergillustoxikosen oder auch Aspergillotoxikosen genannt.
Spezies aus der Sektion Clavati produzieren vor allem Patulin. Dieses Gift kommt als Verunreinigung häufig in verschimmeltem Obst, Gemüse, Getreide und anderen Lebensmitteln sowie in schimmelnder Maissilage vor; wichtigste Kontaminationsquelle sind jedoch Äpfel und Apfelerzeugnisse, häufig Apfelsaft. Da Patulin auch in Früchten auftreten kann, die äußerlich nicht sichtbar beschädigt oder verdorben sind, lässt sich die Kontamination durch Entfernen aller sichtbar beschädigten oder verdorbenen Früchte nicht völlig eliminieren.[23] Die letale Dosis LD50 liegt bei 25 bis 35 Milligramm Sporen pro Kilogramm Körpergewicht bei Mäusen.[24] Sporen aus der Sektion Nigri sind nur schwach giftig, sie enthalten große Mengen Oxalsäure. Auch Pilze aus der Sektion Aspergillus sind nur schwach giftig.
Bedeutender sind die Pilze aus der Sektion Fumigati, sie produzieren vor allem drei Toxine: Fumigatin, Helvolsäure und Gliotoxin. Die letale Dosis LD50 liegt bei Mäusen bei 1,5 Milligramm pro Kilogramm Körpergewicht.[25]
Noch deutlich giftiger sind Arten aus der Sektion Flavi, sie produzieren eine Vielzahl von Aflatoxinen, vor allem Dehydrofurane. Bei Hunden liegt die letale Dosis LD50 bei 200 Mikrogramm pro Kilogramm Körpergewicht, bei Vögeln ist sie noch bedeutend niedriger.[26] Die hohe Giftigkeit von A. flavus ließ in den 1980ern die Theorie aufkommen, dass die Art von den alten Ägyptern zum Schutz ihrer Gräber verwendet wurde und sie für den sogenannten Fluch des Pharao verantwortlich sei.[27]
Die Gifte von A. flavus sind für fast alle Insekten tödlich, aber auch Pilzarten, die keine Aflatoxine enthalten, können Insekten gefährlich werden. Zum Beispiel ist Kojisäure, die von vielen Arten, vor allem aber von A. flavus produziert wird, für den Seidenspinner (Bombyx mori) giftig. A. parasiticus tötet die Schmierlaus (Pseudococcidae) Saccharicoccus sacchari unabhängig davon, ob es sich um den Wildtyp oder eine Mutante, die keine Aflatoxine produzieren kann, handelt.
Die Mykotoxine aus den Sektionen Clavati, Fumigati und Flavi sind neben den direkten schädlichen Wirkungen stark krebserregend (karzinogen).
Aspergillus als Pflanzenpathogen

Neben Tieren und Menschen können Aspergilli auch Pflanzen als Phytopathogen schädigen. János Varga listet in seiner Arbeit aus dem Jahr 2004 insgesamt 30 wichtige durch Aspergillus-Spezies ausgelöste Pflanzenkrankheiten und über 50 Wirtspflanzen auf.[28] Einige wichtige Krankheiten sind zum Beispiel die Chlorose bei Mandeln (Prunus dulcis), die durch A. niger verursacht wird, oder Albinismus bei Zitruspflanzen (Citrus), ausgelöst durch A. flavus.
Auch die Schwarzfäule der Speisezwiebel und die Erdnuss-Kronenfäule, die regelmäßig große wirtschaftliche Schäden verursacht, sind Infektionen durch A. niger. Auch der im Weinbau gefürchtete Weinkrebs wird durch dieselbe Art ausgelöst. A. fischerianus hingegen befällt bevorzugt Storchschnäbel (Geranium), wohingegen beispielsweise A. aculeatus auch Weinreben (Vitis vinifera) bewohnt.
Gleich eine Vielzahl von Aspergilli befällt Kaffeepflanzen (Coffea). Auf diesem Weg gelangen auch viele Mykotoxine in die menschliche Nahrung. Vor allem bei der Baumwollproduktion verursacht A. flavus regelmäßig große Schäden.[29]
Genetik
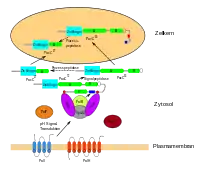
Guido Pontecorvo begann sich um 1950 für die Genetik von A. nidulans zu interessieren. Er beschrieb 1952 erstmals die parasexuelle Fortpflanzung der Art und erkannte dabei den Mechanismus, wie zwei haploide Zellkerne spontan zu einem mitotischen Diploid fusionieren. Haben die Zellkerne eine unterschiedliche genetische Konstitution, so ist der gebildete Kern heterozygot für bestimmte Gene. In der diploiden Phase kann es nun zur Rekombination homologer Chromosomen kommen. Danach entstehen durch den schrittweisen Verlust von Chromosomen im Verlauf einer Reihe von Zellteilungen wieder haploide Kerne. So können sich Anamorphen, ohne die Möglichkeit der Sexualität, veränderten Umweltbedingungen anpassen.
Obwohl die Parasexualität in einer Art entdeckt wurde, zu der auch eine Teleomorphe (Emericella nidulans) mit Sexualität im engeren Sinne existiert, wurde die Transformation schnell zu einer Alternative zur Kreuzung in der Aspergillus-Genetik. So wurden – lange bevor rekombinante DNA verfügbar wurde – durch Ausnutzung der Parasexualität bereits genetische Marker rekombiniert. Schnell wurde A. nidulans zum bedeutendsten eukaryotischen Modellorganismus überhaupt.
Die ersten genetischen Arbeiten zum Zellzyklus wurden ebenfalls an A. nidulans durchgeführt. Auch die Erkenntnisse über die Katabolitrepression, die Stickstoff-Katabolitrepression, die pH-Regulation, das polare Wachstum, die Signaltransduktion und die Morphogenese myzelbildender Mikroorganismen wurden durch Arbeiten am Modellorganismus A. nidulans fundamental vorangetrieben. Als ein wichtiges Ergebnis wurde beispielsweise γ-Tubulin an einer A. nidulans-Mutante entdeckt.[30]
Im Jahr 2003 wurde die komplette DNA-Sequenz des Genoms von A. nidulans veröffentlicht. Im Dezember 2005 wurden in einer einzigen Ausgabe von Nature zusammen die Sequenzen von A. fumigatus, A. flavus und A. oryzae (= A. flavus var. oryzae) publiziert. Diese simultane Veröffentlichung von gleich drei Genomen machte Aspergillus schnell zur bedeutendsten Gattung für vergleichende Genomik der Pilze überhaupt. Zudem zeigte sich eine starke Heterogenität innerhalb der Gattung.[31] Im Jahr darauf folgte die komplette Sequenz von A. niger. Das kleinste bislang sequenzierte Aspergillus-Genom ist das von A. fumigatus mit 29,3 Megabasenpaaren (Mb), das größte das von A. flavus var. oryzae mit 37,1 Mb. A. fumigatus verfügt über 9.926 Gene, wohingegen A. flavus var. oryzae 12.071 Gene hat. Die Größe des Genoms von A. niger liegt mit 33,9 Mb zwischen den beiden anderen Arten.[32]
Für A. nidulans, A. fumigatus, A. flavus und A. oryzae existieren inzwischen vollgenomische Microarrays. Bislang wurden vor allem Studien zur Optimierung von Fermentern und zu verschiedenen Sekundärmetaboliten angefertigt.[33]
Systematik
Der Name Gießkannenschimmel stammt von der Form der Konidienträger. Diese sehen unter dem Mikroskop dem Brausekopf einer Gießkanne oder einem Staubwedel ähnlich.[34] Auch der wissenschaftliche Name Aspergillus leitet sich von der Form der Konidienträger ab.
Mykologische Geschichte

Verschiedene Schimmel waren ständig in der menschlichen Umwelt präsent. Vor der Entwicklung des Lichtmikroskops um 1600 war die Beschreibung aber auf die Farben der Kolonien begrenzt. Pier Antonio Micheli war der Erste, der im Jahr 1729 Sporen und Sporenträger unter dem Mikroskop untersuchte. Er beobachtete, dass die Sporenketten radial von einer zentralen Achse abstanden. Die Struktur erinnerte ihn an ein Aspergill, ein liturgisches Gerät, das zum Besprengen mit Weihwasser genutzt wird. Deswegen verwendete er den Namen Aspergillus für die von ihm beobachteten Schimmel.
Micheli fasste den Begriff Aspergillus aber sehr weit und beschrieb fast alle von ihm beobachteten Schimmel als Aspergillus. Diese sehr breite Auffassung der Gattung hielt sich sehr lange. Zum Beispiel beschrieb Albrecht von Haller noch im 18. Jahrhundert mehrere Aspergillus-Arten, die dann später anderen Gattungen, wie beispielsweise Sporodina zugeordnet wurden. Christian Hendrik Persoon hingegen lehnte in seinen Werken aus den Jahren 1797 und 1801 die Gattung Aspergillus in Gänze ab und schlug sie der von ihm beschriebenen und sehr breit gefassten Gattung Monilia zu, da er die Sporenketten als Aneinanderreihung von holoblastischen Monilia-Konidien auffasste.
Heinrich Friedrich Link wiederum lehnte diese Auffassung von Persoon ab, da er der Meinung war, dass die Form der Sporenketten direkt aus dem Vorhandensein eines Konidiophors resultiert. Jedoch ist die Beschreibung der Konidienträger bei Link sehr ungenau, was wohl auch an den schlechten Herbarbelegen, die ihm zur Verfügung standen, lag. Die erste genaue Beschreibung des Konidiophors und der enteroblastischen Konidien fand sich um 1828 bei August Karl Joseph Corda. Seine Beschreibungen waren sehr genau, aber kompliziert und unverständlich, so dass es um 1850 wohl nur eine Handvoll Menschen gab, die Aspergillus-Arten bestimmen konnten. Im Jahr 1856 klagte Montagne, dass jeder Schimmel, den er betrachte, eine neue Art darstelle.
Im Jahr 1854 entdeckte Anton de Bary, dass die Konidien von Aspergillus glaucus und die Cleistothecien der von Link beschriebenen Art Eurotium herbariorum demselben Myzel entspringen. Dieser Befund wurde von Fresenius, Cramer und Oscar Brefeld bestätigt.
Victor Félix Raulin und van Tieghem begannen 1860 in Frankreich mit der Herstellung von Gallussäure durch Fermentation von Pflanzengallen und studierten die beteiligten Schimmel. Carl Friedrich Wilhelm Wehmer veröffentlichte 1901 die erste umfassende Monografie Ueber einige neue Aspergillus Arten. Im Jahr 1926 erschien The Aspergilli von Charles Thom und Margaret Brooks Church, in diesem Werk wurde die Gattung erstmals in Gruppen geteilt. Die Monografie beschreibt 350 Arten in elf Gruppen.
Inzwischen waren sehr viele kleinere Artikel über die Gattung erschienen und die Situation war sehr unübersichtlich. Hiroshi Tamiya und Tatsuyoshi Morita zitierten in ihrem Werk Bibliografie von Aspergillus, 1729 bis 1928 bereits 2.424 einzelne Artikel. Von diesen waren nur 115 älter als de Barys Aufsatz von 1854, 309 Artikel erschienen bis 1891 und die restlichen 2000 zwischen 1891 und 1928.
Im Jahr 1929 erschien System und Phylogenie von Adalbert von Blochwitz. Er schlägt eine ganz andere Einteilung der Gruppen als Thom und Church vor. George Smith fertigte im Jahr 1938 erstmals systematisch Mikrofotografien von vielen Arten an. In den 1940er Jahren wurde die Forschung an der Gattung Aspergillus nochmals intensiviert. Einige Arten wurden bereits industriell zur Herstellung verschiedener organischer Säuren verwendet und auch das pathogene Potential der Pilze rückte zunehmend in das Interesse der Wissenschaftler. Im Jahr 1945 erschien A Manual of the Aspergilli von Charles Thom und Kenneth B. Raper. Die Monografie enthielt Beschreibungen von 80 Arten, zehn Varietäten und 14 Gruppen. Kenneth B. Raper veröffentlichte dann 1965 zusammen mit Dorothy I. Fennel das Buch The Genus Aspergillus, das 132 Arten in 18 Gruppen enthielt.
Die innere Systematik der Gattung entwickelte sich weiter, als Robert A. Samson und John I. Pitt im Jahr 1985 das Werk Advances in Penicillium and Aspergillus Systematics herausgaben. Sie waren unzufrieden mit dem taxonomisch nicht definierten Begriff der Gruppen, die Thom und Church eingeführt hatten und teilten die Gattung in sechs Untergattungen und 16 Sektionen. Diese Ansicht vertieften sie noch einmal in ihrem Werk Modern Concepts in Penicillium and Aspergillus Classification, das die beiden im Jahr 2000 herausgaben.
Im Jahr 2002 erschien eine Art Bestimmungsschlüssel für Gießkannenschimmel, wenngleich mit molekularbiologischen Markern, unter dem Titel Identification of Common Aspergillus Species. Im Jahr 2008 gaben Samson und János Varga das Werk Aspergillus Systematics in the Genomic Era heraus, in dem sie die taxonomische Einteilung noch einmal bearbeiteten. Schlussendlich erschien im Februar 2010 das von Masayuki Machida und Katsuya Gomi herausgegebene Werk Aspergillus: Molecular Biology and Genomics, in dem stärker darauf hingewiesen wird, dass es sich bei den Aspergilli nicht um eine klassische Gattung, sondern um ein Formtaxon handelt. Dennoch wird die Einteilung von Samson und Pitt in Untergattungen und Sektionen auch in diesem Werk beibehalten.
Äußere Systematik
Wird Aspergillus als Formtaxon betrachtet, werden die Gießkannenschimmel auch nicht als Verwandtschaftsgruppe angesehen, sie sind in dieser Lesart vielmehr ein gemeinsamer Organisationstyp.
Wird Aspergillus hingegen als Gattung betrachtet, steht sie in der Familie der Trichocomaceae. David Malloch teilte diese Familie 1985 in zwei Unterfamilien, die Trichocomiideae mit den anamorphen Gattungen Penicillium und Paecilomyces sowie die Dichlaenoideae mit den Anamorphen Aspergillus, Penicillium, Merimbla, Paecilomyces und Polypaecilum.[35] Dass dieselben Anamorphen in beiden Unterfamilien vorkommen, zeigt bereits, dass es sich hierbei nicht um monophyletische Gruppen handelt.
Eine Untersuchung aus dem Jahr 1995, die neben morphologischen Merkmalen auch die ribosomale DNA betrachtete, ergab die Gattungen Monascus und Eupenicillium als nächste Verwandte der Gießkannenschimmel. Die Studie lässt auch vermuten, dass es sich bei den Aspergilli um eine monophyletische Gruppe handeln könnte.[36] Drei Jahre später untersuchte eine japanische Forschergruppe die Phylogenie anhand der 18S rRNA. Im Ergebnis wurden die anamorphen Gattungen Penicillium und Geosmithia als nächste Verwandte der Aspergilli bestimmt. Auch diese Studie legt die Monophylie der Gruppe Aspergillus in der Familie der Trichocomaceae sensu Malloch und Cain 1972 nahe.[37] Eine neuere molekulargenetische Untersuchung aus dem Jahr 2000 kommt zu dem Schluss, dass es sich bei den Gießkannenschimmeln nicht um eine monophyletische Gruppe handelt. Dennoch konnte die Frage bis heute (Stand März 2010) nicht abschließend geklärt werden.[38]
Nomenklatur
Der Status der Aspergilli ist höchst umstritten. Probleme macht vor allem, dass diese Gruppe morphologisch so eindeutig zusammengehört, die sexuellen Formen aber in insgesamt elf Gattungen zerfallen. Der Umgang mit der Situation ist nicht eindeutig geklärt. Der Internationale Code der Botanischen Nomenklatur hat im Jahr 1910 in Paragraph 59 geregelt, dass in diesem Fall zwei Namen für eine Art vergeben werden dürfen, nämlich einer für die Anamorphe und einer für die Teleomorphe. Diese Regel ist auch heute (Stand 2010) noch gültig. Im Jahr 2003 wurde jedoch der Vorschlag eingebracht, diese duale Nomenklatur zu verwerfen und einer Art auch nur noch einen Namen zuzugestehen, dann würde jeweils der Gattungsname der Teleomorphe verwendet werden. Für viele Gießkannenschimmel ist die Teleomorphe jedoch unbekannt oder sogar inexistent. Für diesen Fall wurde vorgeschlagen, die Arten in die wahrscheinliche teleomorphe Gattung zu überführen, auch wenn die Teleomorphe tatsächlich unbekannt ist.[39]
Ein anderer Vorschlag geht dahin, die Aspergilli als Formtaxon zu behalten und den Namen Aspergillus für solche Arten, bei denen die Teleomorphe unbekannt ist, vorläufig beizubehalten.
Innere Systematik
Stephen W. Peterson, Janos Várga, Jens C. Frisvad und Robert A. Samson unterteilten die Aspergilli 2008 in acht Untergattungen und 22 Sektionen. Diese Einteilung wurde nach molekulargenetischen Gesichtspunkten getroffen, deckt sich aber gut mit der Einteilung von Kenneth B. Raper und Dorothy I. Fennel nach morphologischen Kriterien aus dem Jahr 1965. Auch einige Sektionen, die nach 1965 nach chemischen Gesichtspunkten (Sekundärmetabolite) angelegt wurden, blieben erhalten. Masayuki Machida und Katsuya Gomi übernahmen in ihrer Monografie aus dem Jahr 2010 diese Einteilung.
Bei dieser Untersuchung wurden auch die Verwandtschaftsverhältnisse zwischen den einzelnen Sektionen bestimmt. Sie sind in folgendem Kladogramm dargestellt:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die Aspergillus-Arten sind mit Teleomorphen aus insgesamt elf Gattungen verknüpft. Diese sind:
- Chaetosartorya Subram.
- Emericella Berk.
- Eurotium Link
- Fennellia B.J.Wiley et E.G.Simmons
- Hemicarpenteles A.K.Sarbhoy et Elphick
- Hemisartorya J.N.Rai et H.J.Chowdhery
- Neocarpenteles Udagawa et Uchiy.
- Neopetromyces Frisvad et Samson
- Petromyces Malloch et Cain
- Sclerocleista Subram.
- Warcupiella Subram.
Die meisten Aspergillus-Sektionen bilden genau auf eine teleomorphe Gattung ab, umgekehrt bilden die teleomorphen Gattungen nicht notwendigerweise auf eine Aspergillus-Sektion ab. Eine Ausnahme im ersteren Sinn ist die Sektion Ornati, in der sich Hauptfruchtformen aus den Gattungen Sclerocleista und Hemicarpenteles finden. Wahrscheinlich handelt es sich bei den Hemicarpenteles aber ebenfalls um Sclerocleista, die in diese Gattung übertragen werden können.
Eine ähnlich gelagerte Ausnahme tritt in der Sektion Clavati auf. So wie es viele Gießkannenschimmel gibt, zu denen die Anamorphe unbekannt ist, gibt es auch eine Zahl von Teleomorphen aus den Aspergillus zugeordneten Gattungen, zu denen die Anamorphen unbekannt sind. Ein besonderer Fall ist die Art Dichotomomyces cejpii; eine molekulargenetische Untersuchung zeigte, dass die Art sehr nah mit den Arten der Sektion Clavati verwandt ist und ihr zugeordnet werden müsste. Die Anamorphe zu der Art ist aber bislang unbekannt. Selbiges gilt für die Art Penicilliopsis clavariaeformis und die Sektion Zonati.
Die Gruppe Aspergillus ist sehr artenreich und noch nicht endgültig erforscht. Viele der Arten sind unsicher oder umstritten. Ein Grund hierfür ist, dass bei vielen Arten keine oder unbrauchbare Typusexemplare vorliegen. Vor allem bei den Arten, die im 18. und 19. Jahrhundert beschrieben wurden, wurden gar keine oder ungenügende Typusexemplare angelegt, oder diese gingen später verloren. Auch sind die alten Erstbeschreibungen oft kurz und nach heutigen Maßstäben ungenügend, so dass nicht mehr eindeutig geklärt werden kann, ob der Status als eigenständige Art zurecht besteht.
Wenn auf der anderen Seite aber Typusexemplare angelegt wurden, sind die Sporen zwar nach so langer Lagerzeit nicht mehr keimfähig, aber immer noch intakt, so dass sie molekulargenetisch ausgewertet werden können. Auf diese Art und Weise konnten bereits einige taxonomische Fragen geklärt werden. In einigen Fällen war es auch möglich, einen Neotyp zu definieren.
Die Molekulargenetik hatte einen sehr großen Einfluss auf die Systematik der Gießkannenschimmel. Viele Verwandtschaftsverhältnisse konnten geklärt werden, Varietäten wurden zu Arten heraufgestuft oder Arten zu Varietäten herabgestuft. Das bekannteste Beispiel ist wohl A. oryzae. Die äußerst bekannte Art, die in der Fermentation verwendet wird, wurde nach einer molekulargenetischen Untersuchung zu einer Varietät A. flavus var. oryzae herabgestuft.[40] Dennoch ist der Name A. oryzae heute noch sehr verbreitet.
Aktuell (Stand März 2010) gibt es 355 gültige Aspergillus-Arten, davon sind 354 rezent. Die fossile Art A. collembolorum wurde 2005 eingeschlossen in einem Bernstein entdeckt.[41] Die Typusart der Gießkannenschimmel ist Aspergillus glaucus, die Arten und ihre Zuordnung sind:[42][43][44][45][46]
| Arten der Gattung Aspergillus | |
|---|---|
| Anamorphe | Teleomorphe |
| Untergattung Aspergillus | |
|
|
|
Eurotium herbariorum (F.H. Wiggers) Link |
|
Eurotium appendiculatum Blaser |
|
Eurotium athecium (Raper et Fennell) Arx |
|
Eurotium latericium Mont. |
|
Eurotium echinulatum Delacr. |
|
Eurotium carnoyi Malloch et Cain |
|
– |
|
Eurotium costiforme H.Z.Kong et Z.T.Qi |
|
Eurotium cristatum (Raper et Fennel) Malloch et Cain |
|
Eurotium chevalieri L.Mangin |
|
– |
|
– |
|
– |
|
Eurotium pseudoglaucum (Blochwitz) Malloch et Cain |
|
Eurotium niveoglaucum (Thom et Raper) Malloch et Cain |
|
– |
|
– |
|
– |
|
Eurotium heterocaryoticum C.M.Chr., L.C.López et C.R.Benj. |
|
Eurotium intermedium Blaser |
|
Eurotium leucocarpum Hadlok et Stolk |
|
– |
|
Eurotium medium R.Meissn. |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
Eurotium carnoyi Malloch et Cain |
|
– |
|
– |
|
Eurotium parviverruculosum H.Z.Kong et Z.T.Qi |
|
Eurotium proliferans G.Sm. |
|
– |
|
Eurotium repens de Bary |
|
Eurotium rubrum Jos.König |
|
– |
|
– |
|
Eurotium spiculosum Blaser |
|
– |
|
Eurotium subgriseum Peck |
|
Eurotium taklimakanense Abliz et Y.Horie |
|
Eurotium testaceocolorans Novobr |
|
Eurotium tonophilum Ohtsuki |
|
Eurotium tuberculatum Z.T.Qi et Z.M.Sun |
|
– |
|
Eurotium amstelodami L.Mangin |
|
Eurotium xerophilum Samson et Mouch. |
|
|
|
– |
|
– |
|
– |
|
– |
|
– |
|
Eurotium halophilicum C.M.Chr., Papav. et C.R.Benj. |
|
– |
|
– |
| Untergattung Fumigati | |
|
|
|
Neosartorya fumigata O'Gorman, Fuller et Dyer[9] |
|
– |
|
Neosartorya aureola (Fennell et Raper) Malloch et Cain |
|
– |
|
Neosartorya coreana S.B.Hong, Frisvad et Samson |
|
– |
|
Neosartorya fennelliae Kwon-Chung et S.J.Kim |
|
Neosartorya fischeri (Wehmer) Malloch et Cain |
|
– |
|
– |
|
– |
|
|
|
Neosartorya galapagensis Frisvad, Hong et Samson |
|
– |
|
– |
|
Neosartorya hiratsukae Udagawa, Tsub. et Y. Horie |
|
Neosartorya aurata (Warcup) Malloch et Cain |
|
Neosartorya indohii Y.Horie |
|
Neosartorya laciniosa S.B.Hong, Frisvad et Samson |
|
– |
|
– |
|
Neosartorya multiplicata Yaguchi, Someya et Udagawa |
|
Neosartorya glabra (Fennell et Raper) Kozakiewicz |
|
Neosartorya nishimurae Takada, Y.Horie et Abliz |
|
– |
|
Neosartorya stramenia (Novak et Raper) Malloch et Cain |
|
Neosartorya quadricincta (E.Yuill) Malloch et Cain |
|
Neosartorya spathulata Takada & Udagawa |
|
Neosartorya sublevispora Someya, Yaguchi et Udagawa |
|
– |
|
Neosartorya takakii Y.Horie, Abliz et K.Fukush. |
|
Neosartorya tatenoi Y.Horie, Miyaji, Koji Yokoyama, Udagawa et Camp.-Takagi |
|
Neosartorya pseudofischeri S.W.Peterson |
|
Neosartorya tsurutae Y.Horie |
|
– |
|
Neosartorya udagawaeY.Horie, Miyaji et Nishim. |
|
– |
|
– |
|
– |
|
|
|
– |
|
– |
|
– |
|
– |
|
– |
|
|
|
– |
|
Neocarpenteles acanthosporum (Udagawa et Takada) Udagawa et Uchiyama |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
| Untergattung Ornati | |
|
|
|
Sclerocleista ornata (Raper, Fennell et Tresner) Subram. |
|
– |
|
Hemicarpenteles thaxteri (Subramanian) Arx |
|
Hemisartorya maritima Rai et Chowdheri |
| Untergattung Nidulantes | |
|
|
|
Emericella nidulans (Eidam) Vuillemin |
|
Emericella acristata (Fennell et Raper) Subramanian |
|
– |
|
– |
|
– |
|
Emericella bicolor M. Chr. et States |
|
– |
|
Emericella corrugata Udagawa et Y.Horie |
|
– |
|
Emericella dentata (Sandhu et Sandhu) Horie |
|
Emericella discophora Samson, Zalar et Frisvad |
|
– |
|
Emericella falconensis Y. Horie, Miyaji, Nishim. et Udagawa |
|
Emericella filifera Zalar, Frisvad et Samson |
|
Emericella foeniculicola Udagawa |
|
Emericella foveolata Y.Horie |
|
Emericella fruticulosa (Raper et Fennel) Malloch et Cain |
|
Emericella parvathecia (Raper et Fennel) Malloch et Cain |
|
Emericella miyajii Y.Horie |
|
Emericella montenegroi Y. Horie, Miyaji et Nishim. |
|
– |
|
– |
|
Emericella navahoensis M.Chr. et States |
|
Emericella olivicola Frisvad, Zalar et Samson |
|
Emericella omanensis Y.Horie et Udagawa |
|
– |
|
Emericella purpurea Samson et Mouch. |
|
Emericella qinqixianii Y.Horie, Abliz et R.Y.Li |
|
– |
|
Emericella rugulosa (Raper et Fennel) C.R.Benjamin |
|
Emericella spectabilis M.Chr. et Raper |
|
– |
|
Emericella stella-maris Zalar, Frisvad et Samson |
|
Emericella variecolor Berk. et Broome |
|
Emericella striata (Rai, Tewari et Mukerji) Malloch et Cain |
|
Emericella sublata Y.Horie |
|
– |
|
– |
|
Emericella quadrilineata (Thom et Raper) C.R.Benjamin |
|
– |
|
Emericella undulata H.Z.Kong et Z.T.Qi |
|
Emericella unguis Malloch et Cain |
|
Emericella unguis Malloch et Cain |
|
– |
|
Emericella venezuelensis Frisvad et Samson |
|
– |
|
Emericella violacea (Fennel et Raper) Malloch et Cain |
|
|
|
– |
|
– |
|
|
|
– |
|
– |
|
|
|
– |
| |
|
– |
|
– |
|
– |
|
– |
|
– |
|
Emericella heterothallica (Kwon et al) Malloch et Cain |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
|
|
– |
|
|
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
|
|
– |
|
– |
| Untergattung Terrei | |
|
|
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
|
|
Fennellia flavipes B.J.Wiley et E.G.Simmons |
|
– |
|
Fennellia nivea (B.J.Wiley et E.G.Simmons) Samson |
|
– |
|
– |
| Untergattung Circumdati | |
|
– |
|
|
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
Neopetromyces muricatus (Udagawa, Uchiyama et Kamiya) Frisvad et Samson |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
|
|
– |
|
– |
|
Petromyces albertensis J.P.Tewari |
|
Petromyces alliaceus Malloch et Cain |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
Petromyces parasiticus B.W.Horn, I.Carbone et J.H.Ramirez-Prado[61] |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
|
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
|
|
Chaetosartorya cremea (Kwon-Chung et Fennell) Subramanian |
|
– |
|
Chaetosartorya chrysella (Kwon-Chung & Fennell) Subramanian |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
Chaetosartorya stromatoides B.J.Wiley et E.G.Simmons |
|
– |
|
– |
| Untergattung Warcupi | |
|
|
|
Warcupiella spinulosa (Warcup) Subramanian |
|
|
|
– |
|
– |
| Untergattung Candidi | |
|
|
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
| ohne Zuordnung | |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
|
– |
Industrielle Nutzung


Seit über 1.500 Jahren werden A. flavus var. oryzae, A. sojae und andere nah verwandte Arten in großen Teilen Asiens zur Fermentation von Nahrungsmitteln verwendet.
In Japan sind die Pilze unter dem Namen Kōji (jap. 麹) bekannt. Durch Fermentation von Soja mittels Kōji wird beispielsweise Miso oder Sojasauce erzeugt. Dabei wächst das Myzel durch das Substrat und die Aspergillus-Spezies schüttet Enzyme und organische Säuren durch die Zellwände aus. Die Enzyme zersetzen die Kohlenhydrate und Eiweiße aus dem Substrat teilweise und verändern den Geschmack. Ähnliche Verfahren der Fermentation mit Aspergilli sind auch in anderen Ländern der Region verbreitet, so heißen verschiedene Sojapasten in der Volksrepublik China jiàng (酱). Ein Beispiel ist die gelbe Sojapaste huángjiàng (黄酱), die vor allem in der Gegend um Peking gegessen wird. In Korea sind verschiedene auf diese Weise fermentierte Pasten verbreitet und werden unter dem Namen jang (醬, Hangeul 장) gehandelt. Auch in Indonesien und Thailand werden ähnliche Pasten konsumiert, in Vietnam heißen sie Tương. Ganze fermentierte Sojabohnen werden in Thailand tao-tjo, genannt. Eine fermentierte Fischsauce aus Thailand heißt nam pla (น้ำปลา).
Eine andere Verwendung von Gießkannenschimmeln ist die Fermentation von Reis mittels A. oryzae für Sake oder mittels eines weißen Kōji Aspergillus kawachii für Shōchū. Awamori (jap. 泡盛) ist eine andere Spirituose, die vor allem in Okinawa hergestellt wird, aber in ganz Südostasien verbreitet ist. Zur Herstellung wird ein schwarzer Kōji Aspergillus awamori benutzt.
Der japanische Wissenschaftler Jōkichi Takamine brachte im späten 19. Jahrhundert Kōji in die Vereinigten Staaten. Dort entzog er dem Pilz durch Alkohol Enzyme und vermarktete das Ergebnis unter dem Namen Takadiastase als Heilmittel gegen Verdauungsbeschwerden. Im Jahr 1894 ließ er das Verfahren patentieren und erhielt damit das erste US-Patent auf ein mikrobiologisches Enzym überhaupt.
Im Jahr 1895 entwickelte Albert Boidin in Frankreich ein Verfahren zur Herstellung von Alkohol, in dem er mit Aspergillus sp. geimpftes Getreide verkochte. Weitere Pioniere auf dem Gebiet der industriellen Nutzung von Aspergillus waren Leo Wallenstein und Otto Röhm, die als erste Enzyme isolierten und technisch verwerteten.
Die drei weltgrößten Unternehmen auf dem Gebiet der Fermentation, DSM, Novozymes und Genecor-Danisco, geben an, dass Aspergillus ihre wichtigsten Organismen sind. Für DSM ist dies A. niger und für Novozymes A. flavus var. oryzae.
Citronensäureproduktion
Carl Wehmer entdeckte 1891, dass A. niger bei Abbau von Zucker nicht geringe Mengen von Oxalsäure produziert, dabei entsteht auch etwas Citronensäure. Diese Entdeckung war zunächst nicht besonders aufsehenerregend, da Oxalsäure bereits günstiger produziert werden konnte.[68] Im Jahr 1917 verfeinerte James N. Currie das Verfahren und schuf die Möglichkeit der industriellen Produktion von Citronensäure aus A. niger. Currie vermarktete seine Idee an die Pfizer Inc., die das Verfahren weiterentwickelte. Bis dahin wurde Citronensäure aus Zitronen (Citrus × limon) hergestellt und Italien hatte ein wirtschaftliches Monopol auf das Produkt.[69] Heute stammt fast 100 Prozent der verwendeten Citronensäure aus A. niger, bei einer Weltproduktion von 1,6 Millionen Tonnen pro Jahr (Stand 2007) und wird in großen Bioreaktoren erzeugt.[70]
Citronensäure und ihre Salze werden zur Konservierung und als Säuerungsmittel von Lebensmitteln verwendet, beispielsweise in Getränken. Sie wird insbesondere in Limonaden und Eistees verwendet und ist in der Europäischen Union als Lebensmittelzusatzstoff der Nummer E 330 zugelassen. Verwendung findet Citronensäure aber auch in Reinigungsmitteln, in der Kosmetik und in der Medizin.
Andere Sekundärmetabolite
Heute werden über 100 verschiedene Enzyme industriell aus Aspergilli hergestellt.[71] Wichtige Gruppen sind Amylasen, Katalasen, Cellulasen, Lipasen, Phytasen und Xylanasen.[72]
Wichtige Sekundärmetabolite von A. niger sind des Weiteren Gluconsäure, die als Lebensmittelzusatz (E 574), als Metallbeizmittel und in der Medizin als Eisengluconat bei der Behandlung von Eisenmangel eingesetzt wird, sowie Itaconsäure, die als Comonomer für die Synthese von Polyacrylaten und Gummi verwendet wird. Auch Cyanocobalamin (Vitamin B12) wird mit Hilfe von A. niger hergestellt.[69]
Kojisäure wird vor allem mit Hilfe von A. flavus gewonnen und in der Kosmetik zur Hautbleichung verwendet. Im Jahr 1980 patentierte Merck Lovastatin, ein Sekundärmetabolit von A. terreus, das heute zur Behandlung der Hypercholesterinämie eingesetzt wird.
Quellen
Literatur
- Charles Thom, Kenneth B. Raper: A Manual of the Aspergilli. Williams & Wilkins, Baltimore 1945 (englisch, archive.org [abgerufen am 16. Januar 2010]).
- Kenneth B. Raper, Dorothy I. Fennel: The Genus Aspergillus. Williams & Wilkins, Baltimore 1965 (englisch).
- Robert A. Samson, John I. Pitt (Hrsg.): Advances in Penicillium and Aspergillus Systematics. Plenum Press, New York 1985, ISBN 0-306-42222-0 (englisch).
- Keith A. Powell, Annabel Renwick, John F. Peberdy (Hrsg.): The Genus Aspergillus: From Taxonomy and Genetics to Industrial Application. Plenum Press, New York 1994, ISBN 0-306-44701-0 (englisch).
- Gustavo H. Goldman, Stephen A. Osmani (Hrsg.): The Aspergilli: Genomics, Medical Aspects, Biotechnology, and Research Methods. CRC Press, Boca Raton 2007, ISBN 978-0-8493-9080-7 (englisch).
- Masayuki Machida, Katsuya Gomi (Hrsg.): Aspergillus: Molecular Biology and Genomics. Caister Academic Press, Norwich 2010, ISBN 978-1-904455-53-0 (englisch).
- János Varga, Robert A. Samson (Hrsg.): Aspergillus in the Genomic Era. Wageningen Academic Publishers, Wageningen 2008, ISBN 978-90-8686-065-4 (englisch).
Weblinks
- The Aspergillus / Aspergillosis Website. The Fungal Research Trust, abgerufen am 18. März 2010 (englisch).
Einzelnachweise
- A. P. J. Trinci, N. R. Morris: Morphology and Growth of a Temperature-sensitive Mutant of Aspergillus nidulans which Forms Aseptate Mycelia at Non-permissive Temperatures. In: Journal of General Microbiology. Band 114, 1979, S. 53–59, doi:10.1099/00221287-114-1-53 (englisch).
- A. P. J. Trinci: A Kinetic Study of the Growth of Aspergillus nidulans and Other Fungi. In: Journal of General Microbiology. Band 57, 1969, S. 11–24, doi:10.1099/00221287-57-1-11, PMID 5822157 (englisch).
- Maren A. Klich: Biogeography of Aspergillus species in soil and litter. In: Mycologia. Band 94, Nr. 1, 2002, S. 21–27 (englisch, mycologia.org [PDF]).
- Eldor Alvin Paul (Hrsg.): Soil microbiology, ecology, and biochemistry. 3. Auflage. Academic Press, Riverport 2007, ISBN 978-0-12-546807-7, S. 154 (englisch).
- Serena Ruisi, Donatella Barreca, Laura Selbmann, Laura Zucconi, Silvano Onofri: Fungi in Antarctica. In: Reviews in Environmental Science and Biotechnology. Band 6, Dezember 2007, S. 127–141, doi:10.1007/s11157-006-9107-y (englisch).
- Alisa P. Alker, Garriet W. Smith, Kiho Kim: Characterization of Aspergillus sydowii (Thom et Church), a fungal pathogen of Caribbean sea fan corals. In: Hydrobiologia. Band 460, Nr. 1–3, September 2001, S. 105–111, doi:10.1023/A%3A1013145524136 (englisch).
- John Mullins: Aspergillus and Aerobiology. In: Keith A. Owell, Annabel Renwick, John F. Pederby (Hrsg.): The Genus Aspergillus. Plenum Press, New York 1994, ISBN 0-306-44701-0, S. 351–359 (englisch).
- Bernard E. Proctor, Basil W. Parker: Microbiology of the Upper Air. III. An Improved Apparatus and Technique for Upper Air Investigations. In: Journal of Bacteriology. Band 36, Nr. 2, August 1938, S. 175–185, PMID 16560151 (englisch).
- Céline M. O’Gorman, Hubert T. Fuller, Paul S. Dyer: Discovery of a sexual cycle in the opportunistic fungal pathogen Aspergillus fumigatus. In: Nature. Band 457, Nr. 29, März 2009, S. 471–474, doi:10.1038/nature07528, PMID 19043401 (englisch).
- A. Hocking: Responses of xerophilic fungi to changes in water activity. In: D. H. Jennings (Hrsg.): Stress Tolerance of Fungi. Marcel Dekker, New York 1993, ISBN 0-8247-9061-8, S. 233–256 (englisch).
- A. P. Torzilli, J. D. Isbister: Comparison of coal solubilization by bacteria and fungi. In: Biodegradation. Band 5, Nr. 1, März 1994, S. 55–62, doi:10.1007/BF00695214 (englisch).
- Tristan Brandhorst, Patrick F. Dowd, William R. Kenealy: The effect of fungal ribosome inactivating proteins upon feeding choice in C. freemani, and indications of a mutualistic relationship with A. restrictus. Environmental Mycology. In: Mycopathologia. Band 152, Nr. 3, Dezember 2001, S. 155–158, doi:10.1023/A:1013131930192, PMID 11811644 (englisch).
- S. R. Loschiavo, R. N. Sinha: Feeding, Oviposition, and Aggregation by the Rusty Grain Beetle, Cryptolestes ferrugineus (Coleoptera: Cucujidae) on Seed-Borne Fungi. In: Annals of the Entomological Society of America. Band 59, Nr. 3, Mai 1966, S. 578–585, doi:10.1093/aesa/59.3.578 (englisch).
- D. T. Wicklow, P. F. Dowd, J. B. Gloer: Antiinsectan effects of Aspergillus metabolites. In: Keith A. Powell, Annabel Renwick, John F. Peberdy (Hrsg.): The Genus Aspergillus: From Taxonomy and Genetics to Industrial Application. Plenum Press, New York 1994, ISBN 0-306-44701-0, S. 93–114 (englisch, eingeschränkte Vorschau in der Google-Buchsuche). Keith A. Powell, Annabel Renwick, John F. Peberdy, Federation of European Microbiological Societies (Hrsg.): The Genus Aspergillus: from taxonomy and genetics to industrial application. Plenum Press, New York 1994.
- Anne D. van Diepeningen, János Varga, Rolf E. Hoekstra, Alfons J. M. Debets: Mycoviruses in the Aspergilli. In: János Varga, Robert A. Samson (Hrsg.): Aspergillus in the Genomic Era. Wageningen Academic Publishers, Wageningen 2008, ISBN 978-90-8686-065-4 (englisch).
- Geoffrey Clough Ainsworth: Introduction to the history of mycology. Cambridge University Press, Cambridge 1976, ISBN 0-521-21013-5, S. 175 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- Axel Arthur Brakhage: Systemic fungal infections caused by Aspergillus species: epidemiology, infection process and virulence determinants. In: Current Drug Targets. Band 6, Nr. 8, 2005, S. 875–886, PMID 16375671 (englisch).
- William Kaplan, Paul Arnstein, Libero Ajello, Francis Chandler, John Watts, Martin Hicklin: Fatal aspergillosis in imported parrots. In: Mycopathologia. Band 56, Nr. 1, Januar 1975, S. 25–29, doi:10.1007/BF00493579 (englisch).
- Robert Georg Markus: Untersuchungen zur Therapie der Luftsackmykose des Pferdes – Ligatur der Arteria carotis interna mittels transendoskopischer Clipapplikation. Tierärztliche Hochschule Hannover, Hannover 2002 (elib.tiho-hannover.de [PDF] Dissertationsschrift).
- Raper & Fennel, S. 95 f.
- I. Vennewald, J. Schönlebe, E. Klemm: Mycological and histological investigations in humans with middle ear infections. In: Mycoses. Band 46, Nr. 1–2, Februar 2003, S. 12–18, doi:10.1046/j.1439-0507.2003.00835.x (englisch).
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 197 und 282.
- Empfehlung der Kommission vom 11. August 2003 zur Prävention und Reduzierung der Patulinkontamination von Apfelsaft und Apfelsaftzutaten in anderen Getränken, EU-Recht
- Raper & Fennel, S. 105.
- Raper & Fennel, S. 105 f.
- Raper & Fennel, S. 106–109.
- Gottfried Kirchner: Der Fluch des Pharao – Das Geheimwissen der alten Ägypter. In: TERRA X Rätsel alter Weltkulturen. Bertelsmann, Frankfurt 1986, S. 24, 36.
- János Varga, Akos Juhasz, Ferenc Kevei, Zofia Kozakiewicz: Molecular diversity of agriculturally important Aspergillus species. In: European Journal of Plant Pathology. Band 110, Nr. 5–6, Juni 2004, S. 627–640, doi:10.1023/B:EJPP.0000032402.36050.df (englisch).
- G. Perrone, A. Susca, G. Cozzi, K. Ehrlich, J. Varga, J. C. Frisvad, M. Meijer, P. Noonim, W. Mahakarnchanakul, R. A. Samson: Biodiversity of Aspergillus species in some important agricultural products. In: Studies in Mycology. Band 59, Nr. 1, 2007, S. 53–66, doi:10.3114/sim.2007.59.07, PMID 18490950 (englisch).
- C. Elizabeth Oakley, Berl R. Oakley: Identification of γ-tubulin, a new member of the tubulin superfamily encoded by mipA gene of Aspergillus nidulans. In: Nature. Band 338, Nr. 6217, 1989, S. 662–664, doi:10.1038/338662a0, PMID 2649796 (englisch).
- Dr. Kerstin Mauth: Neue Genom Entschlüsselung wird Forschung stark vorantreiben. DFG Forschungszentrum für Molekularphysiologie des Gehirns, 21. Dezember 2005, abgerufen am 29. Oktober 2012.
- Joan W. Bennett: An Overview of the Genus Aspergillus. In: Masayuki Machida, Katsuya Gomi (Hrsg.): Aspergillus: Molecular Biology and Genomics. Caister Academic Press, Norwich 2010, ISBN 978-1-904455-53-0, S. 1–18 (englisch).
- Andrew Breakspear, Michelle Momany: Microarrays in Aspergillus Species. In: Gustavo H. Goldman, Stephen A. Osmani (Hrsg.): The Aspergilli: Genomics, Medical Aspects, Biotechnology, and Research Methods. CRC Press, Boca Raton 2007, ISBN 978-0-8493-9080-7, S. 475–481 (englisch).
- Michael Köneke: Schimmel im Haus: Erkennen – vermeiden – bekämpfen. Risiken, Einflussfaktoren, Messmethoden, Rechtsstreitigkeiten, Bekämpfungsmaßnahmen von Schimmelpilzen. Fraunhofer Irb, Sttagart 2008, ISBN 978-3-8167-7295-8, S. 12 (eingeschränkte Vorschau in der Google-Buchsuche).
- David Malloch: The Trichocomaceae: Relationships with other Ascomycetes. In: Robert A. Samson, John I. Pitt (Hrsg.): Advances in Penicillium and Aspergillus Systematics. Plenum Press, New York 1985, ISBN 0-306-42222-0, S. 365–382 (englisch).
- Mary L. Berbee, Atsuko Yoshimura, Junta Sugiyama, John W. Taylor: Is Penicillium Monophyletic? An Evaluation of Phylogeny in the Family Trichocomaceae from 18S, 5.8S and ITS Ribosomal DNA Sequence Data. In: Mycologia. Band 87, Nr. 2 (März–April), 1995, S. 210–222, JSTOR:3760907 (englisch).
- Junta Sugiyama: Relatedness, phylogeny, and evolution of the fungi. In: Mycoscience. Band 39, Nr. 4, Dezember 1998, S. 487–511, doi:10.1007/BF02460912 (englisch).
- M. Tamura, K. Kawahara, J. Sugiyama: Molecular phylogeny of Aspergillus and associated teleomorphs in the Trichocomaceae (Eurotiales). In: Robert A. Samson, John I. Pitt (Hrsg.): Integration of Modern Taxonomic Methods For Penicillium and Aspergillus Classification. CRC Press, Boca Raton 2000, ISBN 90-5823-159-3, S. 357–373 (englisch).
- J. I. Pitt, R. A. Samson: Nomenclatural considerations in naming species of Aspergillus and its teleomorphs. In: Studies in Mycology. Band 59, 2007, S. 67–70, doi:10.3114/sim.2007.59.08, PMID 18490944 (englisch).
- C. P. Kurtzman, M. J. Smiley, C. J. Robnett, D. T. Wicklow: DNA Relatedness among Wild and Domesticated Species in the Aspergillus flavus Group. In: Mycologia. Band 78, Nr. 6 (November–Dezember), 1986, S. 955–959, JSTOR:3807436 (englisch).
- Heinrich Dörfelt, Alexander R. Schmidt: A fossil Aspergillus from Baltic amber. In: Mycological Research. Band 109, Nr. 8, August 2005, S. 956–960, doi:10.1017/S0953756205003497, PMID 16175799 (englisch).
- Index Fungorum. Abgerufen am 16. Januar 2010.
- The Aspergillus Website. Abgerufen am 16. Januar 2010.
- V. Robert, G. Stegehuis, J. Stalpers: The MycoBank engine and related databases. Abgerufen am 16. Januar 2010.
- Robert A. Samson: A compilation of the Aspergilli described since 1965. In: Studies in Mycology. Band 18, Januar 1979 (cbs.knaw.nl [abgerufen am 9. März 2010]).
- J. C. Neill: The Mould Fungi of New Zealand. II.The Genus Aspergillus. In: Transactions and Proceedings of the Royal Society of New Zealand 1868–1961. Band 69, 1940, S. 237–264 (englisch, rsnz.natlib.govt.nz [abgerufen am 11. März 2010]).
- R.A. Samson1, S. Hong, S. W. Peterson, J.C. Frisvad, J. Varga: Polyphasic taxonomy of Aspergillus section Fumigati and its teleomorph Neosartorya. In: Studies in Mycology. Band 59, Nr. 1, 2007, S. 147–203, doi:10.3114/sim.2007.59.14, PMID 18490953 (englisch).
- J. L. Varshney, A. K. Sarbhoy: A new species of Aspergillus fumigatus group and comments upon its synonymy. In: Mycopathologia. Band 73, Nr. 2, Januar 1981, S. 89–92, doi:10.1007/BF00562596, PMID 7012634 (englisch).
- Robert A. Samson, Seung-Beom Hong, Jens C. Frisvad: Old and new concepts of species differentiation in Aspergillus. In: Medical Mycology. Band 44, s1, 2006, S. 133–148, doi:10.1080/13693780600913224 (englisch).
- Yoshikazu Horie, Paride Abliz, Kazutaka Fukushima, Kaoru Okada, G.M. Campos Takaki: Two new species of Neosartorya from Amazonian soil, Brazil. In: Mycoscience. Band 44, Nr. 5, Oktober 2003, S. 397–402, doi:10.1007/s10267-003-0132-1 (englisch).
- M. A. Klich: Morphological Studies of Aspergillus Section Versicolores and Related Species. In: Mycologia. Band 85, Nr. 1 (Januar–Februar), 1993, S. 100–107, JSTOR:3760484 (englisch).
- R. A. Samson, J. Mouchacca: Additional notes on species of Aspergillus, Eurotium and Emericella from Egyptian desert soil. In: Antonie van Leeuwenhoek. Band 41, Nr. 3, 1975, S. 343–351, doi:10.1007/BF02565069, PMID 1082299 (englisch).
- M. A. Ismail, A. A. Zohri: Confirmation of the relationships of Aspergillus egyptiacus and Emericella nidulans using progesterone transformation. In: Letters in Applied Microbiology. Band 18, Nr. 3, Juni 2008, S. 130–131, doi:10.1111/j.1472-765X.1994.tb00825.x (englisch).
- Janos Varga, Jos Houbraken, Henrich A. L. Van Der Lee, Paul E. Verweij, Robert A. Samson: Aspergillus calidoustus sp. nov., Causative Agent of Human Infections Previously Assigned to Aspergillus ustus. In: Eukaryotic Cell. Band 7, Nr. 4, April 2008, S. 630–638, doi:10.1128/EC.00425-07, PMID 18281596 (englisch).
- J. C. Frisvad, P. Skouboe, R. A. Samson: Taxonomic comparison of three different groups of aflatoxin producers and a new efficient producer of aflatoxin B1, sterigmatocystin and 3-O-methylsterigmatocystin, Aspergillus rambellii sp. nov. In: Systematic and Applied Microbiology. Band 28, Nr. 5, Juli 2005, S. 442–453, PMID 16094871 (englisch).
- S. Arunmozhi Balajee, John W. Baddley, Stephen W. Peterson, David Nickle, Janos Varga, Angeline Boey, Cornelia Lass-Florl, Jens C. Frisvad, Robert A. Samson: Aspergillus alabamensis, a New Clinically Relevant Species in the Section Terrei. In: Eukaryotic Cell. Band 8, Nr. 5, Mai 2009, S. 713–722, doi:10.1128/EC.00272-08, PMID 19304950 (englisch).
- Jens C. Frisvad, Mick Frank, Jos A. M. P. Houbraken, Angelina F. A. Kuijpers, Robert A. Samson: New ochratoxin A producing species of Aspergillus section Circumdati. In: Studies in Mycology. Band 50, Nr. 1, 2004, S. 23–43 (englisch).
- Martha Christensen: The Aspergillus ochraceus group: two new species from western soils and a synoptic key. In: Mycologia. Band 74, Nr. 2, 1982, S. 210–225, JSTOR:3792887 (englisch).
- Dong Mei Li, Yoshikazu Horie, Yuxin Wang, Rouyu Li: Three new Aspergillus species isolated from clinical sources as a causal agent of human aspergillosis. In: Mycoscience. Band 39, Nr. 3, Oktober 1998, S. 1340–3540, doi:10.1007/BF02464012 (englisch).
- Yoko Ito, S. W. Peterson, T. Goto: Properties of Aspergillus tamarii, A. caelatus and related species from acidic tea field soils in Japan. In: Mycopathologia. Band 144, Nr. 3, Dezember 1998, S. 169–175, doi:10.1023/A:1007021527106, PMID 10531683 (englisch).
- Bruce W. Horn, Jorge H. Ramirez-Prado, Ignazio Carbone: Sexual reproduction and recombination in the aflatoxin-producing fungus Aspergillus parasiticus. In: Fungal Genetics and Biology. Band 46, Nr. 2, Februar 2009, S. 169–175, doi:10.1016/j.fgb.2008.11.004, PMID 19038353 (englisch).
- Robert A. Samson, Jos A. M. P. Houbraken, Angelina F. A. Kuijpers, J. Mick Frank, Jens C. Frisvad: New ochratoxin A or sclerotium producing species in Aspergillus section Nigri. In: Studies in Mycology. Band 50, Nr. 1, 2004, S. 45–61 (englisch).
- T. Inui: Untersuchungen über die niederen Organismen welche sich bei der Herstellung des alkoholischen Getränkes „Awamori“ beteiligen. In: Journal of the College of Science. 1901, S. 469–484 (repository.dl.itc.u-tokyo.ac.jp [PDF]). repository.dl.itc.u-tokyo.ac.jp (Memento des Originals vom 25. Mai 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Paramee Noonim, Warapa Mahakarnchanakul, Janos Varga, Jens C. Frisvad, Robert A. Samson: Two novel species of Aspergillus section Nigri from Thai coffee beans. In: International Journal of Systematic and Evolutionary Microbiology. Band 58, 2008, S. 1727–1734, doi:10.1099/ijs.0.65694-0, PMID 18599725 (englisch).
- Donatella Mares, Elisa Andreotti, Maria Elena Maldonado, Paola Pedrini, Chiara Colalongo, Carlo Romagnoli: Three New Species of Aspergillus from Amazonian Forest Soil (Ecuador). In: Current Microbiology. Band 57, Juli 2008, S. 222–229, doi:10.1007/s00284-008-9178-9, PMID 18594910 (englisch).
- Oriana Magii, Anna Maria Persiani: Aspergillus implicatus, a new species isolated from Ivory Coast forestsoil. In: Mycological Research. Band 98, Nr. 8, 1994, S. 869–873 (englisch).
- Takashi Yaguchi, Ayako Someya and Shun-ichi Udagawa: Aspergillus taichungensis, a new species from Taiwan. In: Mycoscience. Band 36, Nr. 4, Dezember 1995, S. 1618–2545, doi:10.1007/BF02268626 (englisch).
- H. Benninga: A History of Lactic Acid Making: A Chapter in the History of Biotechnology. Springer, New York 1990, ISBN 0-7923-0625-2, S. 140 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Bernard Dixon: Aspergillus niger – das Ende eines italienischen Monopols. In: Der Pilz, der John F. Kennedy zum Präsidenten machte. Spektrum, Heidelberg 1995, ISBN 3-86025-289-5, S. 63–66.
- David R. Dodds, Richard A. Gross: Chemicals from Biomass. In: Science. Band 318, Nr. 5854, November 2007, S. 1250–1251, doi:10.1126/science.1146356, PMID 18033870 (englisch).
- Enzyme List. (PDF) (Nicht mehr online verfügbar.) Association of Manufacturers and Formulators of Enzyme Products (AMFEP), 2009, archiviert vom Original am 25. Mai 2015; abgerufen am 18. März 2010. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Piet W. M. van Dijck: The importance of Aspergilli and regulatory aspects of Aspergillus nomenclature in biotechnology. In: János Varga, Robert A. Samson (Hrsg.): Aspergillus in the Genomic Era. Wageningen Academic Publishers, Wageningen 2008, ISBN 978-90-8686-065-4, S. 249–256 (englisch).