Tubuline
Tubuline sind Proteine, die in den Zellen von Eukaryoten vorkommen. Sie sind etwa 55 kDa schwer und 450 Aminosäuren lang. Es sind allein beim Menschen über hundert paraloge Isoformen bekannt, die in sechs Hauptgruppen (α, β, γ, δ, ε, ζ) eingeteilt werden. Die wichtigsten Formen des Tubulins, die α- und β-Tubuline, sind Hauptbestandteil der Mikrotubuli.[1]
Vorkommen
Während Eukaryoten, ob es sich nur um Einzeller, Pilze, Pflanzen oder Tiere handelt, einheitliches Tubulin haben (Genetische Ähnlichkeit: 90–95 %[2]), haben Prokaryoten erheblich unterschiedlichere tubulinähnliche Proteine (BtubA und BtubB[3][4]. Daneben gibt es TubZ, RepX, FtsZ), die teilweise nur zu 40 % in ihrer Gensequenz übereinstimmen. Trotzdem scheinen die aus diesen Homologen hergestellten Mikrotubuli der Bakterien im Wesentlichen dieselben Funktionen zu erfüllen wie die der Eukaryoten.[5]
Formen
α- und β-Tubulin
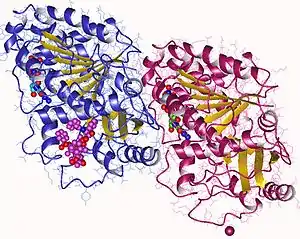
α- und β-Tubuline sind kugelförmige Proteine, welche sich mit Hilfe einer nicht kovalenten Bindung zu einem Heterodimer verbinden können. Diese Heterodimere, welche sich dann zu den sogenannten Protofilamenten zusammenlagern, sind dann in der Lage, sich zu helikalen Hohlkörpern, den so genannten Mikrotubuli zusammenzulagern. Ursprungspunkt dieser rund 25 Nanometer[6] dicken Mikrotubuli sind die „microtubule organizing center“ (MTOC). Es sind 13 Protofilamente nötig, um eine volle Drehung der Helix zu erzeugen.
An den Enden eines Mikrotubulus befinden sich jeweils α-Tubulin bzw. β-Tubulin. Das α-Tubulin-Ende wird minus-Ende genannt, das β-Tubulin plus-Ende.[6] α- und β-Tubulin sind in der Lage, GTP zu binden. Bei α-Tubulin der Protofilamente wird das GTP an der Dimergrenzfläche von einem Loop des β-Tubulin eingeschlossen und so vor der Hydrolyse geschützt. Das GTP des β-Tubulin wird allerdings kurz nach der Anlagerung an ein weiteres Protofilament zu GDP hydrolysiert. Die Stabilität am Plus-Ende ist höher durch GTP-Cap. Mikrotubuli depolymerisiert und polymerisiert leichter am Plus-Ende. Beide Vorgänge (Polymerisation und Depolymerisation) laufen in der Zelle gleichzeitig ab und begründen damit die Dynamik des Mikrotubuli-Netzwerkes. Diese Eigenschaft der Mikrotubuli wird als dynamische Instabilität bezeichnet.
γ-Tubulin
Gamma-Tubulin ist kein Baustein der Mikrotubuli. Es ist vielmehr an der Keimung neuer Mikrotubuli am Zentrosom und den Basalkörpern beteiligt. Gamma-Tubulin bildet dabei einen großen ringförmigen Proteinkomplex mit weiteren Proteinen. Dieser sogenannte „Gamma-Tubulin-Ring-Complex“ (gammaTuRC) kann die Polymerisation von alpha- und beta-Tubulin zur Bildung von Mikrotubuli bewirken.
δ- und ε-Tubulin
δ- und ε-Tubulin findet man in den Zentriolen tierischer Zellen. Es wird vermutet, dass sie eine Rolle bei der Ausbildung der Mitosespindel spielen.
Literatur
- Bruce Alberts u. a.: Molekularbiologie der Zelle. 4. Auflage. Wiley-VCH., Weinheim 2003, ISBN 3-527-30492-4.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemie. 6. Auflage. Spektrum Akademischer Verlag, München 2007, ISBN 978-3-8274-1800-5
- Martin Pilhofer, Bakterielle Tubuline und Zellteilung in Prosthecobacter, VAAM-Promotionspreis 2009
Einzelnachweise
- INTERPRO-Eintrag zu Tubulinen allgemein
- Satyajit Sahu, Subrata Ghosh, Daisuke Fujita, Anirban Bandyopadhyay: Live visualizations of single isolated tubulin protein self-assembly via tunneling current: effect of electromagnetic pumping during spontaneous growth of microtubule. In: Scientific Reports. Band 4, Artikel 7303 (2014), 3. Dezember 2014, doi:10.1038/srep07303 (englisch).
- K. K. Busiek, W. Margolin: Bacterial actin and tubulin homologs in cell growth and division. In: Current Biology. Band 25, Nummer 6, März 2015, S. R243–R254, doi:10.1016/j.cub.2015.01.030, PMID 25784047, PMC 5519336 (freier Volltext) (Review).
- Martin Pilhofer, Mark S. Ladinsky, Alasdair W. McDowall, Giulio Petroni, Grant J. Jensen: Microtubules in Bacteria: Ancient Tubulins Build a Five-Protofilament Homolog of the Eukaryotic Cytoskeleton. In: Zeitschrift: PLOS Biology, Published: December 6, 2011, doi:10.1371/journal.pbio.1001213
- Contzen Pereira: Cytoskeleton and Consciousness: An Evolutionary Based Review. In: Zeitschrift: NeuroQuantology, June 2015, Volume 13, Issue 2, Page 232-239
- William J. Lennarz, M. Daniel Lane (Hrsg.): Encyclopedia of Biological Chemistry, Bd. 1, S. 372, ISBN 0-12-443710-9, 2004
- INTERPRO: ζ-Tubulin