Ubichinon-10
Ubichinon-10 (auch UQ von englisch Ubiquinon, oder Q-10 oder Coenzym Q10[3]) ist ein Chinon-Derivat mit lipophiler Isoprenoid-Seitenkette, strukturell verwandt mit Vitamin K und Vitamin E. Die reduzierte, phenolische Form wird Ubihydrochinon oder Ubichinol (kurz QH2) genannt. Ubichinon-10 gehört zu den Ubichinonen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
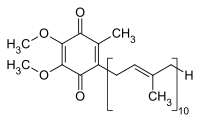 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Ubichinon-10 | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C59H90O4 | |||||||||||||||||||||
| Kurzbeschreibung |
geruchloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C01EB09 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 863,34 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Q-10 ist ein Elektronen- und Protonen-Überträger zwischen dem Komplex I bzw. Komplex II und dem Komplex III der Atmungskette.
Q-10 wird als Bestandteil von kosmetischen Cremes sowie auch als Nahrungsergänzungsmittel zum Verkauf angeboten.
Eigenschaften
Q-10 ist ein gelb-oranges, kristallines Pulver ohne Geruch und Geschmack. Die hydrophobe Isoprenoid-Seitenkette ermöglicht die Verankerung des Moleküls im ebenfalls hydrophoben Bereich der Biomembranen, die die Mitochondrien aufbauen.
Biologische Funktion
Q-10 ist eine körpereigene Substanz. Es wird zum Teil über die Nahrung aufgenommen, aber auch im Körper selbst produziert. In jeder menschlichen Zelle wird die Energie aus der Nahrung in körpereigene Energie (ATP) umgewandelt. Q-10 ist als Coenzym an der oxidativen Phosphorylierung beteiligt, über die 95 % der gesamten Körperenergie (ATP) erzeugt wird.[4][5] Die Organe mit dem höchsten Energiebedarf – wie Herz, Lunge und Leber – weisen deshalb auch die höchste Q-10-Konzentration auf.[6]
Biochemie
Die Atmungskette in den Mitochondrien der Zelle ermöglicht den stufenweise ablaufenden Transfer von Elektronen und Protonen auf Sauerstoff bei gleichzeitiger Gewinnung von ATP als biochemisches Energieäquivalent. Diese Reaktion findet an lokalisierten Membranproteinen, den Komplexen I bis V, und mobilen Komponenten, Ubichinon und Cytochrom c, statt. Letztere dienen als Shuttlesysteme zwischen den Komplexen: Ubichinon vermittelt zwischen den Komplexen I/II und III, Cytochrom c zwischen den Komplexen III und IV.
Die Elektronen zur Reduktion des Ubichinons entstammen der Oxidation des NADH am Komplex I der Atmungskette, der NADH-Dehydrogenase, bzw. von der Oxidation von Succinat am Komplex II, welcher mit der Succinat-Dehydrogenase des Citratzyklus identisch ist. Ein Ubichinon-Molekül kann dabei schrittweise zwei Elektronen aufnehmen. Im ersten Schritt bildet sich QH•, ein recht stabiles Semichinon-Radikal. Die Aufnahme des zweiten Elektrons lässt nach der Protonierung das Hydrochinon Ubichinol entstehen, also die reduzierte Form. Dies ermöglicht neben dem Elektronentransport auch die Bindung zweier Protonen – Ubichinon kann somit auch als Protonencarrier dienen. Diese Vorgänge sind innerhalb der Atmungskette im Q-Zyklus am Komplex III von Bedeutung.
Prooxidante und antioxidante Eigenschaften
Ubichinon ist auch involviert bei der Bildung von reaktiven Sauerstoffspezies (ROS) durch die Entstehung von Superoxid durch Ubisemichinon-Radikale, die oxidative Beschädigungen verursachen, die vielen degenerativen Krankheiten zugrunde liegen. Paradoxerweise ist der Ubichinon-Pool auch ein wichtiges mitochondriales Antioxidans.[7]
Mangel
Ein permanenter Q-10-Mangel kommt selten vor, Mangelerscheinungen sind nicht bekannt.[8] Man findet ihn gehäuft bei Patienten mit Myopathien. Da die an der Biosynthese von Q-10 beteiligten Enzyme noch nicht alle bekannt sind, ist es ohne weiteres möglich, dass Mutationen in einem der betroffenen Gene noch nicht identifiziert sind.[9][10][11]
Eine Möglichkeit für temporären Q-10-Mangel stellt die Medikation mit Statinen dar, wo durch die Hemmung der HMG-CoA-Reduktase die Ausgangsstoffe für die Biosynthese von Q-10 verringert werden, was zu einem Rückgang der Plasmawerte führt. Über die Verfügbarkeit von Q-10 im Muskel ist dagegen nichts bekannt, ebenso wenig wie über eine Wirksamkeit von erhöhter Zufuhr.[12]
Hochdosierte, Q-10-haltige Therapien können unter ärztlicher Kontrolle in der Behandlung von Herzerkrankungen eingesetzt werden.[8]
Biosynthese
Die Biosynthese von Q-10 in Eukaryoten geht einerseits von 4-Hydroxybenzoesäure aus, die aus der Aminosäure Tyrosin in fünf Schritten, unter anderem über Hydroxyphenylbernsteinsäure und 4-Cumarinsäure, erhalten wird und den Chinon-Teil bildet; auf der anderen Seite wird für die Seitenkette all-trans-Decaprenylphosphat benötigt, das aus Geranylgeranylphosphat (GGP, aus dem Mevalonatweg) in sechs Schritten aufgebaut wird. Beide Ausgangsstoffe werden mithilfe der p-Hydroxybenzoat-Polyprenyltransferase (EC 2.5.1.39) zu 3-Decaprenyl-4-hydroxybenzoat zusammengefügt. In sieben weiteren Schritten entsteht Ubichinol-10, das durch Elektronenübertragung zum Ubichinon-10 wird.[13]
Vorkommen
Q-10 findet sich reichhaltig im Fleisch von Organen (Leber), öligem Fisch (Sardinen, Makrelen usw.), Leber, Ei und Butter, ferner in Nüssen (z. B. Pistazien), Hülsenfrüchten, Sesamsamen, Sonnenblumenkernen, Pflanzenölen.[8] Kochen kann das Coenzym jedoch zerstören.
Nahrungsergänzung
Über die Nahrung nimmt ein Mensch täglich etwa fünf bis zehn Milligramm des Coenzyms auf.[8] Zudem ist der Körper in der Lage, Q-10 aus Phenylalanin und Tyrosin bzw. aus der in Pflanzen vorkommenden Mevalonsäure selbst herzustellen (siehe Biosynthese).[8] Damit ist eine zusätzliche Aufnahme für Gesunde über Nahrungsergänzungsmittel überflüssig.
Das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit sieht eine tägliche Aufnahmemenge von 10 bis 30 mg Q-10 als bedenkenlos an.[8] In einer Allgemeinverfügung stellt es fest, dass auch höhere Dosierungen von 100 mg pro Tag verkauft werden können.[3] Voraussetzung hierfür ist, dass die Verzehrempfehlung von einer Kapsel pro Tag nicht überschritten wird sowie eine Kennzeichnung, die vor dem Verzehr durch Schwangere, Stillende, Kinder und Jugendliche unter 18 Jahren warnt.[8]
Überschreitet die Verzehrmenge von 100 mg Q-10 täglich können Nebenwirkungen wie Schlaflosigkeit, Durchfall, Übelkeit, Appetitverlust und Unwohlsein, Reizbarkeit und Hautausschlag auftreten. Für mögliche chronische Auswirkungen liegen keine Daten vor.[8]
Angeboten wird Q-10 entweder in Form von Ubichinon oder Ubichinol. Alle von Herstellern behaupteten Wirkungen bezüglich Q-10 (z. B. Nutzen hinsichtlich der Energiegewinnung, des Blutdrucks, des Schutzes vor oxidativen Schäden, Migräne, kognitiver Funktionen, des Cholesterinspiegels, einer Leistungssteigerung, Verbesserungen des Hautbildes) sind wissenschaftlich nicht belegt und dürfen als Werbeaussage nicht verwendet werden (siehe Health Claims).[8]
Kosmetik
Q-10 ist auch propagierter Wirkstoff von vielfach angebotenen Hautcremes. Sie sollen den angeblich im Alter zunehmenden Mangel an Q-10 ausgleichen und z. B. den Abbau von schädlichen Radikalen sicherstellen. Ein wissenschaftlicher Nachweis hierfür existiert nicht.[8]
Herstellung
Für die Herstellung von Q-10 werden drei Verfahren eingesetzt: Fermentation von Hefen, Fermentation von Bakterien und chemische Synthese.
Beim Hefefermentationsverfahren entsteht Q-10 in der so genannten trans-Konfiguration, was bedeutet, dass es identisch ist mit dem natürlich auftretenden CoQ10, wie man es in Fleisch, Fisch oder anderen Lebensmitteln findet.
Die Sicherheit von Hefefermentation wurde durch mehrere Sicherheitsstudien bestätigt, die von einem der weltweit führenden Versuchslaboratorien (Covance Laboratories Inc.)[14] durchgeführt wurden. Darüber hinaus wurde in einer doppelblinden, randomisierten, placebokontrollierten Studie nachgewiesen, dass CoQ10 von Hefefermentation in Dosierungen bis 900 Milligramm pro Tag absolut sicher und gut verträglich ist.[15]
Das durch chemische Synthese hergestellte Q-10 enthält das cis-Isomer (eine im natürlich auftretenden Q-10 nicht vorhandene Molekularstruktur), über dessen Sicherheit bisher keine intensiven Studien durchgeführt worden sind.
Geschichte
Ubichinon-10 wurde 1957 entdeckt und erstmals von Fred L. Crane aus Rinder-Herzen isoliert.[16] Die chemische Struktur konnte 1958 von Karl August Folkers aufgeklärt werden.[17] Für die Erkenntnisse über die Rolle von Q-10 im Q-Zyklus des Komplex III der Atmungskette erhielt der britische Wissenschaftler Peter D. Mitchell 1978 den Nobelpreis für Chemie.
Literatur
- F. L. Crane: Biochemical functions of coenzyme Q10. In: Journal of the American College of Nutrition, Band 20, Nummer 6, Dezember 2001, S. 591–598. PMID 11771674 (Review).
- L. Ernster, G. Dallner: Biochemical, physiological and medical aspects of ubiquinone function. In: Biochim. Biophys Acta, Band 1271, 1995, S. 195–204. PMID 7599208.
Weblinks
- Coenzym Q 10, Bundesinstitut für Risikobewertung
- Introduction to Coenzymne Q10 (PDF; 52 kB; englisch)
- Coenzym Q10-Produkte – ist ein Nutzen wirklich bewiesen?, Verbraucherzentrale, 25. November 2021
Einzelnachweise
- Eintrag zu UBIQUINONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Datenblatt Coenzyme Q-10, 98+% bei AlfaAesar, abgerufen am 17. Juni 2019 (PDF) (JavaScript erforderlich).
- Nahrungsergänzungsmittel mit Zusatz von Coenzym Q10 vom 12.02.2014 (BVL 14/01/002). In: Bundesamt für Verbraucherschutz und Lebensmittelsicherheit. 12. Februar 2014, abgerufen am 10. Oktober 2021.
- L. Ernster, G. Dallner: Biochemical, physiological and medical aspects of ubiquinone function. Biochim. Biophys. Acta. Band 1271, 1995, S. 195–204. PMID 7599208
- P. L. Dutton u. a.: Coenzyme Q oxidation reduction reactions in mitochondrial electron transport. In: V. E. Kagan, P. J. Quinn (Hrsg.): Coenzyme Q: Molecular mechanisms in health and disease. CRC Press, 2000, S. 65–82.
- Y. Shindo, E. Witt, D. Han, W. Epstein, L. Packer: Enzymic and non-enzymic antioxidants in epidermis and dermis of human skin. In: Invest. Dermatol. 102, 1994, S. 122–124.
- A. M. James u. a.: Antioxidant and prooxidant properties of mitochondrial Coenzyme Q. In: Arch. Biochem. Biophys. Band 423, 2004, S. 47–56. PMID 14989264
- Coenzym Q10-Produkte – ist ein Nutzen wirklich bewiesen? In: Verbraucherzentrale. 16. Februar 2021, abgerufen am 10. Oktober 2021.
- M. Mancuso, D. Orsucci, L. Volpi, V. Calsolaro, G. Siciliano: Coenzyme Q10 in neuromuscular and neurodegenerative disorders. In: Curr Drug Targets. Band 11, Nr. 1, Januar 2010, S. 111–121, PMID 20017723.
- S. R. Lalani, G. D. Vladutiu, K. Plunkett, T. E. Lotze, A. M. Adesina, F. Scaglia: Isolated mitochondrial myopathy associated with muscle coenzyme Q10 deficiency. In: Arch. Neurol. Band 62, Nr. 2, Februar 2005, S. 317–320, doi:10.1001/archneur.62.2.317, PMID 15710863.
- S. Sacconi, E. Trevisson, L. Salviati u. a.: Coenzyme Q10 is frequently reduced in muscle of patients with mitochondrial myopathy. In: Neuromuscul. Disord. Band 20, Nr. 1, Januar 2010, S. 44–48, doi:10.1016/j.nmd.2009.10.014, PMID 19945282.
- L. Marcoff, P. D. Thompson: The role of coenzyme Q10 in statin-associated myopathy: a systematic review. In: J. Am. Coll. Cardiol. Band 49, Nr. 23, Juni 2007, S. 2231–2237, doi:10.1016/j.jacc.2007.02.049, PMID 17560286 (onlinejacc.org).
- MetaCyc: ubiquinone-10 biosynthesis (eukaryotic).
- K. D. Williams, J. D. Maneka, M. Abdel-Hameed, R. L. Hall, T. E. Palmer, M. Kitano, T. Hidaka: 52-Week oral gavage chronic toxicity study with ubiquinone in rats with a 4-week recovery. In: J Agric Food Chem., 47, 1999, S. 3756–3763.
- H. Ikematsu, K. Nakamura, S. Harashima, K. Fujii, N. Fukutomi: Safety assessment of Coenzyme Q10 (Kaneka Q10) in healthy subjects: A double-blind, randomized, placebo-controlled trial. In: Regul Toxicol Pharmacol., 44, 2006, S. 212–218.
- F. L. Crane u. a.: Isolation of a quinone from beef heart mitochondria. In: Biochim. Biophys. Acta, Band 25, 1957, S. 220–221. PMID 13445756.
- Nachruf: Karl Folkers (Memento vom 25. Februar 2020 im Internet Archive)