Pioglitazon
Pioglitazon ist ein Arzneistoff aus der Gruppe der Glitazone (Insulin-Sensitizer), der zur Behandlung des Diabetes mellitus Typ 2 in Form von Tabletten eingesetzt wird. Das Wirkprinzip ist eine Sensibilisierung (Steigerung der Empfindlichkeit) des Gewebes auf Insulin, dessen Wirkung bei der typischen Insulinresistenz dieser Diabetesform herabgesetzt ist. Das körpereigene oder auch durch Injektionen zugeführtes Insulin ist folglich wieder in der Lage, erhöhte Blutzuckerspiegel effektiver zu senken.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
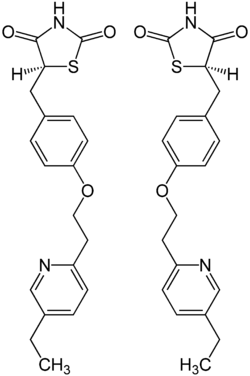 | ||||||||||||||||||||||
| 1:1-Gemisch aus (S)-Pioglitazon (links) und (R)-Pioglitazon (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Pioglitazon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A10BG03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendung
Bei übergewichtigen Patienten wird Pioglitazon in Kombination mit Metformin verwendet. Das Medikament wird oral verabreicht. Bei Patienten, die Metformin nicht vertragen oder bei denen Metformin kontraindiziert ist, kann Pioglitazon in einer Monotherapie (nur Pioglitazon) oder Kombination mit einem Sulfonylharnstoff eingesetzt werden. Es ist ferner möglich, Pioglitazon in einer Triple-Therapie (zusammen mit Metformin und Sulfonylharnstoffen) einzusetzen, auch die Kombination mit Insulin ist möglich. Die Einnahme der Tabletten kann unabhängig von den Mahlzeiten erfolgen. Die Wirkung von Pioglitazon tritt nicht sofort ein, sondern ist erst nach etwa 4 Wochen vollständig ausgebildet. Eine Ausnahme bildet die Kombination mit Insulin, da hierbei die Wirkung des Insulins direkt verstärkt wird. Es sollte eine engmaschige Kontrolle der Blutzuckerwerte erfolgen, um Hypoglykämien (Unterzuckerungen) zu vermeiden.
Pioglitazon kann nach einem Beschluss des Gemeinsamen Bundesausschusses seit April 2011 nur noch in begründeten Ausnahmefällen zu Lasten der GKV verordnet werden.[3]
Wirkmechanismus
In den Körperzellen aktiviert Pioglitazon im Zellkern den PPARγ-Rezeptor (Peroxisom-Proliferator-aktivierten Rezeptor-gamma). Dieser Rezeptor ist an der Regulation verschiedener Mechanismen im Kohlenhydrat- und Fettstoffwechsel beteiligt. Die Aktivierung dieses Rezeptors erhöht die Sensitivität der Zellen von Leber, Muskulatur und Fettgewebe für Insulin. Fettbausteine und Glucose werden dadurch vermehrt in die Zellen aufgenommen und verstoffwechselt. In der Leber verringert sich die Neubildung von Glucose.
Der Blutzuckerspiegel sinkt sowohl in nüchternem Zustand als auch nach den Mahlzeiten ab. Auch erhöhte Insulinkonzentrationen nach den Mahlzeiten werden gesenkt. Durch die verstärkte Wirkung vorhandenen Insulins benötigt der Körper nur noch geringere Mengen Insulin. Eine bestehende Insulinresistenz nimmt durch die Gabe von Pioglitazon daher ab.
Der Wirkstoff Pioglitazon verringert, nach dem gleichen Mechanismus wie alle Glitazone, die Insulinunempfindlichkeit (Insulinresistenz) des Fettgewebes, der Muskulatur und der Leber und senkt so den Blutzuckerspiegel. Außerdem kann Pioglitazon die Zuckerproduktion in der Leber verringern und die Zuckerverwertung im Körper, beispielsweise in der Muskulatur, verbessern. Dadurch wird zusätzlich der Zuckerstoffwechsel optimiert.
Neben der Verbesserung der Wirkung des körpereigenen Insulins verstärkt Pioglitazon auch die Wirkung von zugeführtem Insulin. Der Wirkungseintritt des Pioglitazon, der bei Einzeltherapie etwa zwei bis drei Wochen auf sich warten lässt, tritt in der Kombination mit Insulin wesentlich schneller ein. Bei Einnahme von Pioglitazon muss der Patient teilweise seine Insulindosis um bis zu 30 Prozent senken, um Unterzuckerungen vorzubeugen. Manchmal ist es sogar möglich, das Insulin ganz abzusetzen. Allerdings darf die Umstellung auf die Kombination nur unter Kontrolle eines in der Behandlung von Diabetes erfahrenen Arztes und mit sehr häufigen Nachuntersuchungen geschehen.[4]
Gegenanzeigen
Patienten mit Leberfunktionsstörungen dürfen Pioglitazon nicht anwenden. Außerdem dürfen Patienten mit Herzinsuffizienz, also Herzschwäche, Pioglitazon nicht erhalten. Das gilt auch, wenn die Herzschwäche in der Vergangenheit vorlag.
Es gibt keine Erfahrungen mit der Anwendung von Pioglitazon bei schwangeren Frauen und stillenden Müttern. Der Einsatz der Substanz bei diesen Patientinnen muss daher unterbleiben. Für die Anwendung von Pioglitazon bei Patienten mit schwerer Einschränkungen der Nierenfunktion, bei Dialysepatienten sowie bei Kindern und Jugendlichen unter 18 Jahren gibt es bislang keine ausreichende Erfahrung. Pioglitazon sollte deshalb auch bei diesen Patientengruppen nicht eingesetzt werden.
Nebenwirkungen
Die verstärkte Aufnahme von Fettbausteinen aus dem Blut hat die unerwünschte Folge, dass vermehrt Körperfett und Fettgewebe gebildet wird und so Übergewicht resultiert. Das Körpergewicht kann daher während einer Behandlung mit Pioglitazon ansteigen und macht regelmäßige Gewichtskontrollen erforderlich. Außerdem kann durch Pioglitazon die Wassermenge im Körper ansteigen und auch eine verstärkte Wassereinlagerungen im Gewebe auftreten.
Bei randomisiert kontrollierten Studien zum Langzeitgebrauch wurde außerdem von einem vermehrten Frakturrisiko berichtet. Demnach senke das Medikament, vor allem bei Frauen, die Knochendichte in der Lumbalwirbelsäule und der Hüfte, weshalb die Autoren von einer Behandlung mit Glitazonen bei Frauen mit erhöhtem Frakturrisiko abraten.[5]
Im September 2010[6] veranlasste die US-amerikanische Food and Drug Administration die Überprüfung von Pioglitazon hinsichtlich des Risikos Blasenkrebs auszulösen. Zuvor war in zwei klinischen Studien eine erhöhte Erkrankungsrate (Inzidenz) für Blasenkrebs unter Pioglitazongabe beobachtet worden.[7] Im März 2011 folgte eine durch den Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur initiierte Überprüfung. In Frankreich ordnete die zuständige Behörde Afssaps im Juni 2011 nach dem Abschluss einer Kohortenstudie, die ebenfalls ein tendenziell erhöhtes Blasenkrebsrisiko ergeben hatte, die Marktrücknahme für pioglitazonhaltige Medikamente an.[8] Das deutsche Bundesinstitut für Arzneimittel und Medizinprodukte riet im selben Monat davon ab, Patienten neu auf ein pioglitazonhaltiges Arzneimittel einzustellen,[9] der Hersteller gab einen entsprechenden Rote-Hand-Brief heraus.[10] Die europäische Arzneimittelagentur stellte bei einem geringfügig erhöhten Risiko für die Entstehung eines Blasenkrebses ein weiterhin positives Nutzen-Risiko-Verhältnis fest, das eine sorgfältig kontrollierte Therapie rechtfertigt, und rät lediglich bei entsprechend disponierten Patienten von der Behandlung mit Pioglitazon ab.[11][12] Im Juli 2011 veröffentlichte der Hersteller Takeda einen weiteren Rote-Hand-Brief.[13]
Stereoisomerie
Pioglitazon ist chiral und enthält ein Stereozentrum, es gibt also zwei Enantiomere, die (R)-Form und die (S)-Form. Die Handelspräparate enthalten den Arzneistoff als Racemat in Form des Hydrochlorids.
Handelsnamen
Das Pharmaunternehmen Takeda führte den Insulinsensitizer mit dem Wirkstoff Pioglitazon 1999 gemeinsam mit Eli Lilly unter dem Handelsnamen Actos auf dem US-amerikanischen Markt ein. 2000 folgt die Markteinführung in Europa.
- Monopräparate: Actos (D, A, CH und weitere Länder der EU), Glustin (A)
- Kombinationspräparate: Competact (D, A, CH und weitere Länder der EU), Tandemact (D, A), Actoplus Met (USA), Duetact (USA)
Weblinks
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 698, ISBN 978-0-911910-00-1.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Beschluss über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Glitazone zur Behandlung des Diabetes mellitus Typ 2 (PDF; 285 kB) vom 17. Juni 2010.
- onmeda.de: Pioglitazon.
- Meier, Juris J.; Nauck, Michael A.; Schmidt, Wolfgang E.; Gallwitz, Baptist: Diagnose einer eingeschränkten Glukosetoleranz und Diabetesprävention: Kann die Diabetes-Epidemie aufgehalten werden? Dtsch Arztebl 2002; 99(47): A-3182 / B-2685 / C-2500.
- FDA Safety Alerts: Actos (pioglitazone): Ongoing Safety Review – Potential Increased Risk of Bladder Cancer.
- Deutsches Ärzteblatt, 20. September 2010: Pioglitazon: FDA prüft mögliches Blasenkrebsrisiko (Memento des Originals vom 3. Dezember 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- Fiche Médicament sous surveillance renforcée: Actos, Competact – Traitement du diabète de type 2 vom 9. Juni 2011.
- Das BfArM rät derzeit vom Gebrauch pioglitazonhaltiger Arzneimittel ab. BfArM, 10. Juni 2011, archiviert vom Original am 13. April 2012; abgerufen am 13. September 2013.
- Rote-Hand-Brief von Takeda Pharma am 10. Juni 2011. (PDF; 94 kB) Abgerufen am 15. Juni 2011.
- Pressemitteilung der EMA vom 21. Juli 2011; abrufbar als html; zuletzt abgerufen am 22. Juli 2011.
- Europäische Arzneimittelagentur empfiehlt neue Kontraindikationen und Warnhinweise für pioglitazonhaltige Arzneimittel aufgrund eines leicht erhöhten Blasenkrebsrisikos. BfArM, 22. Juli 2011, abgerufen am 22. Juli 2011.
- Rote-Hand-Brief von Takeda Pharma am 28. Juli 2011. (PDF; 138 kB) Abgerufen am 1. August 2011.