Hypericin
Hypericin ist ein rotes Anthrachinon-Derivat und einer der wesentlichen färbenden Bestandteile der Johanniskräuter, insbesondere des Echten Johanniskrauts (Hypericum perforatum). Hypericin wurde als Arzneistoff, hierbei hauptsächlich als Antidepressivum, verwendet. Als Nebenwirkungen der Einnahme wurden phototoxische Reaktionen der Haut, der Augenlinse und der Retina festgestellt; Letzteres kann zur Makuladegeneration führen.[4][5] Die Anwendung von Hypericin als Antidepressivum ist heute umstritten, da bislang kein Wirksamkeitsnachweis für Hypericin erbracht werden konnte.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
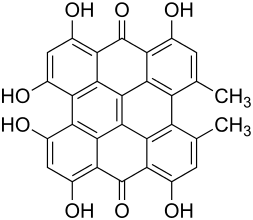 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Hypericin | |||||||||||||||||||||
| Andere Namen |
1,3,4,6,8,13-Hexahydroxy-10,11-dimethylphenanthro[1,10,9,8-opqra]perylen-7,14-dion (IUPAC) | |||||||||||||||||||||
| Summenformel | C30H16O8 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N06AX99 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 504,44 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
schlecht in 1 M Natronlauge (10 g·l−1)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendung
In Deutschland ist Hypericin in allen Arzneien enthalten, die Johanniskräuter beinhalten.[7] Die Zugabe von Hypericin zu Lebensmitteln ist durch den Anhang III der Verordnung (EG) Nr. 1334/2008 (Aromenverordnung) innerhalb der EU einheitlich verboten.
Nebenwirkungen
Das große chromophorartige System des Moleküls bedeutet, dass es im Körper eine phototoxische Reaktion hervorrufen kann, wenn der Stoff (häufig als „natürliches“ Antidepressivum in Form von Johanniskrautprodukten benutzt) in Übermengen oder mit anderen Photosensibilisatoren (synergistischer Effekt) eingenommen wird, da Hypericin die Fotoempfindlichkeit des Körpers erhöht. Nach äußerlicher Anwendung von Hypericin (Bäder/Fußbäder mit Johanniskraut) kann bei Sonnenexposition ein Ödem auftreten.
Hypericin führt zu einer Aktivierung von Cytochrom P450, hierbei vor allem des Subtyps 3A4, in der Leber. Da dieses für die Verstoffwechselung vieler Arzneistoffe verantwortlich ist, wird dadurch der Abbau jener gefördert. Davon betroffen sind u. a. Kontrazeptiva, wodurch die Wirksamkeit der Antibabypille vermindert wird.
Weitere Anwendungen
Da Hypericin sich vorzugsweise in krebsartigem Gewebe sammelt, wird es in der Fluoreszenzdiagnose als Indikator für Krebszellen eingesetzt.[8]
Im Forschungsbereich der photodynamischen Krebstherapie wird Hypericin wegen dieser Eigenschaft auch als Photosensibilisator eingesetzt: Der Patient wird dabei nach der Verabreichung des Sensibilisators mit einem spezifischen Lichtspektrum bestrahlt, welches mit Hilfe von Lampen oder eines Lasers erzeugt wird. Diese Bestrahlung führt zu einer Reaktion des Sensibilisators mit Sauerstoff, wodurch es zur Bildung von Sauerstoffradikalen kommt, was zu einer Schädigung und dem Absterben der bestrahlten Krebszellen führt. Zudem wird die Möglichkeit erprobt, hochresistente Bakterien, etwa Staphylococcus aureus-Stämme in eiternden Brandwunden, mit Hypericin zu sensibilisieren und dann mit Rot- oder IR-Licht abzutöten.
Die antivirale Aktivität von Hypericin beruht hauptsächlich auf der Eigenschaft von Hypericin, mit Licht Sauerstoffradikale zu generieren (Singulett-Sauerstoff, aber auch andere Spezies). Diese Sauerstoffradikale sind toxisch und zerstören organisches Material wie Zellwände, Virenhüllen, genetische Information etc.
Dadurch, dass die Inkubationen von Hypericin mit viralem Material meist nicht vor Licht geschützt stattfanden, inaktivierten Sauerstoffradikale die Viren, was erst zur Entdeckung der antiviralen Aktivität von Hypericin geführt hat. In der Dunkelreaktion zeigt Hypericin meist überhaupt keine antivirale Aktivität.[9]
 Echtes Johanniskraut (Hypericum perforatum)
Echtes Johanniskraut (Hypericum perforatum) Beim Zerreiben der Knospen des Echten Johanniskrauts tritt Hypericin aus („Blut des heiligen Johannes“)
Beim Zerreiben der Knospen des Echten Johanniskrauts tritt Hypericin aus („Blut des heiligen Johannes“) Hypericin-haltiges Johanniskrautöl („Johannisöl, Oleum hyperici“)
Hypericin-haltiges Johanniskrautöl („Johannisöl, Oleum hyperici“)
Biosynthese
Die Biosynthese von Hypericin – ein fluoreszierender, kirschroter Farbstoff – erfolgt aus Emodin.
Analytik
Zur zuverlässigen Bestimmung von Hypericin kann nach adäquater Probenvorbereitung die Kopplung der HPLC mit der Massenspektrometrie herangezogen werden.[10][11][12]
Literatur
- H. Brockmann, F. Kluge, H. Muxfeldt: Totalsynthese des Hypericins. In: Chem. Ber. 1957, S. 2302–2318.
- A. Kubin, F. Wierrani, U. Burner, G. Alth, W. Grünberger: Hypericin–the facts about a controversial agent. In: Current pharmaceutical design. Band 11, Nummer 2, 2005, S. 233–253. PMID 15638760 (Review).
- Heinz Falk: Vom Photosensibilisator Hypericin zum Photorezeptor Stentorin – die Chemie der Phenanthroperylenchinone. In: Angew. Chemie. 111, 1999, S. 3306–3326.
- M. Waser, H. Falk: Towards Second Generation Hypericin Based Photosensitizers for Photodynamic Therapy. 11, 2007, S. 547–558.
Einzelnachweise
- Datenblatt Hypericin (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- Datenblatt Hypericin from Hypericum perforatum bei Sigma-Aldrich, abgerufen am 14. Dezember 2010 (PDF).
- Datenblatt Hypericin bei Sigma-Aldrich, abgerufen am 4. April 2011 (PDF).
- A. R. Wielgus u. a.: Phototoxicity in human retinal pigment epithelial cells promoted by hypericin, a component of St. John’s wort. In: Photochem. Phytobiol. 83, 3, 2007, S. 706–713. PMID 17576381.
- H. Schilcher, S. Kammerer: Leitfaden Phytotherapie. 1. Auflage. Urban & Fischer, 2000, ISBN 3-437-55340-2.
- Alexander Paulke, Manfred Schubert-Zsilavecz, Mario Wurglics: Determination of hypericin and pseudohypericin from Hypericum perforatum in rat brain after oral administration. In: Monatshefte für Chemie. 139, 2008, S. 489, doi:10.1007/s00706-007-0792-1.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 192.
- Zuzana Jendželovská, Rastislav Jendželovský, Barbora Kuchárová, Peter Fedoročko: Hypericin in the Light and in the Dark: Two Sides of the Same Coin. In: Frontiers in Plant Science. Band 7, 6. Mai 2016, doi:10.3389/fpls.2016.00560, PMID 27200034, PMC 4859072 (freier Volltext).
- A. Kubin, F. Wierrani, U. Burner, G. Alth, W. Grünberger: Hypericin–the facts about a controversial agent. In: Current pharmaceutical design. Band 11, Nummer 2, 2005, S. 233–253, PMID 15638760 (Review).
- K. D. Riedel, K. Rieger, M. Martin-Facklam, G. Mikus, W. E. Haefeli, J. Burhenne: Simultaneous determination of hypericin and hyperforin in human plasma with liquid chromatography-tandem mass spectrometry. In: J Chromatogr B Analyt Technol Biomed Life Sci. 813(1-2), 25. Dez 2004, S. 27–33. PMID 15556512.
- X. J. Zhai, F. Chen, C. Chen, C. R. Zhu, Y. N. Lu: LC-MS/MS based studies on the anti-depressant effect of hypericin in the chronic unpredictable mild stress rat model. In: J Ethnopharmacol. 169, 1. Jul 2015, S. 363–369. PMID 25957811.
- F. Liu, C. Pan, P. Drumm, C. Y. Ang: Liquid chromatography-mass spectrometry studies of St. John's wort methanol extraction: active constituents and their transformation. In: J Pharm Biomed Anal. 37(2), 23. Feb 2005, S. 303–312. PMID 15708671.