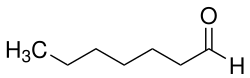
Heptanal
Heptanal ist ein Aldehyd und eine farblose Flüssigkeit mit scharfem unangenehmen Geruch. Der Trivialname lautet Heptaldehyd.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Heptanal | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H14O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,82 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
153 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (1,25 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,4113[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Heptanal kommt natürlich in den essentiellen Ölen von Ylang-Ylang (Cananga odorata), Muskatellersalbei (Salvia sclarea), Zitrone (Citrus x limon), Bitterorange (Citrus x aurantium), Rose (Rosa) und Hyazinthe (Hyacinthus) vor.[4] Die Entstehung von Heptanal bei der fraktionierten Destillation von Rizinusöl[5] wurde bereits 1878 beschrieben. Die großtechnische Darstellung beruht auf der pyrolytischen Spaltung von Ricinolsäureestern[6] (Arkema-Verfahren) und auf der Hydroformylierung von 1-Hexen mit Rhodium-2-Ethylhexanoat als Katalysator unter Zusatz von 2-Ethylhexansäure (Oxea-Verfahren):[7]

Eigenschaften
Heptanal ist eine entzündliche wenig flüchtige farblose Flüssigkeit von durchdringend fruchtigem bis ölig-fettigem Geruch,[8] welche mit Alkoholen mischbar[4] und praktisch unlöslich in Wasser ist.[2] Wegen seiner Oxidationsempfindlichkeit wird Heptanal unter Stickstoff abgefüllt und mit 100ppm Hydrochinon stabilisiert.[9]
Heptanal bildet entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 39,5 °C.[2] Der Explosionsbereich liegt zwischen 1,1 Vol.‑% als untere Explosionsgrenze (UEG) und 5,2 Vol.‑% als obere Explosionsgrenze (OEG).[2] Die Zündtemperatur beträgt 205 °C.[2] Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung
Aus Heptanal kann durch Reduktion mittels Wasserstoffaddition 1-Heptanol produziert werden:
Bei der Oxidation von Heptanal mit Sauerstoff in Gegenwart von Rhodium-Katalysatoren bei 50 °C wird in 95 %iger Ausbeute Heptansäure erhalten.[10] In einer Knoevenagel-Reaktion reagiert Heptanal mit Benzaldehyd unter basischer Katalyse mit hoher Ausbeute und Selektivität (> 90 %) zum alpha-Pentylzimtaldehyd (wegen des jasmintypischen Geruchs auch Jasminaldehyd genannt),[11] das meist als cis/trans-Isomerengemisch in Parfümzubereitungen Verwendung findet.[12]
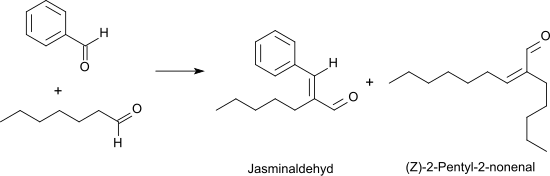
Als Nebenprodukt entsteht durch Selbstkondensation des Heptanals das unangenehm ranzig riechende (Z)-2-Pentyl-2-nonenal.[13] Heptanal kann in Gegenwart von wässriger Borsäure bei azeotroper Entfernung des Wassers praktisch quantitativ in (Z)-2-Pentyl-2-nonenal überführt werden.[14]

Vollständige Hydrierung liefert den auch durch Guerbet-Reaktion aus 1-Heptanol zugänglichen verzweigten primären Alkohol 2-Pentylnonan-1-ol.[15]
Sicherheitshinweise
Das Einatmen, das Verschlucken oder die Aufnahme über die Haut kann zu Gesundheitsschäden führen. Es kann die Atemwege, Verdauungswege und Augen reizen: z. B. Brennen, Kratzen. Es kann weiterhin die Haut reizen: z. B. Brennen, Juckreiz.
Einzelnachweise
- Eintrag zu HEPTANAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Eintrag zu Önanthaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-274.
- G. A. Burdock, Fenaroli’s Handbook of Flavor Ingredients, Fifth Edition, 2005, CRC Press, Boca Raton, Fl., ISBN 0-8493-3034-3.
- F. Krafft, Distillation of castor oil, under educed pressure, Analyst, 3, 329a (1878).
- A. Chauvel, G. Lefebvre, Petrochemical Processes: Technical and Economic Characteristics, Band 2, S. 277, Editions Technip, Paris, 1989, ISBN 2-7108-0563-4.
- Patentanmeldung DE102007053385A1: Verfahren zur Herstellung von Aldehyden. Angemeldet am 9. November 2007, veröffentlicht am 20. Mai 2009, Anmelder: Oxea Deutschland GmbH, Erfinder: Andreas Fischbach et al.
- Richtwerte für gesättigte azyklische aliphatische C4- bis C11-Aldehyde in der Innenraumluft, Bundesgesundheitsbl - Gesundheitsforsch –Gesundheitsschutz, 2009, 52:650–659, doi:10.1007/s00103-009-0860-2.
- Acros Organics, Sicherheitsdatenblatt, Heptaldehyde, stabilized, überarb. am 19. November 2012.
- Patent DE10010771C1: Verfahren zur Herstellung aliphatischer Carbonsäuren aus Aldehyden. Angemeldet am 4. März 2000, veröffentlicht am 3. Mai 2001, Anmelder: Celanese Chem Europe GmbH, Erfinder: Helmut Springer, Peter Lappe.
- M. Perez-Sanchez, P. Dominguez de Maria, Synthesis of natural fragrance jasminaldehyde using silica-immobilized piperazine as organocatalyst, Catal. Sci. Technol., 3, 2732-2736 (2013), doi:10.1039/C3CY00313B
- Riechstofflexikon A, alpha-Amylzimtaldehyd, Letzte Änderung am 4. August 2000.
- J. M. Hornback, Organic Chemistry, 2nd edition, S. 886, Thomson Brooks/Cole, 2006, ISBN 0-534-49317-3.
- R.D. Offenhauer, S.F. Nelsen, Aldehyde and ketone condensation reactions catalyzed by boric acid, J. Org. Chem., 33(2), 775-777 (1968), doi:10.1012/jo01266a059 (zurzeit nicht erreichbar).
- G.H. Knothe: Lipid Chemistry, Guerbet Compounds, AOCS Lipid Library, 22. Dezember 2011.

