2-Hexenal
2-Hexenal ist eine chemische Verbindung aus der Gruppe der Aldehyde. Sie kommt in zwei isomeren Formen (trans- und cis-2-Hexenal) vor, wobei die trans-Form von größerer Bedeutung ist.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Hex-2-enal.svg.png.webp) | |||||||||||||||||||
| Strukturformel von trans-2-Hexenal | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Hexenal | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H10O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,846 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Siedepunkt |
146 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,445 (20 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen

trans-2-Hexenal [(E)-2-Hexenal, auch Blätteraldehyd genannt] gehört zu den Aldehyden, die zum Geschmack von Äpfeln beitragen und die häufig auch als Grünnoten (Geschmack nach grünen Äpfeln, wie Granny Smith) bezeichnet werden. Es entsteht erst beim Zerkleinern oder Kauen im Mund durch eine sehr schnelle enzymatische Umwandlung von Fettsäuren. Bei saurem pH-Wert (wie er in Früchten vorliegt) tritt eine Autooxidation auf und trans-2-Hexenal wandelt sich mit Wasser in 3-Hydroxyhexanal um. Es trägt auch zum Aroma von Kirschen bei[3] und kommt u. a. auch in Wald-Erdbeeren vor.[4]
Die Biosynthese in den Pflanzen geht von der dreifach ungesättigten Linolensäure aus.[5]

Es wirkt auch als Lockstoff für insektenfressende Raubwanzen, der bei der Verdauung von Tabakblättern in den Raupen von Tabakschwärmern entsteht.[6] trans-2-Hexenal wird von gereizten oder verletzten Bettwanzen als Alarmstoff abgesondert.[7]
Gewinnung und Darstellung
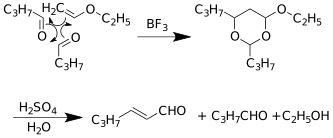
Das trans-Isomer kann durch die Umsetzung von Butanal mit Ethylvinylether in Gegenwart von Bortrifluorid und anschließender Hydrolyse des entstandenen Produkts mit verdünnter Schwefelsäure hergestellt werden.[8]
Eigenschaften
Es handelt sich bei trans-2-Hexenal um eine entzündliche, farblose, licht- und luftempfindliche Flüssigkeit[9], die unlöslich in Wasser ist.[2] Es besitzt einen scharfen, pflanzlich-grünen Geruch mit einer leichten wie Acrolein riechenden Schärfe. Bei Verdünnung riecht es jedoch angenehm grün und Apfel ähnlich.[10]
Verwendung
trans-2-Hexenal wird zur Herstellung anderer chemischer Verbindungen verwendet.[2] In der Parfümerie wird es zur Erzeugung von grünen Noten verwendet, in Aromen als grüne Nuance in Fruchtaromen.[11]
Sicherheitshinweise
Die Dämpfe von trans-2-Hexenal können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 35 °C) bilden.[2]
Einzelnachweise
- Eintrag zu TRANS-2-HEXENAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- Datenblatt trans-2-Hexenal (PDF) bei Merck, abgerufen am 18. März 2012.
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch Der Lebensmittelchemie. Springer-Verlag, 2001, ISBN 978-3-86022-558-5, S. 366, 390, 825 (eingeschränkte Vorschau in der Google-Buchsuche).
- Friedrich Drawert, Roland Tressl, Günter Staudt, Hans Köppler: Gaschromatographisch-massenspektrometrische Differenzierung von Erdbeerarten. In: Zeitschrift für Naturforschung C. 28, 1973, S. 488–493 (PDF, freier Volltext).
- Gordon Hall: Handbuch Aromen und Gewürze, Band 1. 2006, ISBN 978-3-86022-558-5, S. 11 (eingeschränkte Vorschau in der Google-Buchsuche).
- S. Allmann, I. T. Baldwin: Insects Betray Themselves in Nature to Predators by Rapid Isomerization of Green Leaf Volatiles. In: Science. 329, 2010, S. 1075, doi:10.1126/science.1191634.
- Bernd Schäfer: Naturstoffe in der chemischen Industrie, Spektrum Akademischer Verlag, 2007, S. 519, ISBN 978-3-8274-1614-8.
- Patent US2628257: Production of unsaturated aldehydes. Veröffentlicht am 10. Februar 1953, Anmelder: Union Carbide, Erfinder: R. I. Hoaglin, D. H. Hirsh.
- Eintrag zu trans-2-Hexenal bei TCI Europe, abgerufen am 18. März 2012.
- Ullmann, Flavor and Fragrances, Vol. 15
- Fahlbusch, Karl-Georg and Hammerschmidt, Franz-Josef and Panten, Johannes and Pickenhagen, Wilhelm and Schatkowski, Dietmar and and Bauer, Kurt and Garbe, Dorothea and Surburg, Horst: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, 2000, ISBN 978-3-527-30673-2, doi:10.1002/14356007.a11_141.

