Nukleophile Addition
Die nukleophile Addition (kurz AN) (siehe dazu: Nukleophilie) ist ein Reaktionsmechanismus in der organischen Chemie, bei dem ein Nukleophil (Anion oder Lewis-Base) eine Mehrfachbindung angreift. Das Nukleophil wird der angegriffenen Verbindung hinzugefügt (Addition). Es findet kein Austausch von Atomen oder Atomgruppen statt (vergleiche mit: Substitution).[1]
Edukte
Nukleophil
Als Nukleophile können die verschiedensten Verbindungen eingesetzt werden. Dabei handelt es sich um elektronenreiche, meist freie Elektronenpaare enthaltende, Moleküle oder Anionen (siehe unten: Beispiele).
Mehrfachbindungen
Nukleophile Additionen können an unterschiedlichen Typen von Mehrfachbindungen stattfinden:
- Addition an C=C-Doppelbindungen[2]
- Addition an C≡C-Dreifachbindungen
- Addition an konjugierte C-C-Mehrfachbindungen
- Addition an C-X-Mehrfachbindungen
Reaktionsverlauf
Die Addition des Nukleophils ist normalerweise thermodynamisch kontrolliert; das Nukleophil wird so an die Mehrfachbindung angelagert, dass ein möglichst stabiles Anion resultiert (vergleiche hierzu die Begründung der Markownikow-Regel). Die Stabilisierung erfolgt bei C-X-Mehrfachbindungen durch die Heteroatome selbst, bei substituierten CC-Mehrfachbindungen durch induktive Einflüsse von Substituenten, besonders aber durch Substituenten mit −M-Effekt. Da solche Substituenten gleichzeitig das entferntere C-Atom der Doppelbindung positivieren, ist die Addition an diesem auch kinetisch begünstigt.
Nukleophile Addition an C-C-Mehrfachbindungen
Der erste Schritt bei dieser Reaktion besteht in dem Angriff des Nukleophils unter Bildung eines Carbanions:

Im zweiten Schritt reagiert das Carbanion mit einem Elektronenakzeptor, meist einem Proton:
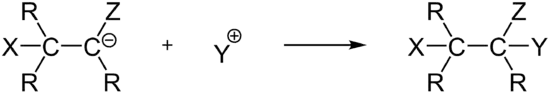
Die Bildung des Carbanions wird stark begünstigt, wenn die Substituenten dieses durch Mesomerie stabilisieren können. Man spricht dann von einer Michael-Addition, wobei das Nukleophil das Anion einer CH-aciden Verbindung ist.
Nukleophile Addition an C-X-Mehrfachbindungen
CX-Mehrfachbindungen kommen in folgenden Atomgruppen vor:
- Carbonylgruppe[3]
- Thiocarbonylgruppe[4]
- Isocyanatgruppe[5]
- Azomethingruppe
- Cyanogruppe
- Isocyanogruppe[5]
Hier kann ein Nukleophil am Kohlenstoff einer CX-Mehrfachbindung angreifen. Die andere Möglichkeit ist, dass zunächst das elektronenziehende Heteroatom in einem vorgelagerten Gleichgewicht protoniert wird und anschließend das Nukleophil am Kohlenstoff bindet.
Beispiele
Nukleophile Addition an C-C-Mehrfachbindungen
- Addition von Ammoniak oder Aminen
- Addition von Cyanwasserstoff
- Michael-Addition
Nukleophile Addition an C-X-Mehrfachbindungen
Die einzelnen nukleophilen Additionen an C-X-Mehrfachbindungen können anhand des angreifenden Nukleophils in Gruppen eingeteilt werden:
Stickstoff als Nukleophil
- Addition von primären Aminen: Diese Reaktion führt zu einer einem Halbacetal entsprechenden Verbindung (Halbaminal), die in einer Folgereaktion unter Wasserabspaltung in ein Azomethin übergeht.

- Addition von sekundären Aminen: Diese Reaktion führt letztendlich zu einem Enamin.
- Addition von Hydrazin
- Addition von Hydroxylamin
- Mannich-Reaktion
Schwefel als Nukleophil
- Mercaptal-Bildung
- Bisulfitaddition
Carbanionischer Kohlenstoff als Nukleophil
Einzelnachweise
- Benno Krieg, Christoph Janiak: Chemie für Mediziner. 2004, ISBN 3-11-017999-7 (Seite 259 nukleophile Additionen bei Aldehyden und Ketonen in der Google-Buchsuche).
- Singh: Advanced Organic Chemistry: Reactions And Mechanisms. Pearson, 2004, ISBN 978-81-317-1107-1 (Seite 193 nucleophilic addition to alkenes and alkynes in der Google-Buchsuche).
- Marye Anne Fox, James K. Whitesell: Organic chemistry. 2004, ISBN 0-7637-2197-2 (Seite 571ff nucleophile, addition or substitution at carbonyl groups in der Google-Buchsuche).
- Alan R. Katritzky, Stanley M. Roberts, Otto Meth-Cohn,Charles Wayne Rees: Comprehensive organic functional group transformations. 1995, ISBN 0-08-042322-1 (Seite 286 in der Google-Buchsuche).
- Alan R. Katritzky: Advances in heterocyclic chemistry, Band 95. 2008, ISBN 978-0-12-374272-8 (Seite 70 in der Google-Buchsuche).