Schiffsche Probe
Die schiffsche Probe ist eine nach ihrem deutsch-italienischen Entdecker Hugo Schiff benannte chemische Reaktion, die zum Nachweis von Aldehyden genutzt wird.
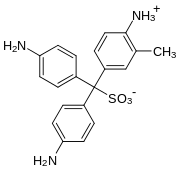
Wirkprinzip
Aldehyde reagieren mit den Aminogruppen der zunächst farblosen Fuchsinschwefligen Säure, einem Anlagerungsprodukt von schwefliger Säure an Fuchsin (s. u.), unter Restaurierung der ursprünglichen sp2-Hybridisierung seines zentralen Kohlenstoffatoms zu wieder farbigen, rosa bis violetten Triphenylmethanfarbstoffen (bathochromer Effekt).[1] Der genaue Mechanismus der insgesamt über mehrere Zwischenstufen verlaufenden Reaktion konnte erst 1980 durch NMR-Spektroskopie aufgeklärt werden.[2] Als Nebenprodukte entstehen dabei regelmäßig weitere Verbindungen, etwa durch Konkurrenzreaktion des eingesetzten Aldehyds mit schwefliger Säure unter Bildung von Hydroxyalkylsulfonationen (vgl. Bisulfit-Reaktion). Bei der Reaktion von Schiffschem Reagenz z. B. mit Formaldehyd können so – je nach Reaktionsgemisch und -bedingungen – mindestens 3 bis 6 verschiedene Verbindungen entstehen.[3]
Herstellung des Schiffschen Reagenzes
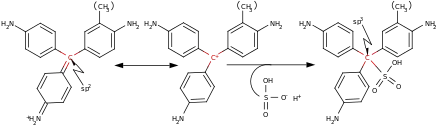
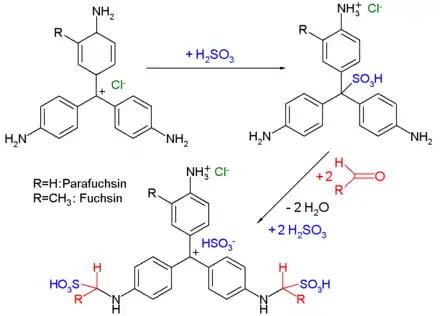
Das Reagenz wird bereitet, indem man zu einer wässrigen Fuchsinlösung tropfenweise Schweflige Säure (wässrige Schwefeldioxidlösung) gibt, bis die rote Farbe des Fuchsins verschwunden ist. Alternativ kann schweflige Säure in situ aus Natriumhydrogensulfit-Lösung (NaHSO3)(aq) durch Ansäuern hergestellt werden. Die Entfärbung des Fuchsins kommt dabei dadurch zustande, dass sich das Schwefelatom der schwefligen Säure an das zentrale Kohlenstoffatom des Fuchsins bindet und so dessen mesomeres Elektronensystem unterbricht, mit der Folge des beobachteten Farbverlusts (hypsochromer Effekt).
Selektivität
Die Reaktion verläuft nicht mit Zuckern und Glyoxal, aromatischen Hydroxyaldehyden und α,β-ungesättigten Aldehyden. Im Unterschied zu Fehlingscher Lösung und Tollens-Reagenz wird nicht die Reduktionswirkung der Aldehyde zu deren Nachweis genutzt.
Einsatzgebiete
In der Histologie und Pathologie kommt die PAS-Färbung zum Einsatz, die mit Periodsäure und schiffscher Probe Glykogen, Cellulose, neutrale Proteoglykane (Glykosaminoglykane/Mucopolysaccharide), Mucoproteine und Glycoproteine anzufärben vermag.
Da die menschliche Haut Aldehyde enthält, entstehen bei Hautkontakt mit dem Reagenz ebenfalls farbige Flecken.
In der Analytik wird Fuchsinschweflige Säure zum qualitativen Nachweis flüchtiger Oxidationsmittel, wie beispielsweise Bromid, welches zu Brom oxidiert und auf einem mit Schiffs Reagenz getränkten Filterpapier detektiert wird,[4] verwendet. Dabei wird die Sulfitgruppe zum Sulfat oxidiert und abgespalten:[5] Es entsteht farbiges Fuchsin aus der farblosen Fuchsinschwefligen Säure.
In der Schulchemie wird der negative Verlauf der Schiffschen Probe mit Glucose häufig als Indiz dafür gedeutet, dass die Aldehyd-Gruppe dieses Moleküls in Form eines intramolekularen Halbacetals gebunden ist und somit nicht mit der Fuchsinschwefligen Säure reagieren kann. Neuere Erkenntnisse zum Reaktionsmechanismus der Schiffschen Probe dagegen lassen eher eine Blockierung der Aldehydgruppe der Glucose durch konkurrierendes Hydrogensulfit vermuten.[6]
Außerdem ist die Probe mit Fuchsinschwefliger Säure neben der Silberspiegel-Probe eine Möglichkeit der Unterscheidung von Aldehyden und Ketonen.[7]
Einzelnachweise
- Wieland, H. and Scheuing, G.: Die Fuchsin-schweflige Säure und ihre Farbreaktion mit Aldehyden. In: Ber. dtsch. Chem. Ges. A/B. Band 54, Nr. 10, 1921, S. 2527, doi:10.1002/cber.19210541002.
- J. H. Robins, G. D. Abrams, J. A. Pincock: The structure of Schiff reagent aldehyde adducts and the mechanism of the Schiff reaction as determined by nuclear magnetic resonance spectroscopy. In: Canadian Journal of Chemistry. Band 4, Nr. 58, 1980, S. 339–347, doi:10.1139/v80-055 (PDF)., zuletzt abgerufen am 20. April 2015.
- Barka T. and Ornstein, L.: SOME OBSERVATIONS OF THE REACTION OF SCHIFF REAGENT WITH ALDEHYDES. In: J Histochem Cytochem. Band 8, Nr. 3, 1960, S. 212, doi:10.1177/8.3.208.
- Europäisches Arzneibuch, 7. Auflage.
- Peter Imming: Arzneibuchanalytik – Grundlagen für Studium und Praxis. 1. Auflage. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2006, ISBN 978-3-8047-2245-3, S. 76 f.
- Karlheinz Seifert: Wieso reagiert Glucose (als eine Aldose) nicht oder nur schwach mit Schiff's Reagenz?; Universität Bayreuth, 2005, zuletzt abgerufen am 19. April 2015.
- Paul Gietz und weitere: Elemente Chemie Oberstufe Einführungsphase Ausgabe Nordrhein-Westfalen (1. Aufl.), Klett Verlag, 2014, S. 61 u. 67.
Weblinks
- Peter Keusch: Nachweis der Aldehyde mit Schiffs Reagenz (Memento vom 14. November 2012 im Internet Archive)