Halbacetale
Halbacetale (oder Hemiacetale) sind organische Verbindungen, die sich durch eine Alkoxygruppe oder Aryloxygruppe –OR und eine Hydroxygruppe -OH auszeichnen, die an dasselbe Kohlenstoff-Atom gebunden sind. Halbacetale entstehen als Zwischenstufe bei der Acetalbildung, indem ein Alkohol säure- oder basenkatalysiert an eine Carbonylgruppe addiert wird. Unter Einwirkung von starken Säuren wird durch Umsetzung mit einem weiteren Molekül des Alkohols schließlich ein Acetal gebildet.[1] Sie besitzen die allgemeine Struktur R1R2C(OH)OR, wobei R kein H sein kann.[2] Cyclische Halbacetale werden Lactole genannt.
| Halbacetale |
|---|
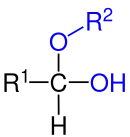 |
| Allgemeine Struktur der Halbacetale mit der blau markierten Alkoxy-/Aryloxy- und Hydroxygruppe, die beide am gleichen Kohlenstoff-Atom gebunden sind. Der Rest R1 stellt dabei einen aliphatischen, cyclischen oder aromatischen Rest oder auch ein Wasserstoff-Atom dar. Der Rest R2 ist kein Wasserstoff-Atom, da es sich sonst um ein geminales Diol handelt. |
Naturstoffe
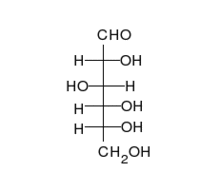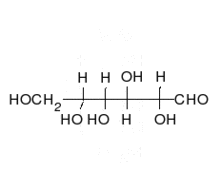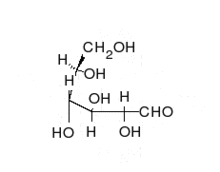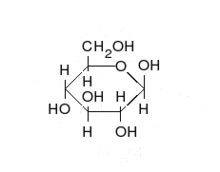
Zahlreiche Zucker sind Aldosen, wie beispielsweise die D-Glucose. Die Aldosen liegen häufig als cyclische Halbacetale vor.
Herstellung
Übersichtsreaktion
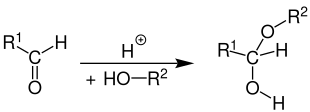
Aldehyde (und Ketone im Falle der Halbketal-Bildung) reagieren unter Säure- oder Basenkatalyse mit Alkoholen in einer nucleophilen Additionsreaktion miteinander und bilden zunächst Halbacetale als Zwischenstufe der Acetalbildung (Ketalbildung).
Reaktionsmechanismus
Das nachfolgende Reaktionsschema soll die mechanistischen Details der säurekatalysierten Halbacetal-Bildung verdeutlichen:

Im ersten Schritt wird zunächst die Carbonylgruppe des Aldehyds am nucleophilen Sauerstoff protoniert (1). Es bildet sich ein mesomeriestabilisiertes Zwischenprodukt (2). Hier liegt parallel ein Oxonium-Ion und ein Carbeniumion vor. An letzteres kann sich nun nucleophil ein Alkohol-Molekül anlagern. Es entsteht erneut ein Oxonium-Ion als Zwischenstufe (3), welches durch Abspaltung des Protons zum Halbacetal reagiert (4). Der Rest R1 im Reaktionsschema stellt dabei entweder einen aliphatischen, cyclischen oder aromatischen Rest oder auch ein Wasserstoff-Atom dar. Der Rest R2 ist ebenso ein aliphatischer, cyclischer oder aromatischer Rest, jedoch kein Wasserstoff-Atom.[3]
Dithiohalbacetale

Wenn man in Halbacetalen die beiden Sauerstoffatome durch Schwefelatome ersetzt erhält man Dithiohalbacetale. Bei der Synthese des Naturstoffes Erythromycin spielte ein Dithiohalbacetal eine zentrale Rolle.[4] Dithiohalbacetale prägen den Geruch der Tropenfrucht Durian.[5]
Siehe auch
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 358, ISBN 3-342-00280-8.
- Eintrag zu hemiacetals. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02774 – Version: 2.1.5.
- K. Peter C. Vollhardt, Neil E. Schore, Katrin-M. Roy, Holger Butenschön: Organische Chemie. 5. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2011, S. 850, ISBN 978-3-527-32754-6
- R. B. Woodward, E. Logusch, K. P. Nambiar, K. Sakan, D. E. Ward, B. W. Auyeung, P. Balaram, L. J. Browne, P. J. Card, C. H. Chen, R. B. Chenevert, A. Fliri; K. Frobel, H. J. Gais, D. G. Garratt, K. Hayakawa, W. Heggie, D. P. Hesson, D. Hoppe, I. Hoppe, J. A. Hyatt, D. Ikeda, P. A. Jacobi, K. S. Kim, Y. Kobuke, K. Kojima, K. Krowicki, V. J. Lee, T. Leutert, S. Malchenko, J. Martens, R. S. Matthews, B. S. Ong, J. B. Press, T. V. Rajanbabu, G. Rousseau, H. M. Sauter, M. Suzuki, K. Tatsuta, L. M. Tolbert, E. A. Trusdale, I. Uchida, Y. Ueda, T. Uyehara, A. T. Vasella, W. C. Vladuchick, P. A. Wade, R. M. Williams, H. N. C. Wong: Asymmetric Total Synthesis of Erythromycin. 1. Synthesis of an Erythronolide A Seco Acid Derivative via Asymmetric Induction, J. Am. Chem. Soc. 1981, 103, 3210-3213, doi:10.1021/ja00401a049.
- Volker Mrasek: Das Geheimnis der Stinkfrucht – Deutsche Forscher untersuchen die asiatische Durian, Deutschlandfunk „Forschung aktuell“ vom 11. Februar 2013.