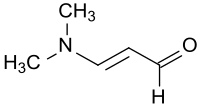
3-Dimethylaminoacrolein
3-Dimethylaminoacrolein ist eine stabile und wesentlich untoxischere Vorstufe für den genotoxischen, mutagenen und potentiell auch beim Menschen karzinogenen Malondialdehyd.[6] Die Verbindung kann als vinyloges Dimethylformamid (DMF) aufgefasst werden und vereinigt die Funktionalitäten eines ungesättigten Aldehyds und eines Enamins. Daher eignet sich 3-Dimethylaminoacrolein und die daraus abgeleiteten Vinamidine (zusammengezogen aus vinyloge Amidine) bzw. Vinamidiniumsalze (substituierte 1,5-Diazapentadiene)[7] als reaktiver Molekülbausteine insbesondere zum Aufbau von stickstoffhaltigen Heterocyclen, wie z. B. von Pyridinen, Pyrimidinen, Pyrrolen oder Pyrazolen.[8]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Dimethylaminoacrolein | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H9NO | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 99,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser,[3] in Methanol[4] und in 1,2-Dichlorethan[5] | ||||||||||||||||||
| Brechungsindex |
1,584 – 1,588 bei 20 °C (589 nm)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
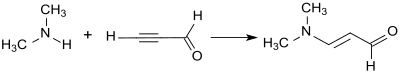
Bei der Addition von Dimethylamin an die Dreifachbindung von Propargylaldehyd im Sinne einer Vinylierung nach Reppe entsteht 3-Dimethylaminoacrolein in 88%iger Ausbeute als gelbes Öl.[3]
Wegen seiner Explosionsneigung[9] ist Propargylaldehyd ein unzweckmäßiger Ausgangsstoff für industrielle Synthesen von 3-(Dimethylamino)-2-propenal.
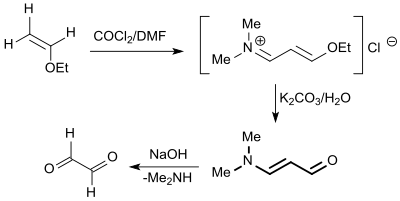
Besser geeignet sind Vinylether, wie z. B. Ethylvinylether,[10] die mit dem aus Dimethylformamid (DMF) und Phosgen gebildeten Vilsmeier-Reagenz in 68%iger Ausbeute zu 3-Ethoxypropenyliden-dimethylammonium-chlorid, einem Enolether-Iminiumsalz reagieren. Im schwach alkalischen Milieu wird daraus 3-Dimethylaminoacrolein gebildet, das bei Einwirkung starker Basen, wie z. B. Natronlauge, Dimethylamin unter Bildung von Malondialdehyd abspaltet.
Mit dem einfacher zu handhabenden Isobutylvinylether, DMF und Phosgen werden bei kontinuierlicher Prozessführung höhere Ausbeuten (>80 %) des Iminiumsalzes erzielt.[4], aus dem mit verdünnter Natronlauge das 3-Dimethylaminoacrolein in 86%iger Ausbeute erhalten wird.[11]
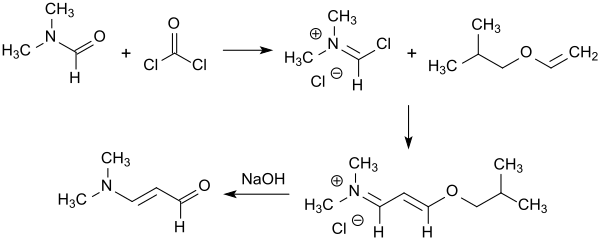
Statt mit Phosgen kann das Iminiumsalz auch mit einem anorganischen Säurechlorid, wie z. B. Phosphoroxychlorid oder einem organischen Säurechlorid, wie z. B. Oxalylchlorid hergestellt werden.
Eigenschaften
3-Dimethylaminoacrolein ist eine klare, hellgelbe und gut wasserlösliche Flüssigkeit, die schwach alkalisch reagiert und mit Eisen(III)-chlorid eine tiefrote Färbung ergibt. Die Verbindung „bewirkt eine Aufhebung der hypnotischen Wirkung des Morphins bei Mäusen“ und besitzt „stimulierende Wirkung am Menschen“.[3]
Verwendung
Reaktionen mit 3-Dimethylaminoacrolein
3-Dimethylaminoacrolein kann zur Einführung ungesättigter und reaktiver C3-Gruppen in CH-acide und nukleophile Verbindungen eingesetzt werden.
Die aktivierte Aldehydgruppe des 3-Dimethylaminoacroleins reagiert quantitativ mit Dialkylsulfaten, wie z. B. Dimethylsulfat unter Bildung von reaktionsfähigen, aber instabilen Addukten[12], die bei 110 °C wieder in die Edukte zerfallen. Die Addukte lassen sich leicht mit Nukleophilen wie Alkoholaten oder Aminen zu den entsprechenden vinylogen Amid-Acetalen bzw. Amidinen umsetzen.[13]
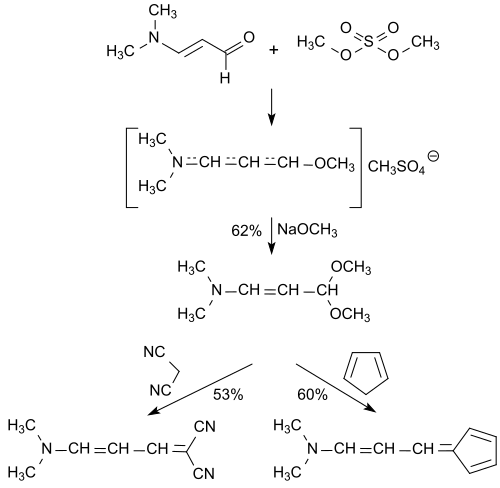
Durch Reaktion mit Natriummethanolat entsteht in 62%iger Ausbeute das stabile 3-Dimethylaminoacrolein-dimethylacetal, das mit CH-aciden Verbindungen, wie z. B. Malodinitril zu 1,3-Butadien-Derivaten oder mit Cyclopentadien zu einem Aminofulven reagiert.
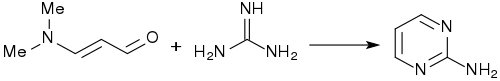
Mit Guanidin bildet 3-Dimethylaminoacrolein fast quantitativ 2-Aminopyrimidin.[4]
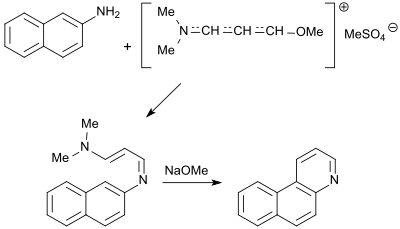
Das mit 2-Naphthylamin und dem Dimethylsulfat-Addukt entstehende Amidin kann mit Natriummethanolat zum Benzo[f]chinolin (1-Azaphenanthren) cyclisiert werden.[14]
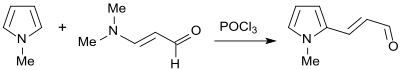
N-Methylpyrrol bildet mit 3-Dimethylaminoacrolein und POCl3 in 49%iger Ausbeute das 3-(2-N-Methylpyrrol)propenal.[15]
Analog verläuft die Herstellung einer Zwischenstufe des Cholesterinsenkers Fluvastatin bei der Reaktion eines fluorarylsubstituierten N-IsopropylIndols mit 3-Dimethylaminoacrolein und POCl3.[16][17]
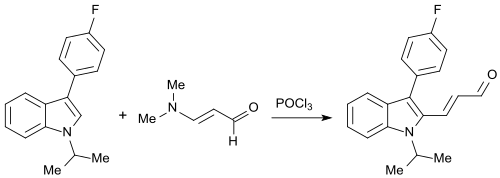
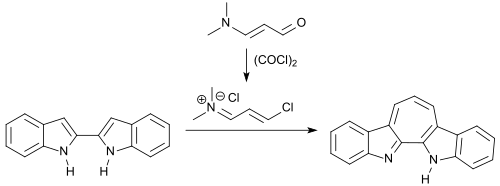
2,2'-Bisindole können bei der Reaktion mit 3-Dimethylaminocrolein und Oxalylchlorid durch das (wie im vorangehenden Beispiel) intermediär entstehenden 1-Chlor-3-(N,N-dimethylamino)propeniumchlorid unter Bildung einer Siebenringstruktur verbrückt werden.[18]
Gelegentlich wird auch das Iminiumsalz aus der Reaktion des Vilsmeier-Reagenz und dem Vinylether als Vorstufe des 3-Dimethylaminoacroleins direkt zur Synthese, z. B. von Pyrazolen eingesetzt.[19]
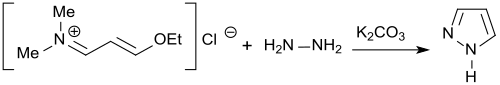
Bei Einsatz von Hydrazinhydrat entsteht der Grundkörper Pyrazol in 84%iger Ausbeute.
Reaktionen zu Vinamidiniumsalzen
Die Umsetzung von 3-Dimethylaminoacrolein mit Dimethylammonium-tetrafluoroborat erzeugt praktisch quantitativ das Vinamidiniumsalz 3-Dimethylaminoacrolein-dimethyliminium-tetrafluoroborat, das als Perchloratsalz besser kristallisiert und mit Cyclopentadien in Gegenwart von Natriumamid in flüssigem Ammoniak ebenfalls zum Aminofulvenderivat reagiert.[20]
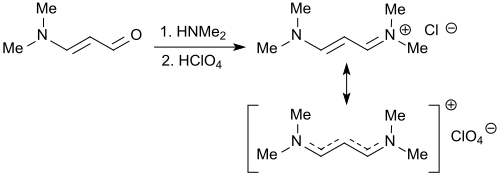
Dasselbe Vinamidiniumsalz 1,1,5,5-Tetramethyl-1,5-diazapentadieniumchlorid entsteht auch bei der Reaktion von 3-Dimethylaminoacrolein mit Dimethylamin-hydrochlorid in 70%iger Ausbeute.[21]
Die in zwei Stufen erfolgende Einwirkung von Dimethylamin und 70%iger Perchlorsäure auf 3-Dimethylaminoacrolein bildet ebenfalls das hier als 1,3-Bis(dimethylamino)trimethiniumperchlorat bezeichnete Iminiumsalz.[22]
Lactone, wie z. B. γ-Butyrolacton oder cyclische Ketone, wie z. B. Cyclopentanon bilden mit dem Vinamidiniumsalz aus 3-Dimethylaminoacrolein und Dimethylamin-hydrochlorid in 91%iger bzw. 88%iger Ausbeute die entsprechenden Dienaminone.[23]
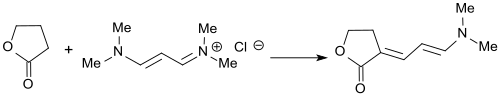
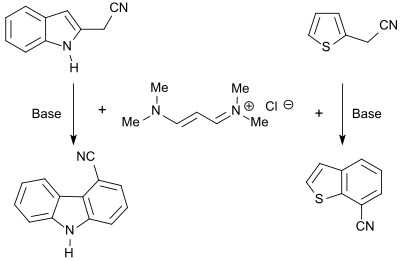
Das Vinamidiniumsalz 1,1,5,5-Tetramethyl-1,5-diazapentadieniumchlorid reagiert mit Heterocyclen, die CH-acide Gruppen tragen, unter Bildung der entsprechenden Dienamine, die mit Basen zu anellierten Heteroaromaten, wie z. B. Carbazole, Benzofurane oder Benzothiophene cyclisiert werden können.[7]
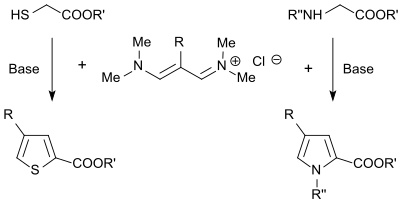
N-Alkylpyrrole werden in guter Ausbeute (86 %) bei der Umsetzung des Vinamidiniumsalzes mit Glycinestern[24], substituierte Thiophene (bis 87 %) bei der Umsetzung mit Mercaptoessigsäureestern erhalten.[25]
Von industriellem Interesse ist die Verwendung von 3-Dimethylaminoacrolein zur Synthese von 2-Chlornicotinsäure (2-CNA) als wichtigem Edukt für Agro- und Pharmawirkstoffe. Hierzu wird 3-Dimethylaminoacrolein mit Cyanessigsäureethylester[26] zum 2-Chlornicotinsäureethylester bzw. mit Cyanessigsäure-n-butylester zum 2-Chlornicotinsäure-n-butylester[27] in einer Knoevenagel-Reaktion umgesetzt.
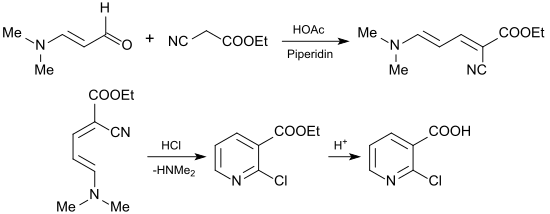
Die anfallenden Ester der 2-Chlorpyridincarbonsäure können glatt zur 2-Chlornicotinsäure hydrolysiert werden.
Einzelnachweise
- Eintrag zu 3-(Dimethylamino)acrolein bei TCI Europe, abgerufen am 15. Juni 2017.
- Datenblatt 3-(Dimethylamino)acrolein 90 % bei Sigma-Aldrich, abgerufen am 15. Juni 2017 (PDF).
- Patent DE944852: Verfahren zur Herstellung von Derivaten des 3-Amino-acroleins. Angemeldet am 25. August 1955, veröffentlicht am 28. Juni 1956, Anmelder: Badische Anilin- & Soda-Fabrik AG, Erfinder: F. Wille.
- Patent DE2424373: Verfahren zur Herstellung von Derivaten des Malondialdehyds. Angemeldet am 20. Mai 1975, veröffentlicht am 11. Dezember 1975, Anmelder: BASF AG, Erfinder: M. Decker, W. Schönleben, H. Toussaint, H. Hoffmann.
- Patent US5780622: Methods of synthesizing 5,15-diarylbenzochlorine-7-one. Angemeldet am 11. August 1997, veröffentlicht am 14. Juli 1998, Anmelder: The University of British Columbia, Erfinder: D. Dolphin, R. Boyle.
- L. J. Niederhofer, J. S. Daniels, C. A. Rouzer, R. E. Greene, L. J. Marnett: Malondialdehyde, a product of lipid peroxidation, is mutagenic in human cells. In: J. Biol. Chem. Band 278, 2003, S. 31426–31433, doi:10.1074/jbc.M212549200.
- D. Lloyd, H. McNab: Vinamidine and Vinamidinium-Salze – Beispiele für stabilisierte Push-Pull-Alkene. In: Angew. Chem. Band 88, Nr. 15, 1976, S. 496–504, doi:10.1002/ange.19760881503.
- S. Makhseed, H. M. E. Hassaneen, M. H. Elnagdi: Studies with 2-(Arylhydrazono)aldehydes: Synthesis and Chemical Reactivity of Mesoxalaldehyde 2-Arylhydrazones and of Ethyl 2-Arylhydrazono-3-oxopropionates. In: Z. Naturforsch. 62b, 2007, S. 529–536 (znaturforsch.com [PDF]).
- P. Perlmutter: Propargyl Aldehyde. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rp262m.
- Z. Arnold, F. Sorm: Synthetische Reaktionen von Dimethylformamid. I. Allgemeine Synthese von β-Dialdehyden. In: Collect. Czech. Chem. Commun. Band 23, Nr. 3, 1958, S. 452–461, doi:10.1135/cccc19580452.
- Patent DE19825200C1: Verfahren zur Herstellung von 3-Aminoacroleinderivaten. Angemeldet am 5. Juni 1998, veröffentlicht am 18. November 1999, Anmelder: BASF AG, Erfinder: D. Golsch, M. Keil, H. Isak.
- H. Bredereck, F. Effenberger, G. Simchen: Säureamid-Reaktionen, XXXII. Über Säureamid-Dialkylsulfat-Komplexe. In: Chem. Ber. Band 96, Nr. 5, 1963, S. 1350–1355, doi:10.1002/cber.19630960526.
- H. Bredereck, F. Effenberger, D. Zeyfang: Synthese und Reaktionen vinyloger Amidacetale und Amidine. In: Angew. Chem. Band 77, Nr. 5, 1965, S. 219, doi:10.1002/ange.19650770511.
- C. Jutz, C. Jutz, R. M. Wagner: Die synchrone Sechs-Elektronen-Cyclisierung von Hexatrien-Systemen als neues Syntheseprinzip zur Darstellung von Aromaten und Heteroaromaten. In: Angew. Chem. Band 84, Nr. 7, 1972, S. 299–302, doi:10.1002/ange.19720840714.
- F. W. Ulrich, Eberhard Breitmaier: Vinyloge Vilsmeier-Formylierung mit 3-(N,N-Dimethylamino)-acroleinen. In: Synthesis. Band 8, 1983, S. 641–645, doi:10.1055/s-1983-30457.
- D. Sriram, P. Yogeeswari: Medicinal Chemistry. 2. Auflage. Pearson, Delhi 2010, ISBN 978-81-317-3144-4, S. 364.
- J.T. Zacharia, T. Tanaka, M. Hagashi: Facile and highly enenatioselective synthesis of (+)- and (-)-fluvastatin and their analogues. In: J. Org. Chem. Band 75, Nr. 22, 2010, S. 7514–7518, doi:10.1021/jo101542y.
- Y. Kumai, R. Miyatake, Y. Sugeno, A. Ohta, M. Oda: Synthesis and spectroscopic properties of 1H-cyclohepta[2,1-b:3,4-b']diindole and molecular structure of its protonated species. In: Amer. J. Org. Chem. Band 5, Nr. 1, 2015, S. 10–13, doi:10.5923/j.ajoc.20150501.02.
- Patent EP0731094A1: Verfahren zur Herstellung von Pyrazolen. Angemeldet am 23. Februar 1996, veröffentlicht am 11. September 1996, Anmelder: Bayer AG, Erfinder: H.-J. Wroblowsky, R. Lantzsch.
- Z. Arnold, J. Zemlicka: Reaktionen der Formamidinium-salze und ihrer Vinyloge mit Carbanionen. In: Collect. Czech. Chem. Commun. Band 25, Nr. 5, 1960, S. 1302–1307, doi:10.1135/cccc19601302.
- V. Nair, C. S. Cooper: Chemistry of 1,5-diazapentadienium (vinamidinium) salts: alkylation reactions to multifunctional dienamines and dienaminones. In: J. Org. Chem. Band 46, Nr. 23, 1981, S. 4759–4765, doi:10.1021/jo00336a027.
- Z. Arnold, D. Dvorak, M. Havranek: Convenient preparation of 1,3-Bis(dimethylamino)trimethinium perchlorate, tetrafluoroborate and hexafluorophosphate. In: Collect. Czech. Chem. Commun. Band 61, Nr. 11, 1996, S. 1637–1641, doi:10.1135/cccc19961637.
- V. Nair, C. S. Cooper: Selective alkylation reactions with vinamidinium salts. In: Tetrahedron Lett. Band 21, Nr. 33, 1980, S. 3155–3158, doi:10.1016/S0040-4039(00)77433-8.
- M. T. Wright, D. G. Carroll, T. M. Smith, S. Q. Smith: Synthesis of alkylpyrroles by use of a vinamidinium salt. In: Tetrahedron Lett. Band 51, Nr. 31, 2010, S. 4150–4152, doi:10.1016/j.tetlet.2010.06.009.
- R. T. Clemens, S. Q. Smith: The application of vinamidinium salts to the synthesis of 2,4-disubstituted thiophenes. In: Tetrahedron Lett. Band 46, Nr. 8, 2005, S. 1319–1320, doi:10.1016/j.tetlet.2004.12.113.
- Patent EP0372654A2: Preparation of 2-chloropyridine 3-carboxylic acid esters. Angemeldet am 5. Dezember 1989, veröffentlicht am 13. Juni 1990, Anmelder: Shell Internationale Research Maatschappij B.V., Erfinder: L. Schröder.
- Patent WO0007989A1: Verfahren zur Herstellung von 2-Halogennikotinsäurederivaten und 2-Halogennikotinsäure-n-butylester als Zwischenprodukt. Angemeldet am 14. Juli 1999, veröffentlicht am 17. Februar 2000, Anmelder: BASF AG, Erfinder: D. Golsch, M. Keil, H. Isak, H. Mayer.
