Amidine
Amidine sind eine Stoffgruppe organisch-chemischer Verbindungen, die man formal als Derivate von Carbonsäureamiden beschreiben kann, bei denen die Carbonylgruppe durch eine Carbiminogruppe ersetzt ist. Die Chemie der Amidine wurde grundlegend durch Adolf Pinner (1842–1909) erforscht.
Struktur
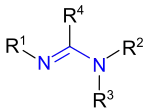
Die nicht cyclischen Amidine haben die allgemeine Strukturformel R4–C(=NR1)–NR2R3, wobei die Reste R Wasserstoff-Atome oder Organyl-Reste sind.[1]
Das strukturell einfachste Amidin mit R1 bis R4 = H nennt sich Formamidin und leitet sich von der Ameisensäure (lat. acidum formicum) ab. Bei R4 = CH3 (Methylgruppe) und R1 bis R3 = H handelt es sich um das von der Essigsäure abgeleitete Acetamidin.
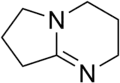
Als starke organische Basen sind die bicyclischen Amidine DBN und DBU wichtig bei denen beide N-Atome Bestandteile der Ringsysteme sind.
Synthese
Amidine lassen sich in einem mehrstufigen Prozess mit der Pinner-Reaktion herstellen. Diese Reaktion geht aus von den entsprechenden Nitrilen R1–CN, die mit HCl aktiviert und dann mit Alkoholen zu Imidsäureestern, den Pinner-Salzen, umgesetzt werden. Aus diesen Salzen entstehen durch Zugabe von Aminen die Amidine.
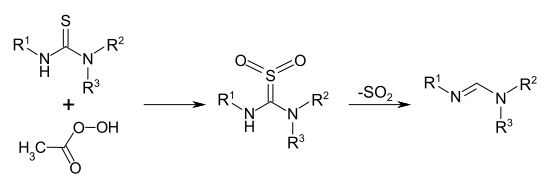
Die Herstellung von Formamidinen als den Derivaten der Ameisensäure ist auf diese Weise nicht möglich, denn um die betreffenden Pinnersalze herzustellen, müsste an Stelle eines Nitrils die flüchtige und giftige Blausäure selbst eingesetzt werden. Deshalb gibt es z. B. zur Herstellung von tri-substituierten Formamidinen spezielle Methoden, die von tri-substituierten Thioharnstoffen R–NH–C(=S)–NR2 ausgehen. Die Thioharnstoffe werden durch Oxidation mit Peressigsäure in die betreffenden Thioharnstoff-S-S-Dioxide R–NH-C(=SO2)–NR2 überführt. Diese instabilen Verbindungen spalten Schwefeldioxid SO2 ab und dadurch bilden sich die entsprechend substituierten Formamidine R–N=CH–NR2.[2]
Eigenschaften und Verwendung
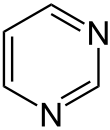
Amidine sind zusammen mit 1,3-Diketonen die Bausteine zur Synthese von Pyrimidinen.[3]
Amidine sind mit einem pK-Wert von 13,6 nahezu so starke Basen wie Natriumhydroxid und bilden mit Säuren stabile Salze. Protoniert wird die sp2-hybridisierte Iminogruppe =NH unter Bildung eines mesomeriestabilisierten Kations, das sich nur nach Protonierung am Iminostickstoff bilden kann.
Auch die beiden bicyclischen Amidine DBU und DBN sind sehr starke Basen und haben für die Anwendung in der synthetischen organischen Chemie gegenüber anderen starken Basen wie Alkalihydroxiden, Alkalialkoholaten oder Alkalihydriden noch einen weiteren Vorteil: Die großen, voluminösen bicyclischen organischen Basen sind in organischen Lösungsmitteln gut löslich und zeigen keine nucleophilen Eigenschaften, sie sind nicht-nucleophile Basen.
Ihre Moleküle sind zwar sehr voluminös, können aber leicht erreichbare Protonen angreifen und binden. Sie eignen sich gut dazu, Eliminierungsreaktionen einzuleiten (z. B. Eliminierung von HCl aus Chloralkanen unter Bildung von Alkenen). Die voluminösen Basen sind jedoch nicht in der Lage, abgeschirmte C- Atome nucleophil anzugreifen, sodass es nicht zu unerwünschten Substitutionsreaktionen kommt.[3]
Einzelnachweise
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 63.
- Wolfgang Walter, Klaus-Peter Rueß: Über die Oxydationsprodukte von Thiocarbonsäureamiden, XXIV. Darstellung derS.S-Di- undS.S.S-Trioxide trisubstituierter Thioharnstoffe und eine neue Methode zur präparativen Gewinnung trisubstituierter Formamidine. In: Chemische Berichte. Band 102, Nr. 8, August 1969, S. 2640–2650, doi:10.1002/cber.19691020820.
- Clayden, Greeves Warren, Wothers: Organic Chemistry. Oxford University Press Inc, New York 2001, ISBN 978-0-19-850346-0, S. 202, 482.
.svg.png.webp)
azepine_200.svg.png.webp)