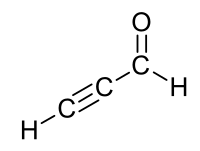
Propinal
Propinal ist eine organische Verbindung mit der Summenformel C3H2O. Es ist die einfachste chemische Verbindung eines Aldehyds mit einer C≡C-Dreifachbindung und gehört zur Stoffklasse der Alkinale.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propinal | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H2O | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis braune Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 54,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Ethanol, Diethylether, Benzol, Toluol, Aceton[4], in Chloroform und Methanol[1] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Das Vorkommen von Propinal neben den C3H2O-Isomeren Cyclopropenon und Propadienon H2C=C=C=O wurde in Molekülwolken im interstellaren Raum nachgewiesen.[7]
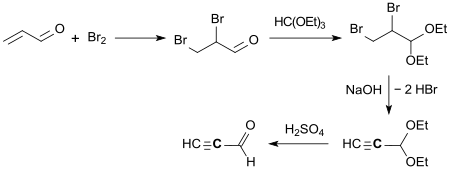
Die chemische Synthese von Propargylaldehyd wurde erstmals 1898 von Ludwig Claisen berichtet.[3] Ausgehend von 2,3-Dibrompropionaldehyd-diethylacetal (aus Acrolein durch Brom-Addition und Acetalisierung mit Orthoameisensäuretriethylester) wird durch zweifache Dehydrobromierung (Abspaltung von Bromwasserstoff HBr) Propinal-diethylacetal gebildet, das mit Schwefelsäure zum freien Propinal gespalten wird.[8]
Eine Laborvorschrift aus Organic Syntheses beschreibt die Herstellung von Propinal durch Oxidation von Propargylalkohol mit giftigem, mutagenem und karzinogenem Chrom(VI)-oxid und Schwefelsäure in bescheidener Ausbeute von 35 bis 41 %.[6] In einer verbesserten Variante mit Methylethylketon MEK als Lösungsmittel für Propinol und Zugabe einer wässrigen Lösung von Chromtrioxid/Schwefelsäure bei Raumtemperatur wird eine Ausbeute von 91 % erzielt.[2] Wegen der problematischen Eigenschaften von Chromtrioxid und der schwierigen Aufarbeitung und Entsorgung von Cr(VI)-Salzen ist diese Syntheseroute nicht mehr zeitgemäß.
Auch für größere Ansätze geeignet erscheint die Vakuum-Pyrolyse des einfach zugänglichen Dipropargylethers (in einer Williamson-Ethersynthese aus Propinol und Propargylbromid zugänglich)[9] bei 750 °C zu Propinal (80 % Ausbeute) und Propadien.[10]

Eigenschaften
Propinal ist als Reinsubstanz eine farblose Flüssigkeit, die sich in Wasser und vielen organischen Lösungsmitteln löst. Bei längerem Stehen verfärbt sich die Verbindung von gelb nach braunrot.[11] Nach L. Claisen ist „der Propargylaldehyd ein Liquidum, welches Nase und Augen ebenso heftig oder noch stärker reizt als Acrolein“.[3] Spuren von Peroxiden oder Basen können eine explosionsartige Polymerisation von in Glasbehältern gelagertem Propargylaldehyd initiieren.[12] Daher sollte Propinal mit Vorsicht in maximal 10 %iger Lösung in höhersiedenden Lösungsmitteln, z. B. Toluol, gehandhabt und in Lagerbehältern aus Aluminium oder Kunststoff aufbewahrt werden.
Anwendungen
Additionen an die Dreifachbindung
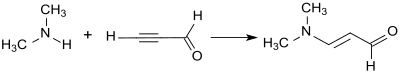
Bei der Addition von Dimethylamin an die Dreifachbindung von Propargylaldehyd im Sinne einer Vinylierung nach Reppe entsteht 3-Dimethylaminoacrolein in 88%iger Ausbeute als gelbes Öl.[13]
In ähnlicher Weise addieren Nukleophile mit Hydroxygruppen oder Thiolgruppen an Propinal unter Bildung von in 3-Stellung substituierten Acroleinen, die eine Doppelbindung in Konjugation mit einer Carbonylgruppe im Molekül aufweisen.

So erzeugt die Michael-Addition von 3-Mercaptopropionsäuremethylester an Propinal ein cis/trans-Isomerengemisch eines 3-thiosubstituierten Acroleins, da durch Behandlung mit Iod in vollständig in das stabilere trans-Isomere überführt werden kann.[14]
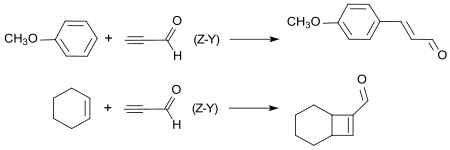
In einer [1,4]-Addition reagiert Propinal, das durch Einschluss in Zeolith-Y-Käfigstrukturen sowohl stabilisiert als auch aktiviert wird, mit wenig reaktiven Methoxybenzolen, wie z. B. Anisol zu dem Aromastoff 4-Methoxyzimtaldehyd oder in einer [2+2]-Cycloaddition mit unreaktiven Cycloalkenen, wie z. B. Cyclohexen zu dem bicyclischen ungesättigten Aldehyd Bicyclo[4.2.0]oct-7-en.[15]
Additionen an die Carbonylgruppe
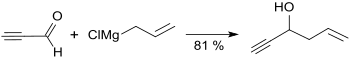
Grignard-Verbindungen addieren leicht an die Carbonylgruppe des Propargylaldehyds, wobei die entsprechenden sekundären Alkohole gebildet werden.[4]
Cycloadditionen mit Propinal
Die 1,3-Dipolare Cycloaddition von Aziden, z. B. Trimethylsilylazid (CH3)3SiN3 an Propargylaldehyd liefert 4-Formyl-1,2,3-triazol in brauchbarer Ausbeute.[16]

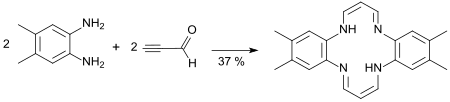
1,2-Diaminobenzole kondensieren beim Erhitzen in einem Methanol/Dimethylformamid-Gemisch unter Cyclisierung zu Tetraaza[14]annulenen, die Schwermetallionen, wie z. B. Mangan3+, Nickel2+ oder Kupfer2+, komplexieren und als Modellverbindungen für Porphyrine dienen können.[17]
Einzelnachweise
- Propynal. Abgerufen am 28. Oktober 2019.
- M.G. Veliev, M.M. Guseinov: An improved synthesis of propynal. In: Synthesis. Band 6, 1980, S. 461, doi:10.1055/s-1980-29052.
- L. Claisen: Propargylaldehyd und Phenylpropargylaldehyd. In: Ber. Dtsch. Chem. Ges. Band 31, Nr. 1, 1898, S. 1021–1023, doi:10.1002/cber.189803101185.
- Patrick Perlmutter: Propargyl Aldehyde. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rp262m.
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 24.
- J.C. Sauer: Propiolaldehyde In: Organic Syntheses. 36, 1956, S. 66, doi:10.15227/orgsyn.036.0066; Coll. Vol. 4, 1963, S. 813 (PDF).
- J.-C. Louisen et al.: The interstellar chemistry of H2C3O isomers. In: Monthly Notices of the Astronomical Society. Band 456, Nr. 4, 2016, S. 4101–4110, doi:10.1093/mnras/stv2866 (arxiv.org [PDF]).
- V.K. Ahluwalia, R. Aggarwal: Organic Syntheses: Special Techniques. Alpha Science International Ltd., Pangbourne, UK 2001, ISBN 1-84265-058-0, S. 27–28.
- R.E. Geiger, M. Lalonde, H. Stoller, K. Schleich: Kobalt-katalysierte Cycloadditionen von Alkinen und Nitrilen zu Pyridinen: Ein neuer Zugang zu Pyridoxin (Vitamin B6). In: Helv. Chim. Acta. Band 67, Nr. 5, 1984, S. 1274–1282, doi:10.1002/hlca.19840670513.
- H. McNab, G. Morel, E. Stevenson: A short, convenient synthesis of propynal. In: J. Chem. Res. (S). Band 6, 1997, S. 207, doi:10.1039/A700453B.
- F. Wille, L. Saffer, W. Weißkopf: Zur Kenntnis des Propargylaldehyds I: Darstellung, Polymerisation und Reaktion mit Aminen. In: Justus Liebigs Ann. Chem. Band 568, Nr. 1, 1950, S. 34–46, doi:10.1002/jlac.19505680103.
- D. Makula, P. Lamy: Sécurité: Stabilité de l’aldehyde propargylique (propynal). In: L’actualité chimique. Juin-Juillet, Nr. 103, 1983, S. 31–34 (www.lactualitechimique.org/numero/103).
- Patent DE944852: Verfahren zur Herstellung von Derivaten des 3-Amino-acroleins. Angemeldet am 25. August 1955, veröffentlicht am 28. Juni 1956, Anmelder: Badische Anilin- & Soda-Fabrik AG, Erfinder: F. Wille.
- R. Hanko, M.D. Hammond, R. Fruchtmann, J. Pfitzner, G.A. Place: Design, synthesis, and 5-lipoxygenase-inhibiting properties of 1-thiosubstituted butadienes. In: J. Med. Chem. Band 33, Nr. 4, 1990, S. 1163–1170, doi:10.1021/jm00166a013.
- D. Hayashi, Y. Igura, Y. Masui, M. Onaka: Stabilization and activation of unstable propynal in the zeolite nanospace and its application to addition reactions. In: Catal. Sci. Technol. Band 19, Nr. 7, 2017, S. 4422–4440, doi:10.1039/C7CY01161J.
- M.M. Demina, P.S. Novopashin, G.I. Sarapulova, L.I. Larina, A.S. Smolin, V.S. Fundamenskii, A.A. Kashev, A.S. Medvedeva: 1,3-Dipolar cycloadditions of trimethylsilyl azide to propynals and dimerization of 1H-1,2,3-triazole-5-carbaldehydes to tricyclic bis-hemiaminals. In: Russian J. Org. Chem. Band 40, Nr. 12, 2004, S. 1804–1809, doi:10.1007/s11178-005-0103-4.
- K. Sakata, H. Nakamura, M. Hashimoto: Preparation and characterization of isothiocyanatomanganese(III) complexes of tetraaza[14]annulenes. In: Inorg. Chim. Acta. Band 83, Nr. 3, 1984, S. L67–L70, doi:10.1016/S0020-1693(00)82375-0.

