Malondialdehyd
Malondialdehyd (MDA), nach IUPAC Propandial, ist ein hochreaktiver Dialdehyd. Er entsteht biochemisch als Abbauprodukt mehrfach ungesättigter Fettsäuren und ist ein wichtiger Biomarker für oxidativen Stress.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
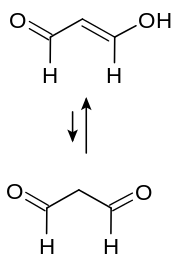 | ||||||||||||||||
| Tautomere Grenzstrukturen von Malondialdehyd | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Malondialdehyd | |||||||||||||||
| Andere Namen |
Propandial | |||||||||||||||
| Summenformel | C3H4O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 72,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Reiner Malondialdehyd ist instabil. Im Handel ist er meist als eine verdünnte wässrige Lösung des Natriumsalzes des Enols erhältlich.[1] Im Labor kann Malondialdehyd durch Hydrolyse von 1,1,3,3-Tetramethoxypropan in situ erzeugt werden. Von den beiden möglichen Enol-Isomeren ist im Wässrigen das Trans-Isomer und in organischen Lösungsmitteln das Cis-Isomer bevorzugt.[3]
Biologische und biochemische Bedeutung
Malondialdehyd ist ein wichtiges Abbauprodukt bei der Lipidperoxidation von mehrfach ungesättigten Fettsäuren.[4] Er dient als Biomarker für den oxidativen Stress. Dazu wird die zu untersuchende Lösung, beispielsweise Blutplasma, mit Thiobarbitursäure versetzt. Ein Molekül Malondialdehyd reagiert dabei mit zwei Molekülen Thiobarbitursäure zu einem rosafarbenen Farbstoff, der ein Absorptionsmaximum bei 532 nm hat und photometrisch oder mit Hilfe der Hochleistungsflüssigkeitschromatographie (HPLC) bestimmt werden kann.[5]
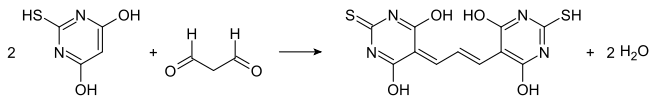
Ein anderes Reagenz für die quantitative Bestimmung von Malondialdehyd ist eine salzsaure alkoholische Lösung von 2-Methylindol. Der dabei in der Reaktion mit MDA gebildete rote Farbstoff hat ein Absorptionsmaximum bei 555 nm.[6]
Darüber hinaus ist der hochreaktive Malondialdehyd, welcher mit der DNA[7] und Proteinen reagieren kann, potenziell mutagen, atherogen[8] und kanzerogen.[9] Durch seine Bifunktionalität kann er beispielsweise Proteine quervernetzen.[10]

- Protein-Cross-Link durch Addition von Malondialdehyd an Protein-Aminogruppen (PNH2).[11]
Bei Patienten mit Diabetes mellitus sind die MDA-Spiegel im Plasma signifikant erhöht.[12]
Weiterführende Literatur
- J. Lykkesfeldt: Malondialdehyde as biomarker of oxidative damage to lipids caused by smoking. In: Clinica Chimica Acta Band 380, Nummer 1–2, Mai 2007, S. 50–58, doi:10.1016/j.cca.2007.01.028. PMID 17336279.
- K. Uchida: Lipofuscin-like fluorophores originated from malondialdehyde. In: Free Radical Research Band 40, Nummer 12, Dezember 2006, S. 1335–1338, doi:10.1080/10715760600902302. PMID 17090422.
- D. E. Shuker, W. Atkin, S. A. Bingham, C. Leuratti, R. Singh: Malondialdehyde-DNA adducts in relation to diet and disease risk–a brief overview of recent results. In: IARC scientific publications Band 156, 2002, S. 475–480, PMID 12484237.
- M. Dib, C. Garrel, A. Favier, V. Robin, C. Desnuelle: Can malondialdehyde be used as a biological marker of progression in neurodegenerative disease? In: Journal of Neurology Band 249, Nummer 4, April 2002, S. 367–374, doi:10.1007/s004150200025. PMID 11967639.
- M. E. Haberland, D. Fong, L. Cheng: Malondialdehyde, modified lipoproteins, and atherosclerosis. In: European Heart Journal Band 11 Suppl E, August 1990, S. 100–104, PMID 2226517.
Einzelnachweise
- Malonaldehyd. NIOSH Pocket Guide to Chemical Hazards, abgerufen am 13. Juni 2011.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- V. Nair, C. L. O'Neil, P. G. Wang: Malondialdehyde. In: Encyclopedia of Reagents for Organic Synthesis John Wiley & Sons, New York, 2008 (doi:10.1002/047084289X.rm013.pub2).
- R. Ebermann, I. Elmadfa: Lehrbuch Lebensmittelchemie und Ernährung. Verlag Springer, 2008, ISBN 3-211-48649-6, S. 99. eingeschränkte Vorschau in der Google-Buchsuche
- D. Ganten, K. Ruckpaul: Molekularmedizinische Grundlagen von para- und autokrinen Regulationsstörungen. Verlag Springer, 2006, ISBN 3-540-28781-7, S. 174. eingeschränkte Vorschau in der Google-Buchsuche
- H. Scherz, G. Stehlik, E. Bancher, K. Kaindl: 2-Methylindol als Reagens auf Malondialdehyd. In: Microchimica Acta Band 55, Nummer 5, 1967, S. 915–919. doi:10.1007/BF01216836
- L. J. Marnett: Chemistry and biology of DNA damage by malondialdehyde. In: IARC scientific publications Nummer 150, 1999, S. 17–27, PMID 10626205.
- D. Del Rio, A. J. Stewart, N. Pellegrini: A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress. In: Nutrition, metabolism, and cardiovascular diseases Band 15, Nummer 4, August 2005, S. 316–328, doi:10.1016/j.numecd.2005.05.003. PMID 16054557.
- L. J. Marnett: Lipid peroxidation-DNA damage by malondialdehyde. In: Mutation Research Band 424, Nummer 1–2, März 1999, S. 83–95, PMID 10064852.
- C. Lehmann: Tierexperimentelle Untersuchungen zur intestinalen Mikrozirkulation bei Endotoxinämie. Habilitationsschrift, Humboldt-Universität zu Berlin, 2000.
- B. S. Berlett und E. R. Stadtman: Protein oxidation in aging, disease, and oxidative stress. In: J Biol Chem 272, 1997, S. 20313–20316. PMID 9252331.
- D. A. Slatter, C. H. Bolton, A. J. Bailey: The importance of lipid-derived malondialdehyde in diabetes mellitus. In: Diabetologia Band 43, Nummer 5, Mai 2000, S. 550–557, doi:10.1007/s001250051342. PMID 10855528.