Perchlorate
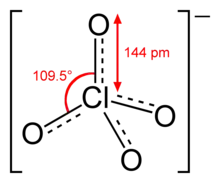
Perchlorate sind die Salze der Perchlorsäure HClO4. Das Perchlorat-Anion ClO4− ist einfach negativ geladen und hat tetraedrische Symmetrie. Chlor besitzt dabei die Oxidationszahl +7.
Natürliche Vorkommen
Perchlorate, die durch oxidative Vorgänge in der Atmosphäre gebildet werden, lagern sich mit dem Staub ab. Dieser Vorgang ähnelt der Bildung von Nitraten und Iodaten. In Gegenden mit regelmäßigen Niederschlägen gelangen die Perchlorate in den Wasserkreislauf und werden dort durch Mikroorganismen abgebaut. In ariden Wüstengebieten wie der Atacamawüste und im trockenen Südwesten der USA können sich die Perchlorate bis zu Konzentrationen von einigen mg/kg anreichern. Beim Abbau des Chilesalpeters in der Atacamawüste mussten Perchlorate vor dessen Verwendung als Dünger entfernt werden.
Perchlorate wurden 2008 auch im Staub des Mars nachgewiesen.[1]
Eigenschaften
Perchlorate sind Oxidationsmittel und geben beim Erhitzen Sauerstoff ab:
Die meisten Perchlorate sind leicht löslich. Ausnahmen bilden die nur mäßig löslichen Salze Kaliumperchlorat, Rubidiumperchlorat und Caesiumperchlorat. Kalium-, Rubidium- und Caesiumsalze können daher durch die Bildung eines weißen Niederschlages mithilfe von Perchlorat nachgewiesen werden, Beispiel:
In wässriger Lösung wirken Perchlorate kaum oxidierend, da ihre Reduktion in Lösungen ohne Katalysator sehr langsam erfolgt. Sie sind brandfördernd und werden in der Pyrotechnik, in Sprengstoffen und als Raketentreibstoff für Feststoffraketen verwendet. In der ISS werden Perchlorat-Kartuschen genutzt, um im Notfall schnell Sauerstoff produzieren zu können.
Struktur
Das Perchlorat-Ion ist perfekt tetraedrisch gebaut, die Chlor-Sauerstoff-Bindungen sind gleich lang und gleichwertig. Die Bindungsverhältnisse können völlig analog zum isoelektronischen Sulfat-Ion durch Mesomerie mit drei delokalisierten Doppelbindungen oder durch Ladungstrennung mit einem formal dreifach positiv geladenen Chloratom erklärt werden.
Herstellung
Perchlorate werden durch die Elektrolyse von Chloriden hergestellt. Das entstehende Chlor wird nicht wie bei der Chlor-Alkali-Elektrolyse abgeleitet, sondern von der sich bildenden Lauge absorbiert. Dabei entsteht Hypochlorit, das anschließend zu Chlorid und Chlorat disproportioniert. Durch weitere Elektrolyse entsteht Perchlorat.
An dotierten Diamantelektroden kann mittels Elektrolyse aus einer Chlorid-, Hypochlorit- oder Chloratlösung Perchlorat mit guter Ausbeute hergestellt werden. Die Mechanismen sind noch nicht vollständig aufgeklärt. Wahrscheinlich ist die Bildung aber auf radikalische Reaktionen (OH-, O-Radikale) zurückzuführen:[2]
Ammoniumperchlorat wird durch Neutralisation von Ammoniak mit Perchlorsäure hergestellt.
Gesundheitliche Gefahren
Perchlorate hemmen die Iod-Aufnahme im Körper (Iodination) und somit den Stoffwechsel der Schilddrüse, sind also Goitrogene. Perchlorate werden daher als Arzneistoffe zur Regulierung der Schilddrüsenfunktion eingesetzt.
Verwendung
Perchlorate dienen u. a. als Oxidationsmittel in Raketen und Feuerwerkskörpern.
Bei radiologischen Untersuchungen wird hyperthyreoten Patienten vor Gabe des iodhaltigen Kontrastmittels Perchlorat verabreicht, da dies die Iod-Aufnahme in der Schilddrüse über eine kompetitive Hemmung blockiert.[3][4]
Nachweis
Qualitativ können Perchlorate durch deren Reduktion zu Chlorid nachgewiesen werden. Hierbei wird die Probelösung angesäuert und mit Titan(IV)-sulfat versetzt. Durch Zugabe von Eisen- oder Zinkspänen wird das Ti4+-Ion zu Ti3+ reduziert. Dieses wiederum reduziert das ClO4−-Ion zu Cl−.
Das entstehende Chlorid wird üblicherweise mit Silbernitrat nachgewiesen.[5]
Vertreter
- Ammoniumperchlorat NH4ClO4
- Bariumperchlorat Ba(ClO4)2
- Kaliumperchlorat KClO4
- Lithiumperchlorat LiClO4
- Magnesiumperchlorat Mg(ClO4)2
- Silberperchlorat AgClO4
- Fluorperchlorat FClO4
- Nickel(II)-perchlorat Ni(ClO4)2
Weblinks
- Perchlorat im Grundwasser – Informationen des Bundesamts für Lebensmittelsicherheit und Veterinärwesen
Einzelnachweise
- M. H. Hecht, S. P. Kounaves, R. C. Quinn u. a.: Detection of Perchlorate and the Soluble Chemistry of Martian Soil at the Phoenix Lander Site. In: Science. Band 325, Nr. 5936, 2009, S. 64–67, doi:10.1126/science.1172466, PMID 19574385.
- H. Bergmann, J. Rollin, T. Iourtchouk: The occurrence of perchlorate during drinking water electrolysis using BDD anodes. In: Electrochim. Acta. 2009, 54, S. 2102–2107.
- A. Lasserre, L. Blohm: Kurzlehrbuch Radiologie. 3. Auflage. Urban und Fischer, München 2003, ISBN 3-437-42111-5, S. 25.
- H. Bergmann, T. Iourtchouk, J. Rollin: Perbromate – eine neue Synthese- und Nachweismöglichkeit. In: LABO. Juni 2010, S. 8–10.
- E. Schweda: Jander/Blasius: Anorganische Chemie I – Einführung & Qualitative Analyse. 17. Auflage. Hirzel, 2012, ISBN 978-3-7776-2134-0.