Carbonsäurechloride
Carbonsäurechloride sind in der Chemie die wichtigsten Verbindungen aus der Stoffgruppe der Carbonsäurehalogenide, die sich von den Carbonsäuren ableiten. Bei ihnen ist die Hydroxygruppe der Carbonsäure durch ein Chlor-Atom ersetzt, so dass eine Chlorcarbonylgruppe resultiert.[1] Je nach der Natur des organischen Restes unterscheidet man beispielsweise zwischen Alkanoylchloriden (R = Alkylrest) und Aryloylchloriden (R = Arylrest, z. B. Phenylrest).
| Carbonsäurechloride |
|---|
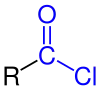 |
| Allgemeine Struktur der Carbonsäurechloride mit der blau markierten Chlorcarbonyl-Gruppe. Der Rest R stellt dabei einen aliphatischen, cyclischen oder aromatischen Rest oder auch ein Wasserstoff-Atom dar. |
Nomenklatur
Bisweilen werden die Begriffe „Carbonsäurechlorid“ und „Säurechlorid“ auch synonym verwendet.[2] Dies ist nicht ganz korrekt, weil zwar alle Carbonsäurechloride zugleich Säurechloride sind. Andererseits sind nicht alle Säurechloride auch Carbonsäurechloride, beispielsweise ist das p-Toluolsulfonsäurechlorid zwar ein Säurechlorid, aber kein Carbonsäurechlorid.
Die Benennung kann entweder als Carbonsäurechlorid, ausgehend vom Namen der Carbonsäure oder vom Acylrest erfolgen. Beispiele:
- Essigsäurechlorid oder Acetylchlorid, nicht zu verwechseln mit Chloressigsäure, ClCH2COOH
- Benzoesäurechlorid oder Benzoylchlorid, nicht zu verwechseln mit ortho-, meta- oder para-Chlorbenzoesäure
- Ameisensäurechlorid oder Formylchlorid ist eine nur hypothetisch bzw. unter hohem Druck und sehr tiefen Temperaturen existierende Substanz. Bei Normalbedingungen zerfällt es in Chlorwasserstoff und Kohlenmonoxid.
Darstellung
Carbonsäurechloride werden durch Reaktion der entsprechenden Carbonsäuren mit Thionylchlorid (SOCl2), Phosgen (COCl2), Phosphor(III)-chlorid oder Phosphor(V)-chlorid synthetisiert:[3]
Umsetzung mit Thionylchlorid (SOCl2) unter Abspaltung von Schwefeldioxid und Chlorwasserstoff:
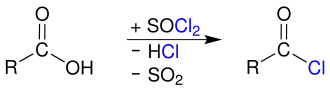 Acyl chloride synthesis1
Acyl chloride synthesis1
Die Umsetzung mit Thionylchlorid hat den Vorteil, dass alle entstehenden Stoffe, außer dem gewünschten Carbonsäurechlorid, gasförmig sind:
Umsetzung mit Phosgen (COCl2) unter Abspaltung von Kohlenstoffdioxid und Chlorwasserstoff:
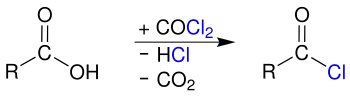 Acyl chloride synthesis2
Acyl chloride synthesis2
Umsetzung mit Phosphor(III)-chlorid unter Abspaltung von Phosphonsäure:
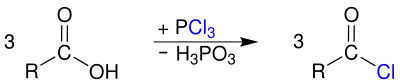 Acyl chloride synthesis3
Acyl chloride synthesis3
Umsetzung mit Phosphor(V)-chlorid unter Abspaltung von Phosphoroxychlorid und Chlorwasserstoff:
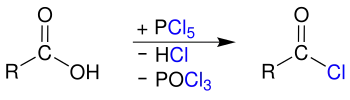 Acyl chloride synthesis4
Acyl chloride synthesis4
Die Fluor- und Bromanaloga reagieren identisch.
Eigenschaften
Die meisten niedermolekularen Carbonsäurechloride sind farblose, stechend riechende Flüssigkeiten, die an feuchter Luft wegen der Hydrolyse zu Carbonsäuren und Chlorwasserstoffsäure rauchen. Im Vergleich zur jeweiligen Carbonsäure liegen Schmelz- und Siedepunkte niedriger, da die Carbonsäurechloride keine Wasserstoffbrückenbindungen ausbilden können. Alle Carbonsäurechloride sind brennbar. Durch den −I-Effekt des Chloratoms ist das Kohlenstoffatom der Carbonylgruppe stärker positiv geladen und dadurch deutlich reaktiver als das der entsprechenden Carbonsäure.
Reaktionen
Die Carbonsäurechloride sind Carbonylverbindungen mit hoher Reaktivität. Deshalb laufen viele Reaktionen, die ausgehend von der reinen Carbonsäure nur unter besonderen Bedingungen möglich sind, wesentlich leichter mit dem entsprechenden Carbonsäurechlorid ab.
Hydrolyse
Mit Wasser reagieren niedermolekulare Carbonylchloride unter stürmischer, stark exothermer Reaktion zur jeweiligen Carbonsäure und Chlorwasserstoff. Je geringer die Wasserlöslichkeit ist, desto langsamer verläuft die Hydrolyse.
 Acyl chloride reaction1
Acyl chloride reaction1
Zum genauen Mechanismus siehe auch: Additions-Eliminierungs-Mechanismus.
Amidbildung
Durch Reaktion mit Ammoniak lassen sich die entsprechenden Carbonsäureamide herstellen:
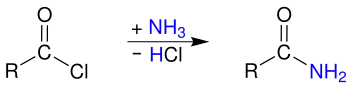 Acyl chloride reaction2
Acyl chloride reaction2
Dabei wird ebenfalls Chlorwasserstoff abgespalten.
Esterbildung
Durch Reaktion mit Alkoholen lassen sich die entsprechenden Carbonsäureester darstellen:[4][5]
 Acyl chloride reaction3
Acyl chloride reaction3
Diese Reaktion ist im Gegensatz zu derjenigen von Carbonsäuren und Alkoholen irreversibel.
Friedel-Crafts-Acylierung
Durch Reaktion mit Aromaten, hier Benzol, bilden sich durch eine Friedel-Crafts-Acylierung aromatische Ketone:[6]
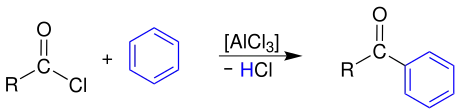 Acyl chloride reaction4
Acyl chloride reaction4
Das Carbonsäurechlorid muss zuvor mit einer Lewis-Säure, hier Aluminiumtrichlorid, aktiviert werden, wobei sich ein hochreaktives Acyl-Kation bildet, das dann den Aromaten elektrophil angreift.
Bildung von Carbonsäureanhydriden
Im Labor stellt man Carbonsäureanhydride durch Einwirkung von Carbonsäurechloriden auf Alkalisalze von Carbonsäuren, hier ein Natriumsalz, her.[2]
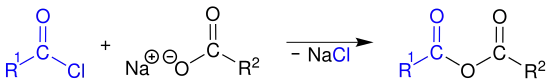 Acyl chloride reaction5
Acyl chloride reaction5
Als Nebenprodukt entsteht ein Alkalichlorid, hier Natriumchlorid.
Bildung von Ketonen
Ein Carbonsäurechlorid reagiert mit einem organischen Cuprat, hier Lithiumdimethylcuprat, zu einem Keton.[7]
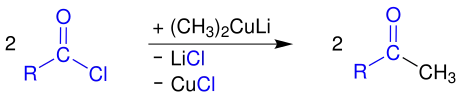 Acyl chloride reaction6
Acyl chloride reaction6
Als Nebenprodukte entstehen Lithiumchlorid und Kupfer(I)-chlorid.
Bildung von Ketenen
Ketene können durch Umsetzung eines Carbonsäurechlorids mit einem tertiären Amin (z. B. Triethylamin) dargestellt werden, wenn an dem α-Kohlenstoffatom des Säurechlorids mindestens ein Wasserstoffatom gebunden ist.
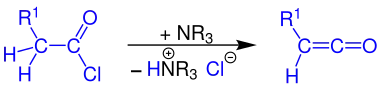 Acyl chloride reaction7
Acyl chloride reaction7
Sicherheitshinweise
Da die Carbonsäurechloride sehr leicht und unter Hitzeentwicklung hydrolysieren, müssen diese möglichst trocken gelagert werden. Entweichender Chlorwasserstoff reizt Schleimhäute, Augen und Haut. Die Reaktion mit niedrigen Alkoholen verläuft meist ähnlich stürmisch unter Bildung des Esters und der Chlorwasserstoffsäure.
Einzelnachweise
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 238–240, ISBN 3-7776-0406-2.
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 241, ISBN 3-7776-0406-2.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1236.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 319, ISBN 3-342-00280-8.
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 245, ISBN 3-7776-0406-2.
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 505, ISBN 3-7776-0406-2.
- Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter Verlag, Berlin, 4. Auflage, 2011, S. 553, ISBN 978-3-11-024894-4.