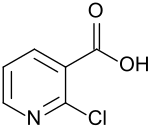
2-Chlornicotinsäure
2-Chlornicotinsäure ist ein Derivat der Pyridin-3-carbonsäure (Nicotinsäure). Das Chloratom (–Cl) – Substituent in 2-Stellung – kann durch nukleophile aromatische Substitution von anionischen oder neutralen Nukleophilen leicht verdrängt werden. 2-Chlornicotinsäure ist ein Zwischenprodukt für pharmazeutische und agrochemische Wirkstoffe, darunter der HIV-Arzneistoff Nevirapin oder das Fungizid Boscalid.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Chlornicotinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H4ClNO2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 157,55 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Der erhebliche Bedarf für 2-Chlornicotinsäure hat eine Vielzahl von Synthesevarianten hervorgebracht, die jedoch oft nur unbefriedigende Ausbeuten an Reinprodukt, unangenehm handhabbare Reaktanden und aufwendige zu behandelnde Nebenproduktströme beinhalten.
Beispielhaft ist die Route über das aus dem in größeren Mengen verfügbare Nicotinsäureamid durch Oxidation mit 30%igem Wasserstoffperoxid in 73- bis 82%iger Ausbeute einfach zugängliche Nicotinsäureamid-N-oxid,[4] das mit einem Gemisch von Phosphorpentachlorid PCl5 und Phosphoroxychlorid POCl3 in 52%iger Ausbeute[5] bzw. (realistischer) 35- bis 39%iger Ausbeute in das 2-Chlornicotinonitril überführt wird.[6] Das substituierte Pyridin-N-oxid wird bei der Reaktion mit Phosphortrichlorid (oder Thionylchlorid) zum Pyridinderivat reduziert.[7]
Dabei entsteht auch u. a. in erheblichen Mengen das schwierig zu entfernende 6-Chlornicotinamid. Bei der sauren Hydrolyse des Nitrils zur Carbonsäure wird das unerwünschte Nebenprodukt 2-Hydroxynicotinsäure gebildet. [Die in den letzten Jahren entwickelte schonende Amidhydrolyse mit Amidasen vermeidet dieses Nebenprodukt vollständig.][8] Außerdem fallen bei der Aufarbeitung größere Mengen phosphathaltiger Abwässer an.
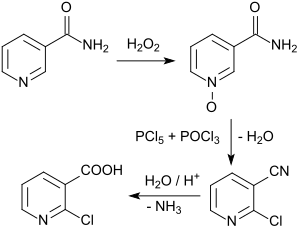
Ergiebiger ist die Route ausgehend von Nicotinsäure, das mit 80%iger Ausbeute zum N-Oxid oxidiert wird und bei der Halogenierung mit POCl3 in Gegenwart von Triethylamin nach Hydrolyse in 65%iger Ausbeute 2-CNA ergibt.[9]
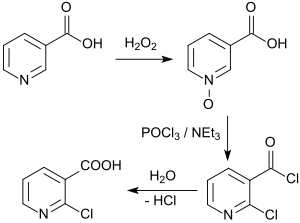
Die Patentliteratur beschreibt eine Prozessvariante[10], bei der das noch 6-Chlornicotinsäure enthaltende Produkt 2-CNA durch Umkristallisieren aus Methanol/Wasser 1:1 in reine 2-Chlornicotinsäure in einer Gesamtausbeute von 45–50 % überführt wird.
Auch die Synthese ausgehend von 3-Cyan-2-pyridon[11], das alkalisch hydrolysiert und nach Ansäuern in 2-Hydroxynicotinsäure überführt, die mit Phosphoroxychlorid zum 2-Chlornicotinsäurechlorid umgesetzt und diese anschließend zum Endprodukt 2-Chlornicotinsäure hydrolysiert wird, ist umständlich und wegen fehlender Angaben zu den Ausbeuten der Prozessstufen eher unwirtschaftlich.
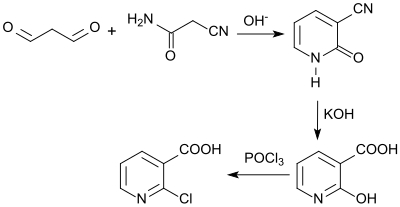
Die Nachteile der auf Pyridinvorstufen basierenden Synthesevarianten gaben Anlass zur Suche nach Alternativen, bei denen aus acyclischen Vorstufen gebildete Zwischenprodukte zu 2-Chlornicotinsäurederivaten cyclisiert werden.
Ein Ansatz ist die Verwendung von Acrolein, Cyanessigsäureethylester und 2-Dichlorcyanessigsäureethylester, die mit Kaliumcarbonat in 77%iger Ausbeute nach 72 Stunden Reaktionszeit zu einem 2-Chlor-2-cyano-5-oxo-pentansäureethylester reagieren, der mit POCl3/DMF in 65%iger Ausbeute regioselektiv zum 2-Chlornicotinsäureethylester cyclodehydratisiert wird, der noch zur 2-Chlornicotinsäure hydrolysiert werden muss.[12]
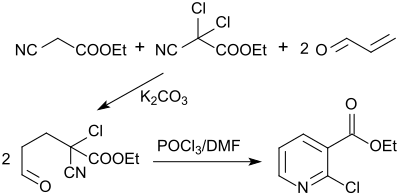
Trotz preisgünstiger Ausgangsstoffe bietet die Reaktion wegen unzumutbar langen Reaktionszeiten, dem Anfall unerwünschter Nebenprodukte und einer Gesamtausbeute unter 50 % keine wirtschaftlichen Vorteile.
Ein geeigneteres Ausgangsmaterial ist der instabile Malondialdehyd in der verkappten Form des 3-Dimethylaminoacroleins (durch Addition von Dimethylamin an Propargylalkohol)[13] oder bevorzugt aus dem Vilsmeier-Salz aus Dimethylformamid, Phosgen und Vinylisobutylether, das mit Natronlauge in 86%iger Ausbeute 3-Dimethylaminoacrolein ergibt.[14]
In einer Knoevenagel-Reaktion reagiert 3-(Dimethylamino)acrolein mit Cyanessigsäureethylester in Gegenwart von Eisessig und Piperidin unter Wasserabspaltung in 91%iger Ausbeute zu 1-Cyano-5-dimethylamino-penta-1,3-diensäureethylester (1-Cyan-4-dimethylamino-1-ethoxycarbonyl-1,3-butadien), der durch Einleiten von Chlorwasserstoff in 88%iger Ausbeute zu 2-Chlornicotinsäureethylester, der praktisch quantitativ zu 2-Chlornicotinsäure hydrolysiert werden kann.[15]
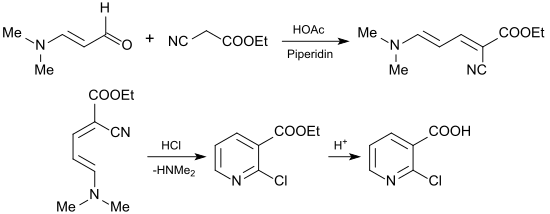
Die Reaktion kann unter leichten Ausbeuteverlusten auch als Eintopfreaktion durchgeführt werden.
Eine Verfahrensverbesserung soll der Einsatz des unpolareren Cyanessigsäure-n-butylesters statt des Ethylesters darstellen.[16] In der Eintopfvariante wird eine Ausbeute von 80 % realisiert. 2-Chlornicotinsäure wird praktisch quantitativ durch alkalische Hydrolyse des n-Butylesters erhalten.
Eigenschaften
2-Chlornicotinsäure ist ein weißes bis cremefarbenes Kristallpulver. Die Substanz ist nur wenig in Wasser, aber gut in Methanol löslich.
Anwendungen
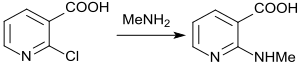
Das Chloratom in 2-Stellung wird leicht durch Nukleophile verdrängt. So reagiert 2-Chlornicotinsäure mit Aminen unterschiedlicher Konstitution in Gegenwart von Diisopropylethylamin in Wasser unter Mikrowellenbestrahlung in Ausbeuten von 47–83 % zu den entsprechenden 2-Aminonicotinsäurederivaten.[17]
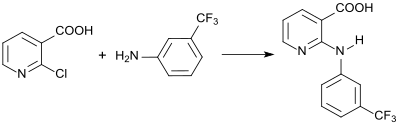
Zur Darstellung des nichtsteroidalen Antirheumatikums Nifluminsäure wird 2-Chlornicotinsäure mit 3-Trifluormethylanilin umgesetzt.[18]
Morniflumate als Prodrug der Nifluminsäure mit besserer gastrointestinaler Verträglichkeit[19] wird bei der Umsetzung des 2-Chlornicotinsäuremethylesters (über 2-Chlornicotinsäurechlorid aus 2-CNA erhalten) mit 3-Trifluormethylanilin in Gegenwart von Zinkoxid und Iod und anschließender Umesterung mit 4-(2-Hydroxyethyl)morpholin erhalten.[20]
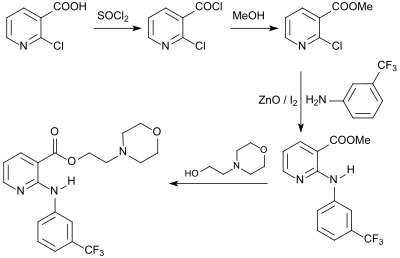
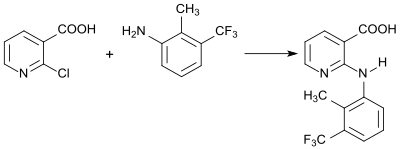
Das in der Tiermedizin als Nichtopioid-Analgetikum zugelassene Nicotinsäurederivat Flunixin wird bei der Reaktion von 2-Chlornicotinsäure mit 2-Methyl-3-trifluormethylanilin gebildet.[21]
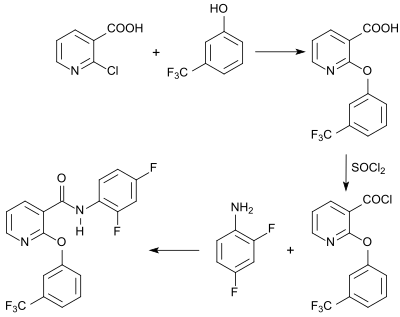
Das Herbizid Diflufenican ist durch Reaktion von 2-Chlornicotinsäure mit 3-Trifluormethylphenol zur 2-(3-Trifluormethylphenoxy)nicotinsäure, deren Umsetzung mit Thionylchlorid zum Säurechlorid und dessen Reaktion mit 2,4-Difluoranilin zugänglich.[22]
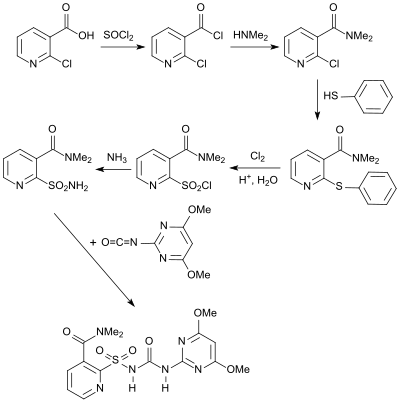
Ein weiteres von 2-Chlornicotinsäure abgeleitetes Herbizid ist Nicosulfuron, das in einer mehrstufigen Synthese über das 2-Aminosulfonyl-N,N-dimethylnicotinamid dargestellt wird.[23]
Das Virustatikum Nevirapin als der erste zugelassene Vertreter der nichtnukleosidische Reverse-Transkriptase-Inhibitoren basiert auf der Umsetzung von 2-Chlornicotinsäurechlorid mit 2-Chlor-3-amino-4-picolin, der nukleophilen Substitution des Chloratoms im Picolin-Molekülteil durch Cyclopropylamin und anschließenden Ringschluss mit Natriumhydrid.[24]
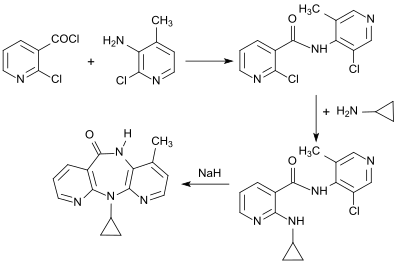
Die geringe Gesamtausbeute von 25 % veranlasste weitere Prozessverbesserungen, wie z. B. die Verwendung von 2-Chlornicotinonitril statt 2-Chlornicotinsäure.[25][26]
Das zumindest mengenmäßig wichtigste Derivat der 2-Chlornicotinsäure ist das Fungizid Boscalid, das gleichzeitig die industriell größte Anwendung der Suzuki-Kupplung bei der Reaktion von 2-Nitrochlorbenzol mit 4-Chlorphenylboronsäure in Gegenwart von Palladium(II)-acetat und Triphenylphosphan[27] (Syntheseweg A) darstellt. In der letzten Stufe wird das erhaltene 2-(4'-Chlorphenyl)anilin mit dem Säurechlorid der 2-Chlornicotinsäure zum Endprodukt umgesetzt.[28]
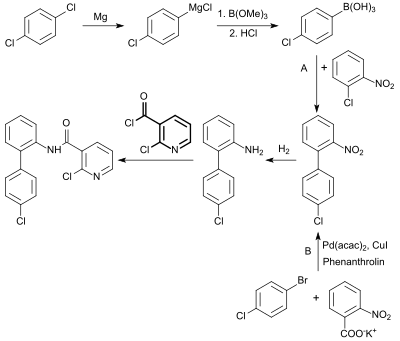
Die decarboxylierende Arylkupplung mit dem Kaliumsalz der 2-Nitrobenzoesäure und 4-Brom-chlorbenzol (Syntheseweg B) liefert ebenfalls das wichtige Zwischenprodukt 2-Nitro-4'-chlorbiphenyl.[29]
Einzelnachweise
- Datenblatt 2-Chlornicotinsäure bei AlfaAesar, abgerufen am 25. Mai 2017 (PDF) (JavaScript erforderlich).
- Datenblatt 2-Chlornicotinsäure zur Synthese (PDF) bei Merck, abgerufen am 25. Mai 2017.
- Eintrag zu 2-Chloronicotinic Acid bei TCI Europe, abgerufen am 25. Mai 2017.
- E.C. Taylor, A.J. Crovetti: Nicotinamide-1-oxide In: Organic Syntheses. 37, 1957, S. 63, doi:10.15227/orgsyn.037.0063; Coll. Vol. 4, 1963, S. 704 (PDF).
- E.C. Taylor, A.J. Crovetti: Pyridine-1-oxides. I. Synthesis of some nicotinic acid derivatives. In: J. Org. Chem. Band 19, Nr. 10, 1954, S. 1633–1640, doi:10.1021/jo01375a012.
- E.C. Taylor, A.J. Crovetti: 2-Chloronicotinonitrile In: Organic Syntheses. 37, 1957, S. 12, doi:10.15227/orgsyn.037.0012; Coll. Vol. 4, 1963, S. 166 (PDF).
- H. v. Euler, H. Hasselquist, O. Heidenberger: Zur Kenntnis der N-Oxyde. In: Chem. Ber. Band 92, Nr. 9, 1959, S. 2266–2270, doi:10.1002/cber.19590920944.
- L.-Q. Jin et al.: Efficient biocatalytic hydrolysis of 2-chloronicotinic amide for production of 2-chloronicotinic acid by recombinant amidase. In: Catal. Commun. Band 38, 2013, S. 6–9, doi:10.1016/j.catcom.2013.04.004.
- E. Kretzschmar: Über Derivate von 4-Oxo-3,4-dihydropyrido[2,3-d]pyrimidin. In: Pharmazie. Band 35, Nr. 5–6, 1980, S. 253–256.
- Patent US4144238: Process for the preparation of pure white 2-chloronicotinic acid. Angemeldet am 4. April 1977, veröffentlicht am 13. März 1979, Anmelder: Lonza, Ltd., Erfinder: A. Said.
- Patent US4081451: Process for preparing 2-halogeno nicotinic acids. Angemeldet am 4. April 1977, veröffentlicht am 28. März 1978, Anmelder: Schering Corp., Erfinder: J. Mayer.
- T.Y. Zhang, J.R. Stout, J.G. Keay, E.F.V. Scriven, J.E. Toomey, G.L. Goe: Regioselective synthesis of 2-chloro-3-pyridinecarboxylates. In: Tetrahedron. Band 51, Nr. 48, 1995, S. 13177–13184, doi:10.1016/0040-4020(95)00788-A.
- Patent DE944852: Verfahren zur Herstellung von Derivaten des 3-Amino-acroleins. Angemeldet am 7. Juni 1956, veröffentlicht am 30. November 1949, Anmelder: Badische Anilin- & Soda-Fabrik AG, Erfinder: F. Wille.
- Patent DE19825200C1: Verfahren zur Herstellung von 3-Aminoacroleinderivaten. Angemeldet am 5. Juni 1998, veröffentlicht am 18. November 1999, Anmelder: BASF AG, Erfinder: D. Grolsch, M. Keil, H. Isak.
- Patent US4987232: Preparation of 2-chloropyridine 3-carboxylic acid esters. Angemeldet am 5. Dezember 1989, veröffentlicht am 22. Januar 1991, Anmelder: Shell Internationale Research Maatschappij, B.V., Erfinder: L. Schröder.
- Patent WO2000007989A1: Verfahren zur Herstellung von 2-Halogennicotinsäurederivaten und 2-Chlornicotinsäure-n-butylester als Zwischenprodukt. Angemeldet am 14. Juli 1999, veröffentlicht am 17. Februar 2000, Anmelder: BASF AG, Erfinder: D. Grolsch, M. Keil, H. Isak, H. Mayer.
- C.E. Quevedo, V. Bavetsias, E. McDonald: Microwave-assisted synthesis of 2-aminonicotinic acids by reacting 2-chloronicotinic acid with amines. In: Tetrahedron Lett. Band 50, Nr. 21, 2009, S. 2481–2483, doi:10.1016/j.tetlet.2009.03.034.
- Patent US3415834: Derivatives of 2-anilino nicotinic acid and process for their preparation. Angemeldet am 15. Dezember 1964, veröffentlicht am 10. Dezember 1968, Anmelder: Laboratoire U.P.S.A., Erfinder: C. Hoffmann, A. Faure.
- G. Cremonesi, L. Cavalieri: Efficacy and safety of morniflumate for the treatment of symptoms associated with soft tissue inflammation. In: J. Int. Med. Res. Band 43, Nr. 3, 2015, S. 290–302, doi:10.1177/030006054567212.
- Patent EP0349902A2: Processes for the preparation of morniflumate and analogous compounds. Angemeldet am 29. Juni 1989, veröffentlicht am 10. Januar 1990, Anmelder: Chiesi Farmaceutici S.p.A., Erfinder: P. Chiesi, V. Servadio, R. Pighi.
- Patent US5484931: Process for preparing flunixin and intermediates thereof. Angemeldet am 15. Juni 1994, veröffentlicht am 16. Januar 1996, Anmelder: Schering Corp., Erfinder: H.J. Doran, D.J. Coveney.
- Patent US4618366: Certain N-(2,4-difluorophenyl)-2-(3-trifluoromethylphenoxy)-nicotinamides having herbicidal activity. Angemeldet am 15. Juni 1984, veröffentlicht am 21. Oktober 1986, Anmelder: May & Baker Ltd., Erfinder: M.C. Cramp, J. Gilmour, E.W. Parnell.
- Patent EP0232067B2: Substituted pyridinesulfonamide compounds, herbicidal composition containing them, and method of preparing these compounds. Angemeldet am 21. Januar 1987, veröffentlicht am 16. März 1994, Anmelder: Ishihara Sangkyo Kaisha Ltd., Erfinder: F. Kimura, T. Haga, N. Sakashita, C. Honda, S. Murai.
- Patent US5366972: 5,11-Dihydro-6H-dipyrido(3,2-B:2',3'-E)(1,4)diazepines and their use in the prevention or treatment of HIV infection. Angemeldet am 13. Juli 1993, veröffentlicht am 22. November 1994, Anmelder: Boehringer Ingelheim Pharmaceuticals, Inc., Erfinder: K.D. Hargraves et al..
- Patent US6680383B1: Method for making nevirapine. Angemeldet am 5. Juni 2003, veröffentlicht am 20. Januar 2004, Anmelder: Boehringer Ingelheim Chemicals, Inc., Erfinder: R.F. Boswell, B.F. Gupton, Y.S. Lo.
- Patent WO2016118586A1: Lowcost, high yield synthesis of nevirapine. Angemeldet am 20. Januar 2016, veröffentlicht am 28. Juli 2016, Anmelder: Virginia Commonwealth University, Erfinder: S. Ahmad, F. Gupton, J. Vergheses, T. McQuade.
- Patent WO199733846: Verfahren zur Herstellung von Nitrobiphenylen. Angemeldet am 6. März 1997, veröffentlicht am 18. September 1999, Anmelder: BASF AG, Erfinder: K. Eicken, J. Gebhardt, H. Rang, M. Rack, P. Schäfer.
- Patent US7241896B2: Method for producing 2-halogen-pyridine-carboxylic acid amides. Angemeldet am 31. Oktober 2002, veröffentlicht am 10. Juli 2007, Anmelder: BASF AG, Erfinder: H. Mayer, D. Golsch, H. Isak, J. Schröder.
- L.J. Gooßen, N. Rodriguez: Decarboxylative Biaryl Synthesis from Carboxylic Acids and Aryl Halides. Wissenschaftsforum Chemie Ulm 2007 (Online [PDF]).
