Cyanessigsäureethylester
Cyanessigsäureethylester ist eine chemische Verbindung, die zu den Carbonsäureestern und Nitrilen zählt und nicht in der Natur vorkommt. Die klare, farblose bis schwach gelbliche Flüssigkeit besitzt einen angenehmem Geruch und weist mit einer Ester-, einer Cyano- und einer CH-aciden Methylengruppe drei reaktive Zentren im Molekül auf.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
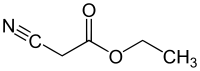 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyanessigsäureethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H7NO2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose klare Flüssigkeit mit schwach aromatischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 113,116 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,06 g·cm−3(20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
209 °C (1013 hPa)[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4175 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Cyanessigsäureethylester kann auf verschiedenen Wegen hergestellt werden:
- durch Veresterung von Cyanessigsäure mit Ethanol in Gegenwart starker Mineralsäuren (z. B. konzentrierte Schwefelsäure).
- durch Kolbe-Nitrilsynthese aus Ethylchloracetat mit Natriumcyanid.
- durch Kolbe-Nitrilsynthese aus Natriumchloracetat und Natriumcyanid, Ansäuern zur Cyanessigsäure und Veresterung mit Ethanol nach 1.[6]
- durch Umsetzung des Natriumsalzes der Cyanessigsäure mit Ethylbromid in einem wässrig-organischen Zweiphasensystem in Gegenwart eines Phasentransferkatalysators.[7]
- durch Oxidation von 3-Ethoxypropionitril mit Sauerstoff unter Druck in Gegenwart des Katalysators Cobalt(II)-acetat-tetrahydrat und eines Radikalbildners, z. B. N-Hydroxyphthalimid.[8]
Eigenschaften
Physikalische Eigenschaften
Cyanessigsäureethylester ist eine farblose Flüssigkeit, die bei Normaldruck bei 209 °C siedet.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 7,46724, B = 3693,663 und C = 16,138 im Temperaturbereich von 341 bis 479 K.[9] In fester Phase können zwei polymorphe Formen auftreten.[10] Unterhalb von −111 °C liegt die Kristallform II vor.[10] Oberhalb dieser Temperatur existiert die Kristallform I, die bei −22 °C schmilzt.[1] Die Wärmekapazität beträgt bei 25 °C 220,22 J·K−1·mol−1.[10]
 Dampfdruckfunktion von Cyanessigsäureethylester
Dampfdruckfunktion von Cyanessigsäureethylester
Chemische Eigenschaften
Mit seinen drei verschiedenen reaktiven Zentren ist Cyanessigsäureethylester ein vielseitiger Synthesebaustein für eine Vielzahl funktioneller und pharmakologisch aktiver Substanzen. In seiner Reaktivität ähnelt es dem Malonsäurediethylester, der aus Cyanessigsäureethylester durch Umsetzung mit Ethanol in Gegenwart starker Säuren erhalten wird (Gefahr der Bildung von Malonsäurediethylester bei der Veresterung von Cyanessigsäure, s.[6]). Cyanessigsäureethylester ist daher ein wichtiger Ausgangsstoff für Kondensationsreaktionen im Sinne der Knoevenagel-Kondensation und der Michael-Addition. Aufgrund seiner Reaktivität und Multifunktionalität bildet Cyanessigsäureethylester beim Erhitzen in Gegenwart von Natriumethanolat den dimeren 3-Amino-2-cyan-2-pentendisäurediethylester.[11]
Verwendung
Aufgrund seiner Funktionalität reagiert Cyanessigsäureethylester:
- an der Nitrilgruppe: Hydrierung führt zur β-Aminosäure β-Alanin.
- an der Estergruppe: Umsetzung mit Ammoniak führt zu Cyanacetamid, das durch Dehydratisierung mit PCl5 oder POCl3 zu Malonsäuredinitril umgesetzt werden kann.[12]
- an der CH-aziden Methylengruppe: z. B. Reaktion mit Formaldehyd zu 2-Cyanacrylsäureethylester, das als Sekundenkleber eingesetzt wird.
Cyanessigsäureethylester ist ein Baustein zum Aufbau von Heterocyclen, die z. B. als Arzneistoffe Verwendung finden.
Die Synthese des Allopurinols zur Behandlung der chronischen Gicht geht aus von Cyanessigsäurediethylester und Orthoameisensäureethylester, deren Kondensationsprodukt mit Hydrazin zu einem substituierten Pyrazol und anschließend mit Formamid zu Allopurinol, einem substituierten Pyrazolo-pyrimidin cyclisiert wird.[13]
Die Purinderivate Theophyllin, Coffein und Harnsäure sind aus Cyanessigsäureethylester und N,N′-Dimethylharnstoff synthetisch zugänglich.[14]
Das Pteridinderivat Folsäure ist ein dem B-Komplex zugeordnetes Vitamin und wird ausgehend von Cyanessigsäureethylester und Guanidin über eine mehrstufige konvergente Synthese erzeugt.
Das Pyrrolderivat Ethosuximid wird zur Behandlung der Epilepsie eingesetzt und aus Cyanessigsäureethylester und 2-Butanon in einer mehrstufigen Synthese erhalten.
Das Pyrimidinderivat Trimethoprim wird als Cotrimoxazol in fixer Kombination mit Sulfamethoxazol als Bakteriostatikum eingesetzt und ausgehend von Cyanessigsäureethylester und 3,4,5-Trimethoxybenzaldehyd bzw. -benzylchlorid synthetisiert.
Daneben ist eine Vielzahl anderer funktioneller Heterocyclen, wie z. B. 3-substituierte Cumarin-Derivate aus Cyanessigsäureethylester in guten Ausbeuten zugänglich.[15]
Ein weiterer wichtiger acyclischer pharmazeutischer Wirkstoff, der sich von Cyanessigsäureethylester ableitet, ist das Antikonvulsivum Valproinsäure.
Sicherheitshinweise
Cyanessigsäureethylester ist kein gefährliches Produkt im Sinne der CLP-Verordnung, seine Dämpfe bzw. Aerosole können aber Augenreizungen verursachen. Dämpfe/Aerosole sollten nicht eingeatmet werden, und die Flüssigkeit sollte nicht in die Kanalisation gelangen. Cyanessigsäureethylester ist brennbar und kann bei der Verbrennung Kohlenmonoxid, Kohlendioxid, Stickoxide und Cyanwasserstoff bilden. Beim Kontakt mit starken Basen oder Säuren, sowie starken Oxidations- und Reduktionsmitteln kann es zu heftigen Reaktionen kommen.
Literatur
- Mary Eagleson: Concise encyclopedia chemistry, Walter de Gruyter, Berlin – New York 1994, ISBN 3-11-011451-8.
- A. Kleemann, J. Engel: Pharmazeutische Wirkstoffe, 2. Auflage, Georg Thieme, Stuttgart – New York 1982, ISBN 3-13-558402-X.
- Beyer-Walter: Lehrbuch der Organischen Chemie, 24. Auflage, S. Hirzel, Stuttgart – Leipzig 2004.
Einzelnachweise
- Eintrag zu CAS-Nr. 105-56-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. März 2011. (JavaScript erforderlich)
- Datenblatt Cyanessigsäureethylester (PDF) bei Merck, abgerufen am 13. Juni 2011.
- Eintrag zu Cyan(o)essigsäureester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. März 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-240.
- Eintrag zu Ethyl cyanoacetate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 31. Juli 2018.
- J. K. H. Inglis: Ethyl Cyanoacetate In: Organic Syntheses. 8, 1928, S. 74, doi:10.15227/orgsyn.008.0074; Coll. Vol. 1, 1941, S. 254 (PDF).
- Europäische Patentanmeldung EP-A 1028105, Priorität: 9. Februar 1999, Anmelder: Lonza AG.
- Europäische Patentschrift EP 1208081, Priorität: 30. August 1999, Anmelder: Lonza AG.
- Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517-540, doi:10.1021/ie50448a022.
- Khodzhaeva, M.G.; Bugakov, Yu.V.; Ismailov, T.S.: Heat capacity and thermodynamic functions of ethyl cyanoacetate in Khim.-Farm. Zhur. 21 (1987) 760-762.
- V. A. Dorokhov et al., Russ. Chem. Bulletin, Vol. 41(2), 287–291, 1992.
- Mary Eagleson: Concise encyclopedia chemistry, Walter de Gruyter, Berlin - New York 1994, ISBN 3-11-011451-8.
- Axel Kleemann, Jürgen Engel: "Pharmazeutische Wirkstoffe", 2. Aufl., Georg Thieme, Stuttgart - New York 1982, ISBN 3-13-558402-X.
- Beyer-Walter: "Lehrbuch der Organischen Chemie", 24. Aufl., S. Hirzel, Stuttgart - Leipzig 2004.
- A. A. Avetisyan et al., Chem. Heterocycl. Compounds, Vol. 15(9), 959–960, 1980.