Phosgen
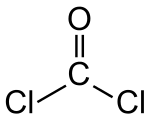
Phosgen ist der Trivialname für Kohlenoxiddichlorid oder Carbonylchlorid, COCl2, das Dichlorid der Kohlensäure. Als Diphosgen bzw. Triphosgen werden Verbindungen der Zusammensetzung C2O2Cl4 bzw. C3O3Cl6 bezeichnet, die zwar als Syntheseäquivalente des Phosgens eingesetzt werden, jedoch im engeren Sinne keine Oligomere desselben sind.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phosgen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | COCl2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,92 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
7,6 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
zersetzt sich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−219,1 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Der als Gas äußerst giftige Stoff wird in der Industrie nur in hermetisch geschlossenen Kreisläufen verwendet. In einigen Kriegen wurde er als tödlicher chemischer Kampfstoff eingesetzt. Seit langem ist er aber durch die internationale Chemiewaffenkonvention geächtet.
Geschichte
Phosgen wurde 1812 von John Davy, dem jüngeren Bruder von Sir Humphry Davy, entdeckt. Der Name Phosgen (griech.: durch Licht erzeugt; vgl. biogen, anthropogen) stammt von der von ihm durchgeführten photoinduzierten Addition von Chlorgas an Kohlenstoffmonoxid.
Der Einsatz von Phosgen als chemischer Gaskampfstoff (Grünkreuz) war für den Großteil der etwa 90.000[7] Gastoten des Ersten Weltkriegs verantwortlich.
Eigenschaften
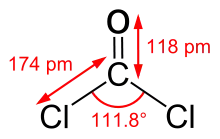
Phosgen ist ein sehr giftiges Gas, dessen Geruch als süßlich faul (faulende Bananenschale oder feuchtes Heu) beschrieben werden kann. Dieser ist sehr charakteristisch und schnell zu identifizieren.
Phosgen ist gut in organischen Lösungsmitteln löslich (beispielsweise Benzol, Toluol, Chlorbenzolen und andere), es löst sich in Wasser unter allmählicher Zersetzung zu Kohlenstoffdioxid und Salzsäure, weshalb für die Umsetzung von Phosgen in aller Regel wasserfreie organische Lösungsmittel verwendet werden.
- Hydrolyse von Phosgen zu Kohlenstoffdioxid und Chlorwasserstoff
Phosgen hat eine Verdampfungsenthalpie von 24,38 kJ·mol−1.
Toxikologie und Sicherheit
Da Phosgen schlecht wasserlöslich ist, gelangt es nach Inhalation ohne nennenswerte Zersetzung in den Bronchien bis zu den Lungenbläschen. Dort wirkt es in doppelter Weise schädigend: Aufgrund der großen Kontaktoberfläche wird ein Teil durch Wasser zersetzt, die freiwerdende Salzsäure verätzt das Gewebe der Alveolen. Weiterhin werden im Gewebe der Alveolen SH-, NH2- und OH-Gruppen von Proteinen und Enzymen in phosgentypischer Weise acyliert (Bildung von Thioester-, Amid- und Esterfunktionen). Welcher der beiden Schädigungsmechanismen vorrangig abläuft, hängt von der Phosgenkonzentration und der Inhalationsdosis (Produkt aus Konzentration und Inhalationszeit) ab. Beide Mechanismen tragen zur Ausbildung eines Lungenödems (Wasseransammlung in der Lunge im Bereich der Alveolen) bei. Abhängig ist das Ausmaß der Schädigung in erster Linie von der inhalierten Dosis[8]. Daher zeigen die zum Hinweis auf eine Phosgeninhalation von den in phosgenproduzierenden und -verarbeitenden Anlagen beschäftigten Personen in aller Regel getragenen „Phosgenindikatorplaketten“[9] nicht die Expositionskonzentration, sondern die Expositionsdosis an, um sofort eine adäquate Therapie einzusetzen. Bei niedriger Inhalationsdosis können die Betroffenen in der Regel nach einigen Stunden unter ärztlicher Beobachtung und vorsorglicher Therapie aus der ärztlichen Betreuung entlassen werden, ohne bleibenden Schaden davonzutragen. Bei höherer Inhalationsdosis (ab ca. 150 ppm · min) bildet sich in der Regel ein Lungenödem, dessen Ausmaß wiederum von der Dosis abhängt[10]. Die Atmung ist dann stark behindert, die Aufnahme von Sauerstoff in der Lunge ins Blut geht zurück. Dies ist an der rückläufigen Sauerstoffsättigung im Blut leicht zu diagnostizieren. Nach einigen Stunden, manchmal erst nach 2–3 Tagen, kann der Tod eintreten.[11]
Die Gefährlichkeit von Phosgen liegt weniger in seiner Toxizität an sich (moderne chemische Kampfstoffe wie Sarin, Tabun und Nowitschok sind ganz erheblich toxischer), sondern vielmehr in seiner Wirkungscharakteristik begründet: Auch von letalen Dosen Betroffene bleiben oft noch Stunden symptomfrei, sodass oft die medizinischen Gegenmaßnahmen zu spät kommen. Alle im industriellen Umgang mit Phosgen bekannt gewordenen Todesfälle zeigen diese Charakteristik und Problematik. Andererseits heilen Lungenödeme nach Phosgenintoxikation mittel- und langfristig folgenlos ab, nur in den ersten Wochen nach Exposition zeigen sich Einschränkungen der Lungenfunktion, die allmählich abklingen[12][13]
Bei der industriellen Produktion und Verwendung von Phosgen ereigneten sich mehrere tödliche Unfälle, der folgenschwerste in Deutschland im Jahr 1928: Am 20. Mai 1928 trat aus einem undichten Kesselwagen auf dem Gelände der Chemischen Fabrik Stoltzenberg (Hamburg) Phosgen aus. Es starben 10 Menschen, etwa 150 (nach anderen Quellen etwa 300) wurden verletzt.
Die letzten tödlichen Unfälle ereignete sich im Jahr 2010 in den USA und im Mai 2016 in Südkorea: Am 23. Januar 2010 führte auf dem Gelände der DuPont Chemical Facility in Belle, West Virginia, das plötzliche Aufreißen eines geflochtenen Stahlschlauches, der an einem Phosgen-Tank angeschlossen war, zur Freisetzung von Phosgen. Ein Mitarbeiter wurde dem toxischen Gas-Luft-Gemisch ausgesetzt und erlag den Folgen der Exposition einen Tag später.[14] Im Mai 2016 trat in einer TDI-Anlage der BASF in Südkorea Phosgen aus, ein Angehöriger einer in der Anlage tätigen Fremdfirma starb an den Folgen einer Phosgeninhalation[15].
Der letzte größere Unfall in Europa ereignete sich 2008 in München, glücklicherweise ohne Todesopfer: Am 14. März 2008 löste sich in einem Labor der Technischen Universität München in Garching aufgrund eines Defektes ein Schlauch einer Versuchsanlage und Phosgen trat aus. Zwei Personen wurden auf die Intensivstation gebracht, da sich Lungenödeme gebildet hatten, 38 weitere Personen wurden vorsorglich im Krankenhaus untersucht.[16]
Zwischen dem Unfall in Hamburg 1928 und dem Unfall 2010 bei Dupont ereigneten sich in der zweiten Hälfte des letzten Jahrhunderts weitere tödliche Unfälle, die bis auf wenige Ausnahmen (z. B. China) auch öffentlich bekannt und von den staatlichen Behörden untersucht wurden. Die Katastrophe von Bhopal 1984 wurde zunächst Phosgen zugeschrieben, was sich eindeutig als falsch erwies.
Herstellung
Phosgen wird unter katalytischem Einfluss von Aktivkohle aus Kohlenstoffmonoxid und Chlor hergestellt:
Die stark exotherme Reaktion muss mit großem Aufwand gekühlt werden, da Temperaturen im „Hotspot“ von bis zu 600 °C entstehen. Kohlenstoffmonoxid wird im Überschuss eingesetzt, um die vollständige Umsetzung des Chlors zu garantieren und somit einem Chloreisenbrand (exotherme Reaktion von Chlor und Eisen bei Temperaturen über 170 °C[17]) vorzubeugen. Restmengen von Methan, die aus der Kohlenstoffmonoxidherstellung stammen, reagieren zu Tetrachlormethan. Das Kohlenstoffmonoxid muss unbedingt frei von Wasserstoff sein, damit kein Chlorknallgas entsteht.
Phosgen kann durchaus auch bei der Verbrennung von chlorhaltigen Kunststoffen (beispielsweise PVC) in Gegenwart von Metall und Kohle und bei Verbrennung (z. B. Zulöten alter Kupferleitungen von Kälteanlagen) des seit 1. Januar 2010 verbotenen Kältemittels R22 entstehen. Im Labormaßstab kann es auch aus Tetrachlormethan und rauchender Schwefelsäure („Oleum“) hergestellt werden:
Verwendung
Phosgen wird vor allem zur großtechnischen Produktion von aromatischen Diisocyanaten wie Toluylendiisocyanat (TDI) und Methylendiphenylisocyanat (MDI) verwendet, die für die Herstellung von z. B. Schaumstoffen auf Polyurethanbasis, sowie von Polycarbonat (PC), das zur Herstellung hochwertiger Kunststoffe (z. B. compact discs) verwendet wird. Für diese Verwendung werden über 90 % des weltweit produzierten Phosgens in einer Größenordnung von über 3 Mio. Tonnen pro Jahr eingesetzt. Weitere Verwendungszwecke sind die Herstellung von „aliphatischen“ Diisocyanaten wie z. B. HDI Hexamethylendiisocyanat und IPDI Isophorondiisocyanat, die zu hochwertigen Lacken, z. B. Autolacke, weiterverarbeitet werden, sowie die Produktion von Monoisocyanaten wie z. B. Methylisocyanat, die zur Herstellung von Pflanzenschutzmitteln verwendet werden. Der Einsatz zur Herstellung von Carbonsäurechloriden und Pharmazeutika ist mengenmäßig und ökonomisch von untergeordneter Bedeutung, wie auch die Herstellung und Verwendung im Labormaßstab. Die größten Anlagen stehen in Saudi-Arabien, USA (Tx und La), Deutschland, China (um Shanghai), Japan und Südkorea. Die wichtigsten Produzenten sind DOW, Covestro (eine Bayer-Ausgliederung) und BASF.
Aufgrund seiner hohen Toxizität werden über 99 % des produzierten Phosgens in derselben Produktionsanlage hergestellt in der es auch verbraucht wird, um Transporte über firmeninterne und vor allem öffentliche Verkehrswege zu vermeiden. Auch eine Zwischenlagerung in der Produktionsanlage wird vermieden, das produzierte Phosgen wird sofort zu vergleichsweise harmlosen Folgeprodukten weiterverarbeitet. Bei der Weiterverarbeitung wird ein Phosgenüberschuss eingesetzt, die Überschussmengen werden zurückgewonnen und wieder in den Produktionsprozess recycliert. Restmengen werden durch Absorption an Aktivkohle und Hydrolyse mit Wasser vernichtet. Als Alternativen stehen im Laborbereich flüssiges Diphosgen (Trichlormethylchlorformiat) und festes Triphosgen (Bistrichlormethylcarbonat) zur Verfügung, die eine ähnliche Reaktivität zeigen, jedoch ungefährlicher in der Anwendung und einfacher zu lagern sind.
Phosgen wurde erstmals 1915 im Weltkrieg von den Franzosen als chemischer Gaskampfstoff militärisch eingesetzt[18]. Deutschland setzte es als 5%ige Beimengung zum Chlorgas am 31. Mai 1915 (bei Ypern in der Zweiten Flandernschlacht) ein. Am 22. Februar 1916 setzte Frankreich Phosgen in Reinform ein[19]. Phosgen wird der größte Anteil an allen Gasverletzten zugeschrieben. Später wurden die Kampfstoffe durch Giftgasgranaten verschossen, zumeist im Wechsel mit Giftgasgranaten mit anderen Giftstoffen („Buntschießen“).
Siehe auch
Literatur
- Beyer Hans, Walter Wolfgang: Lehrbuch der Organischen Chemie. 23. überarb. und aktualisierte Auflage. S. Hirzel Verlag, Stuttgart/Leipzig 1998, ISBN 3-7776-0808-4.
- Dominique Lapierre und Javier Moro: Fünf nach zwölf in Bhopal. Die unglaubliche Geschichte der größten Giftgaskatastrophe unserer Zeit. Europa Verlag, Wien 2004 (französische Originalausgabe 2001), ISBN 3-203-79508-6.
- Wolfgang Schneider, Werner Diller: Phosgene. In: Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, Wiley-VCH.
- K. L. Dunlap : Phosgene. In: Kirk Othmer Encyclopedia of Chemical Technology. 5th edition, vol. 18, John Wiley & Sons, Hoboken, NJ 2006, S. 802–814,
Weblinks
Einzelnachweise
- Eintrag zu Phosgen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- Eintrag zu Phosgen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Phosgene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-44-5 bzw. Phosgen), abgerufen am 2. November 2015.
- Eintrag zu PHOSGENE in der Hazardous Substances Data Bank, abgerufen am 27. Juli 2012 (online auf PubChem).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Die Atomwaffe des kleinen Mannes. In: Der Spiegel. Nr. 39, 1998 (online – 26. September 1998).
- Werner F. Diller: Early Diagnosis of Phosgene Overexposure. In: Toxicology and Industrial Health. Band 1, Nr. 2, April 1985, ISSN 0748-2337, S. 73–80, doi:10.1177/074823378500100208.
- W.F. Diller, E.Drope, E. Reichold: Ber. Int. Kolloq. Verhütung Arbeitsunfällen Berufskrankh. Chem. Ind. 6 th ( 1979 ) ; Chem. Abstr. 92 (1980 )168366x.
- W. F. Diller, R. Zante,: Zentralbl. Arbeitsmed. Arbeitsschutz Prophyl. Ergon. 32 ( 1982 ) 60–368.
- Jonathan Borak, Werner F. Diller: Phosgene Exposure: Mechanisms of Injury and Treatment Strategies. In: Journal of Occupational and Environmental Medicine. Band 43, Nr. 2, Februar 2001, ISSN 1076-2752, S. 110–119, doi:10.1097/00043764-200102000-00008.
- W. F. Diller, F. Schnellbächer, F. Wüstefeld,: Zentralbl. Arbeitsmed. Arbeitsschutz Prophyl. Band 29, 1979, S. 5–16.
- James J. Collins, Donald M. Molenaar, Larry O. Bowler, Tom J. Harbourt, Michael Carson: Results From the US Industry-Wide Phosgene Surveillance. „The Diller Registry“. In: Journal of Occupational and Environmental Medicine. Band 53, Nr. 3, März 2011, ISSN 1076-2752, S. 239–244, doi:10.1097/jom.0b013e31820c90cf.
- DuPont Corporation Toxic Chemical Releases | CSB. Abgerufen am 30. August 2018 (englisch).
- Ludwigshafener BASF muss in Südkorea nach tödlichem Phosgen-Unfall Geldbuße zahlen - Pfalz. In: DIE RHEINPFALZ. 11. Februar 2017, abgerufen am 26. Februar 2021.
- Universität München: Polizei ermittelt nach Giftgasunfall, Spiegel Online, Meldung vom 16. März 2008.
- Eintrag zu Chlor in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. November 2017. (JavaScript erforderlich)
- Nye, Mary Jo: Before big science: the pursuit of modern chemistry and physics, 1800–1940. Hrsg.: Harvard University Press. 1999, ISBN 0-674-06382-1, S. 193.
- Erster Weltkrieg: „Gelbkreuz“ sollte die ultimative Waffe werden. In: Welt Online. Abgerufen am 14. Juli 2017.


