2,2,2-Trifluorethanol
2,2,2-Trifluorethanol (Trifluorethanol, TFE) ist eine fluororganische Verbindung mit der Konstitutionsformel CF3-CH2OH. Die hohe Elektronegativität der Trifluormethylgruppe ist verantwortlich für den im Vergleich zu Ethanol stärker ausgeprägten Säurecharakter von Trifluorethanol, das sich in vielen Reaktionen phenolartig verhält. Das elektrische Dipolmoment (2,03 Debye),[5] der hohe Wert des Polaritätsparameters ET(30) von 250,2 kJ·mol−1[5] und die ausgeprägte Neigung zur Ausbildung von Wasserstoffbrücken machen TFE zu einem ausgezeichneten protischen Lösungsmittel für polare Verbindungen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2,2,2-Trifluorethanol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H3F3O | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 100,04 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
12,4[4] | |||||||||||||||||||||
| Löslichkeit |
löslich in Wasser, löslich in Alkoholen, Ketonen, Estern, Ethern, mischbar mit niedrigen aliphatischen und aromatischen Kohlenwasserstoffen, mit Chloroform und 1,1,1-Trichlorethan[5] | |||||||||||||||||||||
| Brechungsindex | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Treibhauspotential |
24 (bezogen auf 100 Jahre)[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Darstellung
2,2,2-Trifluorethanol kann verhältnismäßig aufwendig durch katalytische Hydrierung von Trifluoressigsäure,[8][9] und deren Derivaten, wie z. B. Trifluoracetylchlorid,[10] oder 2,2,2-Trifluorethyltrifluoracetat,[11] erhalten werden.
Von industriellem Interesse ist die Route ausgehend von 2-Chlor-1,1,1-trifluorethan, einem Zwischenprodukt der Halothan-Synthese. Der Prozess kann entweder diskontinuierlich und zweistufig über die Bildung eines TFE-Esters[12]
oder kontinuierlich und einstufig in Gegenwart von Wasser[13] zum 2,2,2-Trifluorethanol geführt werden.

Bei dem kontinuierlichen Verfahren in einem Schlaufenreaktor wird 2-Chlor-1,1,1-trifluorethan (durch Anlagerung von Fluorwasserstoff an Trichlorethen in der Gasphase) mit wässriger Kaliumacetat-Lösung unter Druck bei Temperaturen über 250 °C und Verweilzeiten von ca. einer Stunde bei 77-prozentigem Umsatz mit einer Ausbeute von bis zu 95 % zu TFE hydrolysiert.
In einer Prozessvariante wird 2-Chlor-1,1,1-trifluorethan mit dem Kaliumsalz der γ-Hydroxybuttersäure (aus γ-Butyrolacton und Kalilauge) in γ-Butyrolacton als Lösungsmittel unter Bildung von Kaliumchlorid und γ-Butyrolacton zur Reaktion gebracht.[14]

Der Prozess soll sich durch extreme Produktreinheit, milde Reaktionsbedingungen und fehlenden Produktionsabfall (das KCl kann als Dünger verwendet werden) auszeichnen.[15]
Eigenschaften
2,2,2-Trifluorethanol ist eine klare, farblose Flüssigkeit von ethanolartigem Geruch, die mit Wasser und vielen polaren Lösungsmitteln in jedem Verhältnis mischbar ist. Seine Dichte ist höher als die von Dichlormethan. Trifluorethanol ist bis 315 °C thermisch stabil[16] und spaltet oberhalb der Zersetzungstemperatur Fluorwasserstoff ab. Mit seinem Flammpunkt von 33 °C[2] ist TFE als brennbare Flüssigkeit klassifiziert, nicht leicht bioabbaubar[3] und kann schwere Augen- und Fertilitätsschäden verursachen.
Verwendung
TFE eignet sich als ausgezeichnetes Lösungsmittel für eine Vielzahl organischer Verbindungen, aufgrund seines niedrigen Treibhauspotentials als Reinigungsflüssigkeit,[9] z. B. für elektronische Bauteile als Ersatz für Fluorchlorkohlenwasserstoffe,[14] als Eluent in der HPLC, sowie als Arbeitsmedium im so genannten Organic Rankine Cycle zur Rückgewinnung von Abwärme.[17][5][14]
Wegen seiner hohen Ionisierungsenergie und niedrigen spezifischen Leitfähigkeit wird TFE als Lösungsmittel für ionische Reaktionen und konduktometrische Titrationen verwendet.[16]
Bemerkenswert ist das außerordentlich hohe Lösevermögen von TFE für polare Polymere, wie z. B. Polyamide (Nylon), Polymethylmethacrylat, Polyvinylacetat, Polyacrylnitril und Celluloseacetat,[5] wobei Nylonkonzentrationen bis 10 % erreicht und die TFE-Lösungen zur Bestimmung der Molmassenverteilung eingesetzt werden können.[18] Die gute Löslichkeit von Polyamiden in TFE kann auch zum Zusammenfügen fester Nylonoberflächen oder zur Herstellung von nylonverstärkten Klebstoffen genutzt werden.[5]
Wie Polyamide löst TFE auch Peptide und Proteine, häufig unter Denaturierung.[19]
TFE eignet sich ebenfalls als Lösungsmittel für Polymerisationen, die z. B. durch Palladium- oder Ruthenium-Komplexe katalysiert werden.[20][21]
Aus 2,2,2-Trifluorethanol ist 2,2,2-Trifluoracetaldehyd durch elektrochemische Oxidation[22] als Trifluorethyl-Halbacetal oder durch Gasphasenoxidation[23] in Gegenwart von Wasser an Vanadin-Molybdän-Mischkontakten bei 260 °C als Acetal zugänglich.
2,2,2-Trifluorethanol liefert die Molekülbausteine CF3CH2 (Trifluorethylgruppe) und CF3CH2O (Trifluorethoxygruppe) für chemische Synthesen, z. B. können die Halogenatome in dihalogensubstituierten Benzoesäuren in einer Art Ullmann-Reaktion durch Trifluorethoxyreste substituiert werden.[24]
benzoes%C3%A4ure_%C3%BCber_2%252C2%252C2-Trifluorethanol.svg.png.webp)
Die entstehende 2,5-Bis(2,2,2-trifluorethoxy)benzoesäure ist ein Baustein für das Antiarrhythmikum Flecainid.
Der Protonenpumpenhemmer Lansoprazol enthält eine Trifluorethoxygruppe im Pyridin-Molekülteil, die z. B. durch Ersatz einer Nitrogruppe im Zwischenprodukt 2-Cyano-3-methyl-4-nitropyridin entsteht.[25]

Auch das Herbizid Triflusulfuron-methyl enthält eine über TFE eingeführte Trifluorethoxygruppe.
Beim polymeranalogen Austausch der Chloratome im Polydichlorphosphazen durch TFE (als Natriumsalz) entsteht Poly[bis(trifluorethoxy)phosphazen],[26] ein Standard-Polyphosphazen, das als hydrophobes Elastomer Folien, Fasern und Membranen bildet.
phosphazen-Synthese.svg.png.webp)
Die Ester von 2,2,2-Trifluorethanol mit Acrylsäure oder Methacrylsäure stellen Monomere dar, die mit einer Vielzahl anderer Monomere copolymerisiert werden können und die erhaltenen Copolymeren wasserabweisend, sauerstoffdurchlässig und hochtransparent werden lassen. Diese Eigenschaften macht man sich bei der Herstellung weicher Kontaktlinsen zunutze.[27]
Die wichtigste Anwendung für 2,2,2-Trifluorethanol ist die Herstellung des Inhalationsnarkotikums Isofluran und seines Derivats Desfluran.[28]
In einer neueren Verfahrensvariante wird Isofluran in zwei Stufen unter Verwendung des als Kältemittel weitgehend verbotenen Chlordifluormethans (Freon 22, R22) erhalten.[29]
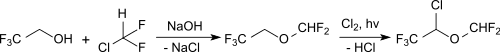
Desfluran entsteht durch Austausch des Chloratoms durch Fluor mit Fluorwasserstoff in Gegenwart von Antimonpentafluorid auf Aktivkohle bei 135 °C.[30]

Einzelnachweise
- Datenblatt 2,2,2-Trifluorethanol bei Sigma-Aldrich, abgerufen am 7. Juli 2019 (PDF).
- Datenblatt 2,2,2-Trifluorethanol zur Synthese (PDF) bei Merck, abgerufen am 15. Dezember 2015.
- Rhodia: 2,2,2-trifluoroethanol (Memento vom 24. September 2015 im Internet Archive), GPS Safety Summary
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 978-1-4398-8049-4 (books.google.de).
- Halocarbon: Trifluoroethanol CAS No. 75-89-8
- Eintrag zu 2,2,2-Trifluorethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- Patent US4396784: Hydrogenation of fluoroacids with rhenium-fluorided alumina catalyst. Angemeldet am 4. März 1982, veröffentlicht am 2. August 1983, Anmelder: Phillips Petroleum Co., Erfinder: M.M. Johnson, G.P. Nowack, P.S. Hudson, B.H. Ashe, Jr..
- D. Lee, S.I. Cho, G.-J. Kim, H. Kim, I.-M. Lee: Efficient and selective hydrogenation of carboxylic acids catalyzed by Ni or Pd on ZSM-5. In: Journal of Industrial and Engineering Chemistry. Band 13, Nr. 7, 2007, S. 1067–1075 (online (Memento vom 25. September 2015 im Internet Archive) [PDF]).
- Patent US3970710: Process for making trifluoroethanol. Angemeldet am 9. April 1975, veröffentlicht am 20. Juli 1976, Anmelder: Abbott Laboratories, Erfinder: S. Wolownik.
- Patent US3356746: Preparation of 2,2,2-trifluoroethanol by catalytic hydrogenation. Angemeldet am 30. September 1964, veröffentlicht am 5. Dezember 1967, Anmelder: Allied Chemical Corp., Erfinder: L.G. Anello, W.J. Cunningham.
- Patent US4434297: Process for the preparation of trifluoroethanol. Angemeldet am 30. August 1982, veröffentlicht am 28. Februar 1984, Anmelder: Halocarbon Products Corp., Erfinder: G.W. Astrologes.
- Patent EP0171248: Process for the preparation of 2,2,2-trifluoroethanol. Angemeldet am 29. Juli 1985, veröffentlicht am 16. Oktober 1991, Anmelder: Anaquest, Inc., Erfinder: P.W. Townsend, G.G. Vernice, C. Huang.
- Tosoh F-Tech, Inc.: 2,2,2-Trifluoroethanol (TFEA), Its production process and various applications
- Patent EP1426351: Process for preparation of 2,2,2-trifluoroethanol. Angemeldet am 13. September 2002, veröffentlicht am 9. Juni 2004, Anmelder: Tosoh F-Tech, Inc., Erfinder: N. Nagasaki, T. Kawamura, K. Nukui, S. Arai.
- Solvay Fluor und Derivate: 2,2,2-Trifluoroethanol (TFE)
- Patent US4232525: Working fluid for the Rankine Cycle. Angemeldet am 23. Januar 1979, veröffentlicht am 11. November 1980, Anmelder: Daikin Kogyo Co. Ltd., Erfinder: N. Enjo, H. Aomi.
- P.J. Wang, R.J. Rivard: Characterization of nylons by gel permeation chromatography and low angle laser light scattering in 2,2,2-trifluoroethanol. In: J. Liq. Chromatogr. Band 10, Nr. 14, 1987, S. 3059–3071, doi:10.1080/01483918708068297.
- A. Kundu, N. Kishore: Interaction of 2,2,2-trifluoroethanol with proteins: calorimetric, densimetric and surface tension approach. In: Biophys. Chem. Band 109, Nr. 3, 2004, S. 427–442, doi:10.1016/j.bpc.2003.12.009.
- A. Scarel et al.: Trifluoroethanol: key solvent for palladium-catalyzed polymerization reactions. In: Journal of Organometallic Chemistry. Band 690, 2005, S. 2106–2120, doi:10.1016/j.jorganchem.2005.01.004.
- D.A. Rankin, S.J. P’Pool, H.-J. Schanz, A.B. Lowe: The controlled homogeneous organic solution polymerization of new hydrophilic cationic exo-7-oxanorbornenes via ROMP with RuCl2(PCy3)2CHPh in a novel 2,2,2-trifluoroethanol/methylenechloride solvent mixture. In: Journal of Polymer Science A: Polymer Chemistry. Band 45, Nr. 11, 2007, S. 2113–2128, doi:10.1002/pola.21976.
- K. Shirai, O. Onomura, T. Maki, Y. Matsumura: Electrochemical oxidation of 2,2,2-trifluoroethanol to trifluoroacetaldehyde 2,2,2-trifluoroethyl hemiacetal. In: Tetrahedron Letters. Band 41, Nr. 31, 2000, S. 5873–5876, doi:10.1016/S0040-4039(00)00880-7.
- Patent EP1832343: Catalyst for oxidizing 2,2,2-trifluoroethanol and method for producing trifluoroacetaldehyde. Angemeldet am 29. November 2005, veröffentlicht am 12. September 2007, Anmelder: Tosoh F-Tech, Inc., Erfinder: H. Mimura, A. Watanabe, N. Nagasaki, K. Kawada.
- Patent WO0190062: Method for production of trifluoroethoxy-substituted benzoic acid. Angemeldet am 23. Mai 2001, veröffentlicht am 29. November 2001, Anmelder: Merck Patent GmbH, Erfinder: K. Fabian, S. Enke, H. Tilly.
- K.-H. Ahn et al.: A new synthesis process of Lanzoprazole. In: B. Korean Chem. Soc. Band 23, Nr. 4, 2002, S. 626–628.
- H.R. Allcock, R.L. Kugel, K.J. Valan: Phosphonitrilic Compounds. VI. High Molecular Weight Poly(alkoxy- and aryloxyphosphazenes). In: Inorganic Chemistry. Band 5, Nr. 10, 1966, S. 1709–1715, doi:10.1021/ic50044a016.
- B. D. Ratner, A. S. Hoffman, F. J. Schoen, J. E. Lemons (Hrsg.): Biomaterials Science: An Introduction to Materials in Medicine. 3. Auflage. Academic Press, 2013, ISBN 978-0-12-374626-9, S. 912.
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Syntheses, Patents and Applications of the most relevant APIs, 5th Edition. Thieme, 2009, ISBN 978-3-13-179275-4.
- Patent US3637477: Method of preparing of CF3CH=CHF2. Angemeldet am 20. Februar 1970, veröffentlicht am 25. Januar 1972, Anmelder: Air Reduction Co., Inc., Erfinder: L.S. Croix.
- H. Sivaramakrishnan, A.A. Upare, D. Satagopan, O.R. Chambers: The Preparation of Desflurane by the Vapor-Phase Fluorination of Isoflurane. In: Organic Process Research & Development. Band 15, Nr. 3, 2011, S. 585–592, doi:10.1021/op100318b.



