Isofluran
Isofluran ist ein volatiles Anästhetikum aus der Gruppe der Flurane. Es ist ein Strukturisomer des Enfluran und wird in Deutschland seit 1984 für Narkosen verwendet. Isofluran hat eine gute hypnotische und muskelrelaxierende Wirkung, wirkt jedoch nur schwach analgetisch. Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation. Verabreicht wird Isofluran über einen Verdampfer wie den von der Lübecker Firma Dräger hergestellten Vapor 19.1.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
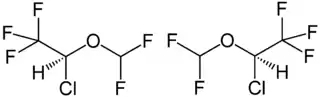 | ||||||||||||||||||||||
| 1:1-Gemisch aus (S)-Isofluran (links) und (R)-Isofluran (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Isofluran | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H2ClF5O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, etherisch riechende Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N01AB06 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 184,49 g·mol−1 | |||||||||||||||||||||
| Dichte |
1,45 g·cm−3 [1] | |||||||||||||||||||||
| Siedepunkt |
48,5 °C [1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
nicht oder schwer mischbar mit Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Treibhauspotential |
510[3] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologie
Die Metabolisierungsrate von Isofluran ist sehr niedrig (0,2 %), weshalb das Narkotikum auch bei Patienten mit Leberschädigung eingesetzt werden kann. Der Blut-Gas-Verteilungskoeffizient von Isofluran ist 1,46, bei einer Konzentration von 1 Vol.-% in den Lungenbläschen beträgt die Konzentration im Blut also 1,46 Vol.-%.
Chemie
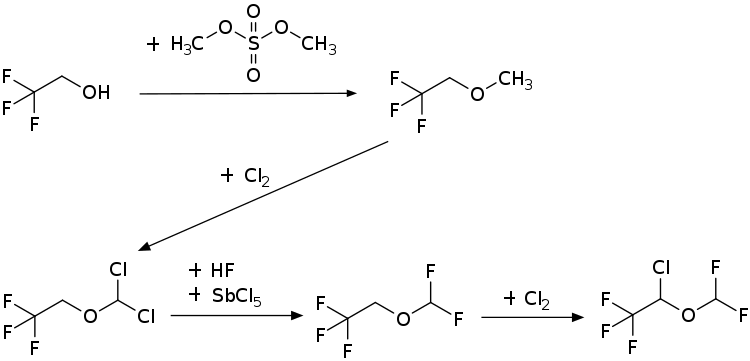
Isofluran ist chiral, es wird als Racemat [1:1-Gemisch aus (S)-Isofluran und (R)-Isofluran] eingesetzt. Es handelt sich um eine farblose Flüssigkeit, die bei Normaldruck bei 49,3 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend ln(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 14.09217, B = 2539.154 und C = −54,400 im Temperaturbereich von 280,05 bis 343,97 K.[4] Die molare Verdampfungsenthalpie beträgt 31,9 kJ·mol−1.[5] Die kritische Temperatur liegt bei 194,6 °C, der kritische Druck bei 30,46 bar.[4] Die Synthese von Isofluran erfolgt in einer vierstufigen Synthese. Ausgehend von 2,2,2-Trifluorethanol und Dimethylsulfat wird im ersten Schritt der 2,2,2-Trifluorethylmethylether erhalten. Dieser wird in einem Chlorierungsschritt mit Chlor zum 2,2,2-Trifluorethyldichlormethylether umgesetzt. Ein Halogenaustausch mittels Fluorwasserstoff in Gegenwart von Antimonpentachlorid ergibt im dritten Schritt 2,2,2-Trifluorethyldifluormethylether. Die Zielverbindung wird dann in einer zweiten Chlorierungsreaktion erhalten. Aus der Synthesesequenz resultiert das Racemat.[6]
Nebenwirkungen
Isofluran bewirkt eine Gefäßerweiterung (Vasodilatation) und führt dosisabhängig zum Abfall des arteriellen Blutdrucks und zum Anstieg der Herzfrequenz. Es vermindert die Durchblutung des Herzens und dosisabhängig[7] das Herzminutenvolumen. Auch die Durchblutung der Nieren wird verringert, die glomeruläre Filtrationsrate und die Urinproduktion werden herabgesetzt. Außerdem verringert der Wirkstoff die Atmungsaktivität, wirkt also atemdepressiv, unterscheidet sich aber hinsichtlich seines Einflusses auf die Atemmechanik[8] nicht von Halothan oder Enfluran. Isofluran ist schleimhautreizend und eignet sich damit nur bedingt zur Narkoseeinleitung.
Umwelt
Die Lebenszeit in der Atmosphäre beträgt 3,2 Jahre, das Treibhauspotential 510 und die Emissionen liegen bei (geschätzt) 880 Tonnen weltweit pro Jahr.[3]
Handelsnamen
Monopräparate: Forane (A), Forene (D, CH), diverse Generika (D, A, CH)
Literatur
- Michaele Alef, Gerhard Oechtering: Praxis der Inhalationsanästhesie. Enke-Verlag, Stuttgart 2003, ISBN 3-8304-1015-8.
Einzelnachweise
- Eintrag zu Isofluran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Januar 2020. (JavaScript erforderlich)
- Datenblatt Isofluran bei AlfaAesar, abgerufen am 17. März 2010 (PDF) (JavaScript erforderlich).
- Martin K. Vollmer, Tae Siek Rhee, Matt Rigby, Doris Hofstetter, Matthias Hill, Fabian Schoenenberger, Stefan Reimann: Modern inhalation anesthetics: Potent greenhouse gases in the global atmosphere. In: Geophysical Research Letters. Band 42, Nr. 5, 16. März 2015, S. 1606–1611, doi:10.1002/2014GL062785.
- Ambrose, D.; Ghiassee, N.B.: Vapour pressures, critical temperatures, and critical pressures of 2-chloro-1,1,2-trifluoroethyl difluoromethyl ether (enflurane) and of 1-chloro-2,2,2-trifluoroethyl difluoromethyl ether (isoflurane) in J. Chem. Thermodyn. 20 (1988) 765–766.
- R. M. Stephenson, S. Malanowski: Handbook of the Thermodynamics of Organic Compounds. Springer 1987, ISBN 94-010-7923-4, doi:10.1007/978-94-009-3173-2.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. Syntheses, Patents, Applications. 2 Bände. 4. Auflage. Thieme, Stuttgart u. a. 2001, ISBN 1-58890-031-2; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/ Heidelberg/ New York u. a. 1999, ISBN 3-540-65024-5, S. 8–10.
- Th. Pasch u. a.: Der Einfluß von Isofluran auf die Atemmechanik. In: Anästhesie Intensivtherapie Notfallmedizin. Band 21, Heft 1, 1986, S. 1–4.