Konduktometrie
Konduktometrie oder Leitfähigkeitsmessung ist eine chemisch-physikalische Analysemethode, die die elektrolytische Leitfähigkeit einer flüssigen Probe zur Bestimmung ihrer dissoziierten Inhaltsstoffe und deren Konzentration ausnutzt.

Verfahren
Im Wesentlichen wird zwischen zwei verschiedenen Verfahren der Konduktometrie unterschieden.
- Beim Bestimmungsverfahren wird die Leitfähigkeit gemessen und die Konzentration anhand von Kalibrationskurven bestimmt.
- Beim Indikationsverfahren wird die Leitfähigkeitsänderung während einer Titration gemessen, und die Konduktometrie dient der Bestimmung des Endpunkts der Titration. Diese Art der Konduktometrie ist wichtig für viele Fälle der analytischen Praxis. Solche Leitfähigkeitstitrationen können Säure-Base-Titrationen oder auch Fällungstitrationen sein. Große Vorteile der Konduktometrie sind die Einfachheit des Verfahrens und die Möglichkeit von exakten konduktometrischen Titrationen auch mit sehr verdünnten Lösungen (10−4 molar). Ferner werden keine chemischen Indikatoren benötigt.
Leitfähigkeitsmessung
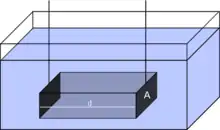
Die Leitfähigkeitsmessung basiert auf der Bestimmung des ohmschen Widerstands der Analysenlösung bzw. dessen Kehrwerts, des elektrischen Leitwerts (in Siemens S = Ω−1). Sie verwendet Wechselstrom. Dabei tauchen in die zu messende Lösung zwei inerte Elektroden ein in zueinander paralleler oder in koaxialer Anordnung. Die Widerstandsmessung verwendet eine Wien-Brücke bzw. eine in modernen Geräten enthaltene komplexe elektronische Schaltung. Der Widerstand einer Lösung wird geringer, wenn die Elektrodenfläche des Messgerätes zunimmt oder der Abstand zwischen den Elektroden abnimmt. Justierte Geräte sind bereits auf Standardflächen und Abstände eingestellt. Mit manchen Geräten kann man direkt die elektrische Leitfähigkeit einer Lösung ablesen; sonst erhält man die Leitfähigkeit der Lösung aus der Multiplikation des Leitwertes mit der Zellenkonstanten.
Die elektrolytische Leitfähigkeit ist eine geräteunabhängige, nur für die Lösung spezifische Größe, sie wird von der Wertigkeit, Beweglichkeit und Teilchendichte der Ionen in wässrigen Lösungen beeinflusst.
Messgeräte
Meist werden zur Messung spezielle Leitfähigkeitsmessgeräte verwendet, die auch Konduktometer genannt werden. Typischerweise sind diese mit einem Thermometer versehen und die Messfrequenz ist einstellbar oder zumindest umschaltbar. Die Messgröße wird oft in S/cm (Siemens pro Zentimeter) angegeben (Beispiel: hoch reines Wasser 0,05 bis 0,1 µS/cm, Leitungswasser 0,3 bis 1 mS/cm, Meerwasser etwa 50 mS/cm). Der elektrische Aufbau der Messgeräte gleicht dem der wheatstonschen Messbrücke, es handelt sich also um eine sehr präzise Widerstandsmessung.
Im Handel gibt es bereits sehr preiswerte Leitfähigkeitsmessgeräte, deren Preis um ca. 35 € liegt. Diese Geräte zeigen die Leitfähigkeit der Lösung üblicherweise in μS/cm (2000–9999 μS/cm) an. Diese Geräte sind somit nur für einen Bereich bis maximal 0,1 mol/L Kochsalz geeignet und eignen sich daher nicht für konzentrierte Salzlösungen. Entweder muss die wässrige Lösung mit destilliertem Wasser (1/10 oder 1/100) verdünnt werden oder es müssen Spezialgeräte (Preis ab 130 €, bis 100 mS/cm) verwendet werden. Diese modernen Geräte sind recht genau, es gibt sogar eine Temperaturkompensation. Dabei rechnen sie mit Temperaturfühler und elektronischem Programm den Leitfähigkeitsmesswert um auf 25 °C. Sowohl bei 20 °C wie bei 29 °C erhält man somit identische Leitfähigkeitswerte, so dass die Werte leichter mit Leitfähigkeitsangaben aus Nachschlagewerken verglichen werden können. Der Anwender sollte jedoch vorab die Temperaturkompensation überprüfen. Leichte Abweichungen sind möglich. Mit der Messung der Leitfähigkeit einer bekannten Eichlösung (z. B. Kaliumchloridlösung) bei genau eingestellter Temperatur kann die Genauigkeit des Gerätes überprüft und – bei leichten Abweichungen – manchmal auch nachjustiert werden.
Während der Messung darf die Temperatur der Elektrolytlösung nicht schwanken – falls keine Temperaturkompensation im Gerät vorhanden ist. Eine Temperaturänderung von 1 °C bedeutet eine Leitfähigkeitsänderung von ca. 2 %. Mit Temperaturkompensation liegt die Abweichung meist unter 0,2 % pro Grad Celsius.
Leitfähigkeit von Elektrolytlösungen
Die elektrolytische Leitfähigkeit einer Lösung ist abhängig von der
- Konzentration (oft in sehr guter Näherung linear)
- Ionenladung
- Grenzleitfähigkeit der Ionen
- Temperatur
Hilfreich für die konduktometrische Konzentrationsbestimmung von ionisch einheitlichen Substanzen (z. B. die Essigsäurekonzentration von Haushaltsessig) durch konduktometrische Messung sind das Kohlrausch'sche Quadratwurzelgesetz, das Ostwald'sche Verdünnungsgesetz, die Debye-Hückel-Theorie, siehe molare Leitfähigkeit.
Anwendungen des direkten Bestimmungsverfahrens ohne Titration
- Kontrolle der Reinheit von Lösungen oder von gereinigtem Wasser (destilliertes Wasser, demineralisiertes Wasser, insbesondere auch Reinstwasser, das bei 25 °C Werte einen Leitwert von 0,055 µS/cm bzw. einen spezifischen Widerstand von 18,2 MΩcm aufweisen sollte)
- Bestimmung der Konzentration (Säurebad, Salzlösung) mit Eichkurven, Tabellen, z. B. Lösungen von Regeneriersalz
- Bestimmung der Gesamtkonzentration aller Elektrolyte (Wasseranalyse, Medizin)
- Analyse einer Substanz anhand von typischen Stoffeigenschaften (Vergleich mit Tabellen)
Konduktometrische Titration

Die Leitfähigkeitstitration oder kondumetrische Titration (verkürzt auch Konduktometrie) ist eine Titrationsmethode, bei der nach jedem Reagenzzusatz der ohmsche Widerstand der Analysenlösung bzw. dessen Kehrwert, der elektrische Leitwert mittels Wechselstrom gemessen wird. Bei der konduktometrischen Titration werden Ionen mit einem sehr hohen Leitvermögen (z. B. Protonen, Hydroxidionen – siehe Grenzleitfähigkeit) durch Zugabe von Ionen mit entgegengesetzter Ladung neutralisiert. Säureprotonen werden beispielsweise von Hydroxidionen einer Natronlauge zu Wasser und Salz umgewandelt. Wasser und Salz haben ein geringeres Leitvermögen als eine reine Säure. Dies macht sich in einer Abnahme der Leitfähigkeit bemerkbar. Sobald sich bei einer Titration alle Protonen zu Wasser umgewandelt haben, steigt bei weiterer Laugezugabe die Leitfähigkeit wieder kräftig an, da nun wieder Ionen mit hoher Leitfähigkeit (Hydroxidionen) vorliegen. Wenn man die Titration mit standardisierten Normallösungen ausführt, erkennt man am Leitfähigkeitsanstieg den Titrationsendpunkt und die Ionenmenge (z. B. Säuregehalt) einer Probe.
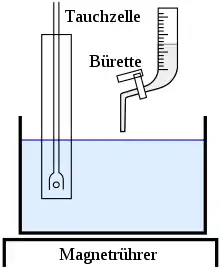
Die Messwerte werden grafisch aufgetragen (Leitfähigkeit über Reagenszusatz). Die Messpunkte in unmittelbarer Nähe des Äquivalenzpunktes liegen oft nicht auf der Geraden, der Titrationspunkt wird daher durch Extrapolation ermittelt. Es ist sogar möglich, eine schwächere und eine stärkere Säure gemeinsam zu titrieren, da sich die jeweilige Stoffmenge aus den Knickpunkten der zwei unterschiedlichen Geradensteigungen ergibt.
Anwendung der konduktometrischen Titration
Die wichtigsten Arten der Gehaltsbestimmung durch konduktometrische Titration sind
- Weil Protonen und Hydroxidionen eine sehr hohe Leitfähigkeit (genauer Grenzleitfähigkeit) besitzen, sind Säure-Base-Titrationen bei konduktometrischen Titrationen besonders beliebt. Titrationen können auch in nichtwässrigen Lösungen vorgenommen werden (z. B. Amine, Amide, Anilinderivate in wasserfreier Essigsäure mit eingestellter Perchlorsäure).
- Fällungstitrationen. Auch bei Ausfällungstitrationen kann sich die Leitfähigkeit deutlich ändern. Beispiele sind:
- Fällung von Halogeniden (Cl−, Br−, I−) mittels einer Silbernitratlösung, siehe Argentometrie
- Fällung von Sulfat mittels einer Bariumchlorid- oder Bariumacetatlösung
- Fällung von Mercaptiden oder Thiolen mittels einer HgCl2-Lösung
- Komplexbildungstitrationen
Geschichte
Das erste Konduktometer wurde von Friedrich Wilhelm Georg Kohlrausch entwickelt. Anders als bei Gleichstrommessungen wird durch Wechselstrom die Überspannung der Elektroden vermieden, so dass die Leitfähigkeit der Elektrolytlösung ohne Messabweichung bestimmt werden kann. Die Konduktometrie wurde von I. M. Kolthoff, G. Jander und O. Pfundt in die Analytik eingeführt.
Literatur
- Ullmanns Encyklopädie der technischen Chemie, 3. + 4. Auflage, Stichwort: Elektrochemische Analysenverfahren
- Udo R. Kunze: Grundlagen der quantitativen Analyse, Georg Thieme Verlag, Stuttgart 1980, S. 179–181, ISBN 3-13-585801-4