Polyphosphazene
Als Polyphosphazene wird eine Stoffklasse hybrider anorganisch-organischer Polymerer bezeichnet, deren Rückgrat aus alternierenden Phosphor- und Stickstoffatomen mit alternierenden Einfach- und Doppelbindungen gebildet und formal mit der Summenformel (NPR1R2)n beschrieben wird. Die Phosphoratome tragen zwei gleiche (R1 = R2) oder verschiedene (R1 ≠ R2)Substituenten, wie z. B. Alkoxy-, Amino-, Dialkyl- bzw. Diarylamino- (R2N-) oder Halogenreste (wie Chlor- oder Fluoratome), die wesentlichen Einfluss auf die außergewöhnlichen Eigenschaften von Polyphosphazenen haben.[1]
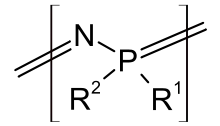
Polyphosphazene sind meist lineare Polymere, die standardmäßig durch ringöffnende Polymerisation ring-opening polymerization ROP des cyclischen Hexachlorphosphazens und nachfolgende nucleophile Substitution der Chloratome entstehen. Daneben gibt es auch so genannte cyclolineare, d. h. über lineare Segmente verknüpfte Phosphazenringe (meist löslich und flexibel) und zweidimensional vernetzte, so genannte Cyclomatrix-Phosphazene (unlöslich und starr).[2]
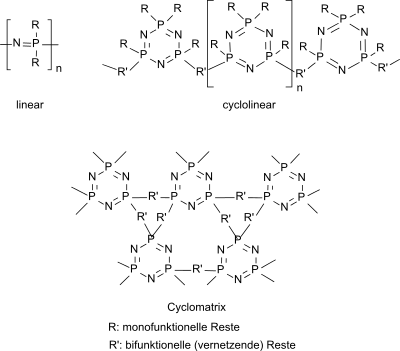
Wie von organischen Polymeren sind auch von Polyphosphazenen Blockcopolymere, Kammpolymere und Dendrimere bekannt.[3]
Grundlegende Arbeiten zu Polyphosphazenen kommen seit 1965[4] bis in die jüngste Gegenwart[5] aus dem Arbeitskreis von Harry R. Allcock an der Pennsylvania State University, State College, PA.[6]
Synthese
Polyorganophosphazene (NPR1R2)n aus Polydichlorphosphazenen (NPCl2)n
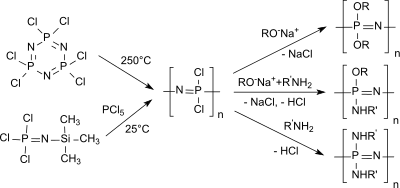
Die Standardmethode zur Synthese von Polyorganophosphazenen ist ein zweistufiger Prozess, ausgehend vom sechsgliedrigen cyclischen anorganischen Hexachlorcyclotriphosphazen (NPCl2)3, das nach Umkristallisation und Sublimation als kristalliner Feststoff in ausreichender Reinheit vorliegt.[7]
Im ersten Schritt wird beim Erhitzen über 250 °C im geschlossenen System das niedermolekulare Cyclophosphazen unter Ringöffnung in hochmolekulare (Mw 105 – 106 und höher) lineare – und bei Umsatz unter 70 % unvernetzte – Polydichlorphosphazene überführt. Die in relativ niedriger Ausbeute erhaltenen linearen Polydichlorphosphazene sind in Benzol, Toluol und Tetrahydrofuran löslich,[2] aber bereits an feuchter Luft instabil und vernetzen zu unlöslichen Produkten. Die unerwünschte Vernetzung von Polydichlorphosphazenen wird durch Auflösen in Diglyme wirksam verhindert.[8]
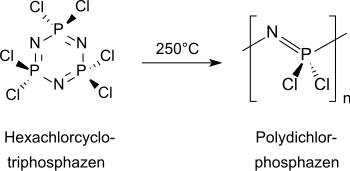
Die drastischen Polymerisationsbedingungen erlauben jedoch keine Kontrolle der Molmassen und der Molmassenverteilung (Polydispersität).
Die Polykondensation von Trichlor[(dichlorphosphoryl)imido]phosphoran Cl3P=N-P(O)Cl2[9][10] liefert beim mehrstündigen Erhitzen auf 280 °C in Gegenwart von PCl5 lineares Polydichlorphosphazen mit breiter Molmassenverteilung.[11] Die erforderlichen Reaktionsbedingungen machen die Synthese für einen industriellen Prozess unbrauchbar.
Die Reaktion von Phosphortrichlorid, Chlor und Ammoniak in Chlorbenzol bei 130 °C erzeugt in hohen Ausbeuten lineare flüssige Oligodichlorphosphazene mit einem Polymerisationsgrad bis 9 und breiter Polydispersität, die kein technisches Interesse gefunden haben.[12]
Eine weitere Alternative stellt das fluoranaloge Polydifluorphosphazen (NPF2)n[13] dar, das allerdings Polymerisationstemperaturen von 350 °C erfordert und in gängigen Lösungsmitteln unlöslich ist,[14] aber sich besonders für die Umsetzung mit Metallorganylen zur Bildung von Polyalkyl- bzw. Polyarylphosphazenen mit P-C-Bindungen eignet.
-chain-from-xtal-1972-3D-balls.png.webp)
Polyphosphazene durch kationische Polymerisation von Phosphoraniminen
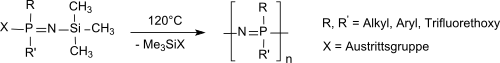
Lineare Polydichlorphosphazene mit definierten Molmassen und enger Molmassenverteilung ist zugänglich durch Polymerisation von Trichlorphosphoraniminen, wie z. B. Cl3P=N-SiMe3,[15]
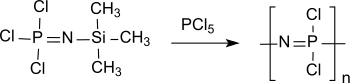
die auch als quasi lebende kationische Polymerisation in Gegenwart von Spuren von Phosphorpentachlorid PCl5 durchgeführt werden kann.[16]
Auf diesem Weg sind auch kompliziertere Polymerarchitekturen wie Blockcopolymere,[17] Kammpolymere, Sternpolymere[18] oder Dendrimere[3] realisierbar.
Polyphosphazene durch anionische Polymerisation von Phosphoraniminen
Phosphoranimine vom Typ Me3SiN=P(OCH2CF3)(OR)2 können auch unter weniger drastischen Bedingungen (unter 100 °C) anionisch durch Fluoridionen mit dem Initiator (Tetrabutylammoniumfluorid) Bu4N+ F− zu Polyphosphazenen mit relativ enger Polydispersität (< 1,4) und einstellbaren Molmassen von 10,000 bis 200,000 anionisch polymerisiert werden.[19]
Noch elektronegativere Alkoxyphosphazene, wie z. B. Tris(2,2-dinitropropoxy)-N-(trimethylsilyl)phosphoranimin, polymerisieren bereits bei Raumtemperatur mit Bu4N+ F− zu Polyphosphazenen.[20] Die Synthese der Ausgangsverbindungen ist jedoch mit erheblichem präparativem Aufwand verbunden.
Synthese von Polyorganophosphazenen
In der zweiten Stufe des Standardverfahrens über Polydichlorphosphazene werden die Chloratome am (PNCl2)n in einer nucleophilen Substitution durch organische Reste (Alkoxy, Aryloxy,[21] Amino)[22] oder Metallorganyle[23] ersetzt.
Durch Kombination mehrerer nucleophiler Reaktanden kann eine Vielzahl von Polyorganophosphazenen mit sehr unterschiedlichen Eigenschaften erzeugt werden.
Polyorganophosphazene (NPR1R2)n durch Polykondensation von reaktiven P-N-Monomeren
Statt durch ringöffnende Polymerisation von cyclischem (NPCl2)3 und nachfolgende (vollständige) Substitution der labilen Chloratome sind (stabile) lineare Polyorganophosphazene auch direkt aus organische Reste tragenden Phosphoraniminen[24][25]
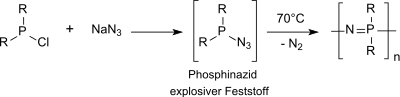
oder Phosphinaziden R2PN3 zugänglich.[26]
Meist lassen sich auch auf diesen Syntheserouten keine kontrolliert hohen Molmassen und engen Polydispersitäten erzeugen, die für technische Anwendungen wichtige Parameter wie hohe Festigkeit bei guter Verarbeitbarkeit und definierte Phasenübergänge bedingen.
Einen brauchbaren Kompromiss scheint der Weg über das relativ einfach zugängliche Trichlor(trimethylsilyl)phosphoranimin Cl3P=N-SiMe3 (aus Lithium-bis(trimethylsilyl)amid und PCl5) zu bieten.[15] Außerdem sind für die Alternativsynthesen oft teure und gefährliche (z. B. Azide) Reagentien und ein erheblicher präparativer Aufwand erforderlich, der einem kommerziellen Durchbruch der so dargestellten definierten Polyphosphazene im Wege steht.[27]
Die Stoffklasse der Polyphosphazene hat wegen ihrer außergewöhnlichen Eigenschaften großes Interesse in der akademischen Forschung gefunden, so dass bis zum Jahr 2004 bereits mehr als 700 verschiedene Polyphosphazene dargestellt und beschrieben wurden.[28][29]
Eigenschaften
Die unterschiedlichen Polyphosphazene verdanken ihre hohe Flexibilität, außerordentliche thermische Stabilität und Feuerbeständigkeit, hohen Brechungsindex, Beständigkeit gegenüber energiereicher Strahlung, sowie Durchlässigkeit für UV- und sichtbares Licht wesentlich dem wegen der Bindungsabstände und -winkel hochflexiblen Polymerrückgrat –[–N=P(R1R2)–]n–. Die Variation der Seitengruppen an der Polyphosphazenkette bestimmt entscheidend über die Hydrophilie bzw. Hydrophobie, die chemische Stabilität, die Permeabilität für Lösungsmittel, die mechanische Festigkeit und Elastizität, der breite Bereich der Glasübergangstemperatur TG zwischen −100 °C bis +180 °C[30] und die Biokompatibilität[31] von Polyphosphazenen.
Anwendungen
Elastomere
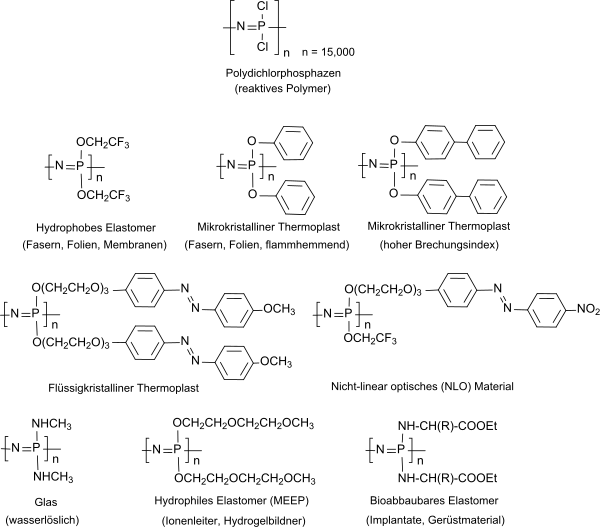
Fluoralkoxysubstituierte elastomere Polyphosphazene des Typs PN-F mit zwei unterschiedlich langen Seitengruppen sind amorph und wurden wegen ihrer Resistenz gegenüber Treibstoffen, Öle und Hydraulikflüssigkeiten im Temperaturbereich zwischen −60 °C und +175 °C unter dem Markennamen EypelR F als Basismaterial für O-Ringe und Dichtungen in Luft- und Raumfahrtanwendungen vermarktet.[28]
-Typen.svg.png.webp)
Das Arylalkoxy-Polyphosphazen PN-A wurde wegen seiner feuerhemmenden Eigenschaften als Kabelisolierungsmaterial angeboten. Die Kommerzialisierung der Eypel-Typen scheiterte an ihren selbst für Militäranwendungen exorbitanten Preisen; die Produktion wurde daher in den 1990er Jahren von der Ethyl Corporation eingestellt.
Zwei unterschiedliche flexible Seitengruppen, wie z. B. Alkoxy-, Aryloxy- oder Oligo-ethylenoxy-Gruppen in willkürlicher Abfolge entlang der -N=P-N=P-Kette behindern die Kristallisation und erlauben die flexible Beweglichkeit des Polymerrückgrats und führen somit ebenfalls zu Elastomeren.[32] Die Variation der Seitengruppen erzeugt Polyorganophosphazene mit hydrophoben (Alkyloxy) bis hydrophilen wasserlöslichen (Oligoethylenoxy) Eigenschaften mit Glasübergangstemperaturen zwischen −100 °C bis +100 °C.[33]
Thermoplaste
Polyorganophosphazene mit zwei identischen Seitengruppen, wie z. B. Methoxy (CH3O), Ethoxy (CH3CH2O), Phenoxy (C6H5O), Amino (H2N, RHN, R2N) sowie das frühe „Arbeitspferd“ der Allcock-Gruppe Trifluorethoxy (CF3CH2O) sind in der Regel thermoplastische Materialien. Insbesondere das Poly[bis(2,2,2-trifluorethoxy)phosphazen] wurde wegen seiner ausgeprägten Hydrophobie[34], Bioverträglichkeit[35], sowie Feuerbeständigkeit und Strahlungsstabilität und wegen seiner Eignung zur Herstellung von Mikrofasern, Folien und Membranen intensiv untersucht.[36]
Polymerelektrolyte
Lineare Polyphosphazene mit Oligoethylenoxy-Seitengruppen, wie z. B. MEEP, werden seit vielen Jahren auf ihre Einsatzmöglichkeiten als feste (und feuerfeste) Polymerelektrolyten in wiederaufladbaren Lithium-Ionen-Akkumulatoren untersucht,[37] da sie gute Lösungsmittel für Leitsalze, wie z. B. Lithiumtrifluormethansulfonat (Lithiumtriflat, Li+ CF3SO3−), Lithiumbis(trifluormethansulfonat)imid (LiTFSI, Li+ (CF3SO3−)2N) oder Lithiumbis(oxalato)borat (LiBOB, Li+ B(C2O4)2−) darstellen und brauchbare Ionenleitfähigkeiten aufweisen.[38]
Vernetzte Polyaryloxyphosphazene mit Sulfonsäure- bzw. Phosphonsäuregruppen sind wegen ihrer Protonenleitfähigkeit als Membranen für Protonenaustauschmembran-Brennstoffzellen (engl. proton exchange membrane fuel cell, PEMFC) und wegen ihrer niedrigen Methanolpermeabilität auch für Direktmethanolbrennstoffzellen (DMFC) von Interesse.[39][40]
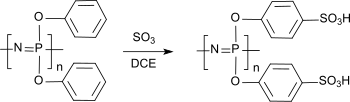
Membranen und Hydrogele
Auch als Werkstoffe zur Herstellung von Gastrennmembranen[41] und Pervaporationsmembranen wurden Polyorganophosphazene in Betracht bezogen.[42]
Wasserlösliche Polyphosphazene mit Oligoethylenoxy-Seitengruppen können durch Bestrahlung mit Gammastrahlen vernetzt werden.[43] Die vernetzten Polyorganophosphazene quellen mit Wasser zu Hydrogelen,[44] die bei Temperaturwechsel einen Sol-Gel-Phasenübergang vollziehen, d. h. unterhalb einer kritischen Temperatur expandieren und darüber kontrahieren und zur gesteuerten Wirkstofffreisetzung eingesetzt werden können.[45]
Die Einführung polymerisierbarer Gruppen, wie z. B. Acrylsäureesterfunktionen, in die Oligoethylenglycolseitengruppen erlaubt die nachträgliche Vernetzung durch UV-Bestrahlung und liefert Hydrogele mit verbesserter mechanischen Stabilität[46]
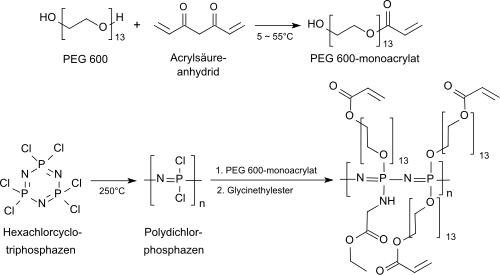
Carboxylatgruppenhaltige Polyphosphazene können auch durch Zugabe zweiwertiger Kationen, wie z. B. Calciumionen Ca2+ reversibel zu Hydrogelen vernetzt werden und eröffnen einen weiteren Zugang zu Implantaten mit kontrollierter Wirkstoffabgabe.[47]
Implantatmaterialien
Die extreme Variabilität im chemischen Aufbau (Seitengruppen am P-Atom der Polymerkette) und in der Molekülarchitektur möglicher Copolymerstrukturen von Polyorganophosphazenen sowie deren generell gute Bioverträglichkeit ermöglichen den gezielten Aufbau biomedizinischer Materialien für Kurz- und Langfristanwendungen im physiologischen Milieu.[48][49] So wurde eine Vielzahl von Polyorganophosphazenen als makromolekularer Wirkstoffträger (engl. drug carrier)[50][51], als Membranen für die kontrollierte Wirkstoffabgabe (engl. drug delivery),[45][47] als biostabile elastomere Gerüstmaterialien, insbesondere mit Aminosäureseitengruppen,[52] und als bioabbaubare Gerüstmaterialien für den Knochensubstanzaufbau[53][54] und den Gewebeersatz (engl. tissue engineering).[55][56] Die Polyorganophosphazene werden – abhängig von den chemischen Natur der Seitenketten und der Molekülarchitektur – innerhalb Wochen oder Monaten vollständig zu Ammonium- und Phosphationen abgebaut.
Trotz intensiver Forschungs- und Entwicklungsarbeiten seit den ersten Beobachtungen von Justus von Liebig im Jahr 1832[57][58] haben Polyorganophosphazene – im Gegensatz zu den ähnlichen Polyorganosiloxanen – bisher keine nachhaltigen kommerziellen technischen Anwendungen gefunden. Eine aktuelle Begründung dafür gibt H.R. Allcock[36] im Jahr 2014: Perhaps the greatest impediment to wider commercialization is the difference in chemistry compared to that used in conventional petrochemical polymer manufacturing. („Das vielleicht größte Hindernis für eine breitere Vermarktung ist der Unterschied in der Chemie im Vergleich zu der, die bei der Herstellung konventioneller petrochemischer Polymerer zur Anwendung kommt.“)
Aufgrund der anspruchsvollen Synthesen für die funktionellen Monomeren, der aufwendigen polymeranalogen Umsetzungen zu den Polymeren, sowie der ausgeprägten Neigung der Zwischenstufen, insbesondere der halogenhaltigen Präpolymeren des Typs (NPCl2)n, zu Hydrolyse und Vernetzung[27] bleiben Polyphosphazene wohl auch weiterhin interessante Exoten unter den Polymeren.
Literatur
- H.R. Allcock: Chapter 7: Phosphazene High Polymers, in RSCA Polym. Chem. Ser. No 11 Phosphorus-based polymers: from synthesis to applications. Hrsg.: S. Monge, G. David. 2014, ISBN 978-1-84973-646-6, S. 125–150.
- A.K. Andrianov: Polyphosphazenes for biomedical applications. Wiley, 2009, ISBN 978-0-470-19343-3.
- J.E. Mark, H.R. Allcock, R. West: Inorganic Polymers. 2. Auflage. Oxford University Press, 2005, ISBN 0-19-513119-3.
- V. Chandrasekhar: Inorganic and organometallic polymers. Springer, 2005, ISBN 3-540-22574-9, doi:10.1007/b137079.
- M. Gleria, R. De Jaeger, P.Potin: Synthesis and characterization of poly(organophosphazenes). Nova Science Publishers, 2004, ISBN 1-59454-024-1.
- M. Gleria, R. De Jaeger: Polyphosphazenes: A worldwide insight. Nova Science Publishers, 2004, ISBN 1-59454-024-1.
- H.R. Allcock: Chemistry and applications of polyphosphazenes. Wiley-Interscience, 2003, ISBN 0-471-44371-9.
Weblinks
Einzelnachweise
- P. Potin, R. De Jaeger: Polyphosphazenes: Synthesis, structures, properties, applications. In: Eur. Polym. J. Band 27, Nr. 4–5, 1991, S. 341–348, doi:10.1016/0014-3057(91)90185-Q.
- F.F. Stewart, T.A. Luther, M.K. Harrup, C.J. Orne: Phosphazene: A Worldwide Insight, Chapter 24: Linear and Cyclomatrix Polyphosphazene Research for Membrane Applications. Hrsg.: M. Gleria, R. De Jaeger. Nova Science Publishers, 2004, ISBN 1-59033-423-X, S. 573–590.
- S.Y. Cho, H.R. Allcock: Dendrimers Derived from Polyphosphazene−Poly(propyleneimine) Systems: Encapsulation and Triggered Release of Hydrophobic Guest Molecules. In: Macromolecules. Band 40, Nr. 9, 2007, S. 3115–3121, doi:10.1021/ma062582w.
- H.R. Allcock, R.L. Kugel: Synthesis of high polymeric alkoxy- and aryloxyphosphonitriles. In: J. Amer. Chem. Soc. Band 87, Nr. 18, 1965, S. 4216–4217, doi:10.1021/ja01096a056.
- R.J. Davidson, E.W. Ainscough, A.M. Brodie, M.R. Waterland, H.R. Allcock, M.D. Hindenlang, G.N.L. Jameson: Avoiding Crosslinking in Iron-Polyphosphazene Metallo-Polymers. In: Inorg. Chem. Commun. Band 51, 2015, S. 1–3, doi:10.1016/j.inoche.2014.10.011.
- Harry R. Allcock. auf der Webseite der The Pennsylvania State University.
- R. Koci Voznicova, J. Taraba, J. Prihoda, M. Alberti: The synthesis and characterization of new aminoadamantane derivatives of hexachloro-cyclo-triphosphazene. In: Polyhedron. Band 27, 2008, S. 2077–2082, doi:10.1016/j.poly.2008.04.001.
- A.K. Andrianov, J. Chen, M.P. LeGolvan: Poly(dichlorophosphazene) as a precursor for biologically active polyphosphazenes: Synthesis, characterization, and stabilization. In: Macromolecules. Band 37, Nr. 2, 2004, S. 414–420, doi:10.1021/ma0355655.
- Patent US3231327: Preparation of N-Dichlorophosphinyl-imidophosphoric trichloride. Angemeldet am 13. November 1961, veröffentlicht am 25. Januar 1966, Anmelder: FMC Corp., Erfinder: L. Seglin, M.R. Lutz, H. Stange.
- R. De Jaeger, P. Potin: Chapter 2: Poly(dichlorophosphazene) from P-trichloro-N-dichlorophosphoryl monophosphazene Cl3P=N-POCl2, in Synthesis and Characterization of Poly(organophosphazenes). Hrsg.: M. Gleria, R. De Jaeger. Nova Science Publishers, 2004, ISBN 1-59454-024-1, S. 25–48.
- Patent US5132389: Polycondensation of impure P2NOCl5 into uncrosslinked Poly(dichlorophosphazenes) in the presence of PCl5. Angemeldet am 22. Oktober 1990, veröffentlicht am 21. Juli 1992, Anmelder: Atochem, Erfinder: R. de Jaeger, G. D’Halluin, G. Pagniez, P. Potin.
- Patent US4198381: Process for preparing low molecular weight linear phosphonitrilic chloride oligomers. Angemeldet am 21. August 1978, veröffentlicht am 15. April 1980, Anmelder: Ethyl Corp., Erfinder: E.D. Hornbaker, H.M. Li.
- T.L. Evans, H.R. Allcock: Poly(difluorophosphazene): A new intermediate for the synthesis of poly(organophosphazenes). In: J. Macromol. Sci., Chem. Band 16, Nr. 1, 1981, S. 409–423, doi:10.1080/00222338108082059.
- H.R. Allcock, D.B. Patterson, T.L. Evans: Synthesis of Open‑Chain Poly(difluorophosphazene) and its Reactions with Alkoxides. In: Macromolecules. Band 12, Nr. 2, 1979, S. 172–177, doi:10.1021/ma60068a002.
- Patent US5698664: Synthesis of polyphosphazenes with controlled molecular weight and polydispersity. Angemeldet am 26. April 1995, veröffentlicht am 16. Dezember 1997, Anmelder: The Penn State Research Foundation, University of Toronto, Erfinder: H.R. Allcock, C.T. Morrissey, I. Manners, C.H. Honeyman.
- H.R. Allcock, C.A. Crane, C.T. Morrissey, J.M. Nelson, S.D. Reeves, C.H. Honeyman: “Living” cationic polymerization of phosphoranimines as an ambient temperatur route to polyphosphazenes with controlled molecular weight. In: Macromolecules. Band 29, Nr. 24, 1996, S. 7740–7747, doi:10.1021/ma960876j.
- H.R. Allcock, R. Prange: Properties of Poly(phosphazene−siloxane) Block Copolymers Synthesized via Telechelic Polyphosphazenes and Polysiloxane Phosphoranimines. In: Macromolecules. Band 34, Nr. 20, 2001, S. 6858–6865, doi:10.1021/ma010088g.
- Y. Cui, X. Tang, X. Huang, Y. Chen: Synthesis of the star-shaped copolymer of epsilon-caprolactone and L-lactide from a cyclotriphosphazene. In: Biomacromolecules. Band 4, Nr. 6, 2003, S. 1491–1494, doi:10.1021/bm034237+.
- R.A. Montague, K. Matyjaszewski: Synthesis of Poly[bis(trifluoroethoxy)phosphazene under mild conditions using a fluoride initiator. In: J. Amer. Chem. Soc. Band 112, Nr. 18, 1990, S. 6721–6723, doi:10.1021/ja00174a047.
- R.D. Chapman, M.F. Welker, C.R. Kreutzberger: Polyalkoxyphosphazenes by room-temperature polymerization of an electronegative phosphoranimine monomer. In: J. Inorg. Organomet. Polym. Band 6, Nr. 3, 1996, S. 267–275, doi:10.1007/BF01057751.
- H.R. Allcock, R.L. Kugel, K.J. Valan: Phosphonitrilic compounds. VI. High molecular weight poly(alkoxy and aryloxy-phosphazene). In: Inorg. Chem. Band 5, Nr. 10, 1966, S. 1709–1715, doi:10.1021/ic50044a016.
- H.R. Allcock, R.L. Kugel: Phosphonitrilic compounds. VII. High molecular weight poly(diaminophosphazenes). In: Inorg. Chem. Band 5, Nr. 10, 1966, S. 1716–1718, doi:10.1021/ic50044a017.
- H.R. Allcock, C.T.-W. Chu: Reaction of Phenyllithium with Poly(dichlorophosphazene). In: Macromolecules. Band 12, Nr. 4, 1979, S. 551–555, doi:10.1021/ma60070a003.
- R.H. Neilson, P. Wisian-Neilson: Poly(alkyl/arylphosphazenes) and their precursors. In: Chem. Rev. Band 88, Nr. 3, 1988, S. 541–562, doi:10.1021/cr00085a005.
- K. Matyjaszewski, M. Cypryk, J. Dauth, R.A. Montague, M.L. White: New synthetic routes towards polyphosphazenes. In: Makromol. Chem. Macromol. Sym. Band 54–55, Nr. 1, 1992, S. 13–30, doi:10.1002/masy.19920540105.
- K. Matyjaszewski, U. Franz, R.A. Montague, M.L. White: Synthesis of polyphosphazenes from phosphoranimines and phosphine azides. In: Polymer. Band 35, Nr. 23, 1994, S. 5005–5011, doi:10.1016/0032-3861(94)90656-4.
- O. Nuyken, S.T. Pask: Ring-opening polymerization – An introductory review. In: Polymers. Band 5, 2013, S. 361–403, doi:10.3390/polym5020361.
- M. Gleria, R. De Jaeger: Polyphosphazenes: A Worldwide Insight. Nova Science Publishers, 2004, ISBN 1-59454-024-1.
- L.S. Nair, Y.M. Khan, C.T. Laurencin: Polyphosphazenes, in Handbook of Fluoropolymer Science and Technology, Chapter 22. Hrsg.: J.O. Hollinger. CRC Press, 2012, ISBN 978-1-4398-1256-3, S. 385–400.
- V. Chandrasekhar: Inorganic and Organometallic Polymers. Springer, 2005, ISBN 3-540-22574-9, doi:10.1007/b137079.
- H.R. Allcock, N.L. Morozowich: Bioerodible polyphosphazenes and their medical potential. In: Polym. Chem. Band 3, 2012, S. 578–590, doi:10.1039/C1PY00468A.
- H.R. Allcock, G.S. McDonnell, J.L. Desorcie: Synthesis of new polyphosphazene elastomers. In: Macromolecules. Band 23, Nr. 17, 1990, S. 3873–3877, doi:10.1021/ma00219a001.
- A.L. Weikel, D.K. Lee, N.R. Krogman, H.R. Allcock: Phase changes of poly(alkoxyphosphazenes), and their behavior in the presence of oligoisobutylene. In: Polym. Eng. Sci. Band 51, 2011, S. 1693–1700, doi:10.1022/pen.21623.
- A. Singh, L. Steely, H.R. Allcock: Poly[bis(2,2,2-trifluoroethoxy)phosphazene] superhydrophobic nanofibers. In: Langmuir. Band 21, Nr. 25, 2005, S. 11604–11607, doi:10.1021/la052110v.
- H. Kawakami, S. Kanezaki, M. Sudo, M. Kanno, S. Nagaoka, S. Kubota: Biodegradation and Biocompatibility of Polyorganophosphazene. In: Artificial Organs. Band 26, 2002, S. 883–890, doi:10.1046/j.1525-1594.2002.07029.x.
- H.R. Allcock: Fluorinated Polyphosphazenes, in Handbook of Fluoropolymer Science and Technology, Chapter 1. Hrsg.: D.W. Smith, Jr., S.T. Iacono, S.S. Iyer. John Wiley & Sons, Inc., 2014, ISBN 978-0-470-07993-5, S. 1–20.
- H.R. Allcock, N.J. Sunderland, R. Ravikiran, J.M. Nelson: Polyphosphazenes with Novel Architectures: Influence on Physical Properties and Behavior as Solid Polymer Electrolytes. In: Macromolecules. Band 31, Nr. 23, 1998, S. 8026–8035, doi:10.1021/ma9804491.
- S. Jankowsky, M.M. Hiller, H.-D. Wiemhöfer: Preparation and electrochemical performance of polyphosphazene based salt-in-polymer electrolyte membranes for lithium ion batteries. In: J. Power Sources. Band 253, 2014, S. 256–262, doi:10.1016/j.powsour.2013.11.120.
- X. Zhou, J. Weston, E. Chalkova, M.A. Hofmann, C.M. Ambler, H.R. Allcock, S.N. Lvov: High temperature transport properties of polyphosphazene membranes for direct methanol fuel cells. In: Electrochim. Acta. Band 48, Nr. 14–16, 2003, S. 2173–2180, doi:10.1016/S0013-4686(03)00201-9.
- R. Wycisk, P.N. Pintauro: Polyphosphazene membranes for fuel cells. In: Adv. Polym. Sci. Band 216, 2008, S. 157–183, doi:10.1007/12_2007_130.
- C.J. Orme, F.F. Stewart: Mixed gas hydrogen sulfide permeability and separation using supported polyphosphazene membranes. In: J. Membrane Sci. Band 253, Nr. 1–2, 2005, S. 243–249, doi:10.1016/j.memsci.2004.12.034.
- F.F. Stewart, M.K. Harrup, T.A. Luther, C.J. Orme, R.P. Lash: Formation of pervaporation membranes from polyphosphazenes having hydrophilic and hydrophobic pendant groups: Synthesis and characterization. In: J. Appl. Polym. Sci. Band 80, 2001, S. 422–431, doi:10.1002/1097-4628(20010418)80:3<422::AID-APP1115>3.0.CO;2-H.
- H.R. Allcock, S. Kwon, G.H. Riding, R.J. Fitzpatrick, J.L. Bennett: Hydrophilic polyphosphazenes as hydrogels: radiation cross-linking and hydrogel characteristics of poly [bis (methoxyethoxyethoxy)phosphazene]. In: Biomaterials. Band 9, Nr. 6, 1988, S. 509–513, doi:10.1016/0142-9612(88)90046-4.
- H.R. Allcock: Crosslinking reactions for the conversion of polyphosphazenes into useful materials. In: Chem. Mater. Band 6, Nr. 9, 1994, S. 1476–1491, doi:10.1021/cm00045a003.
- Patent US8075916B2: Poly(organophosphazene) hydrogels for drug delivery, preparation method thereof and use thereof. Angemeldet am 14. Juni 2007, veröffentlicht am 13. Dezember 2011, Anmelder: KIST Korea Institute of Science and Technology, Erfinder: S.-C. Song, M.-R. Park, S.-M. Lee.
- Z. Huang, X. Liu, S. Chen, Q. Lu, G. Sun: Injectable and cross-linkable polyphosphazene hydrogels for space-filling scaffolds. In: Polym. Chem. Band 6, 2015, S. 143–149, doi:10.1039/C4PY00967C.
- A.K. Andrianov, S. Cohen, K.B. Visscher, L.G. Payne, H.R. Allcock, R. Langer: Controlled release using ionotropic polyphosphazene hydrogels. In: J. Control. Release. Band 27, Nr. 1, 1993, S. 69–77, doi:10.1016/0168-3659(93)90058-D.
- H.R. Allcock, N. Morozowich: Bioerodible polyphosphazenes and their medical potential. In: Polym. Chem. Band 3, 2012, S. 578–590, doi:10.1039/C1PY00468A.
- I. Teasdale, O. Brüggemann: Polyphosphazenes for medical applications. Smithers Rapra Technology, 2014, ISBN 978-1-909030-88-6.
- I. Teasdale, S. Wilfert, I. Nischang, O. Brüggemann: Multifunctional and biodegradable polyphosphazenes for use as macromolecular anti-cancer drug carriers. In: Polym. Chem. Band 2, 2011, S. 828–834, doi:10.1039/C0PY00321B.
- I. Teasdale, O. Brüggemann: Polyphosphazenes: Multifunctional, Biodegradable Vehicles for Drug and Gene Delivery. In: Polymers. Band 5, 2013, S. 161–187, doi:10.3390/polym5010161.
- A.L. Baillargeon, K. Mequanint: Biodegradable polyphosphazene biomaterials for tissue engineering and delivery of therapeutics. In: BioMed Res. Int. 2014. Article ID 761373, doi:10.1155/2014/761373.
- M. Deng u. a.: Dipeptide-based polyphosphazene and polyester blends for bone tissue engineering. In: Biomaterials. Band 31, Nr. 18, 2010, S. 4898–4908, doi:10.1016/j.biomaterials.2010.02.058.
- N.L. Morozowich, J.L. Nichol, H.R. Allcock: Investigation of apatite mineralization on antioxidant polyphosphazenes for bone tissue engineering. In: Chem. Mater. Band 24, Nr. 17, 2012, S. 3500–3509, doi:10.1021/cm3022825.
- M. Deng, S.G. Kumar, Y. Wan, U.S. Toti, H.R. Allcock, C.T. Laurencin: Polyphosphazene polymers for tissue engineering: an analysis of material synthesis, characterization and applications. In: Soft Matter. Band 6, 2010, S. 3119–3132, doi:10.1039/B926402G.
- S. Rothemund u. a.: Degradable glycine-based photo-polymerizable polyphosphazenes for use as scaffolds for tissue regeneration. In: Macromol. Biosci. 2014, S. 1–13, doi:10.1002/mabi.201400390.
- H. Rose: Ueber eine Verbindung des Phosphors mit dem Stickstoff. In: Ann. Pharm. Band 11, 1834, S. 129–139, doi:10.1002/jlac.18340110202.
- J. Liebig: Nachtrag der Redaction. In: Ann. Pharm. Band 11, 1834, S. 139–150, doi:10.1002/jlac.18340110202.