Trifluoressigsäure
Trifluoressigsäure (Abkürzung: TFA) ist eine synthetische chemische Verbindung aus der Gruppe der Perfluorcarbonsäuren. Sie ist ein fluorierter Abkömmling der Essigsäure, wobei alle drei Wasserstoffatome der Methylgruppe durch Fluoratome ersetzt („substituiert“) sind. Ihre Salze und Ester heißen Trifluoracetate.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
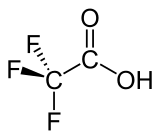 | |||||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluoressigsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2HF3O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende, hygroskopische Flüssigkeit[1][2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,02 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,48 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
72,5 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
0,23[3] | ||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser,[1] Ethanol, Aceton und Diethylether[4] | ||||||||||||||||||
| Brechungsindex |
1,2855[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−1069,9 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
Trifluoressigsäure kommt durch Eintrag verschiedener Chemikalien in der Umwelt vor. Im Meerwasser beträgt die Konzentration circa 200 ng pro Liter.[7] In der Umwelt entsteht sie aber unter anderem auch durch Photooxidation des häufig verwendeten Kältemittels 1,1,1,2-Tetrafluorethan.[8] Überdies entsteht sie als atmosphärisches Abbauprodukt von fast allen synthetischen Kältemitteln der vierten Generation, die auch Hydrofluorolefine (HFO) genannt werden, wie zum Beispiel 2,3,3,3-Tetrafluorpropen. Ein weiterer Mechanismus führt über den Metabolismus perfluorierter Arzneistoffe wie Fluoxetin oder Flutamid zum Abbauprodukt Trifluoressigsäure.[9] Einmal entstanden ist sie in der Umwelt praktisch nicht mehr abbaubar (persistent). Mediankonzentrationen von einigen Mikrogramm pro Liter wurden in Bier und Tee gefunden.[10]
Eigenschaften

Trifluoressigsäure ist eine farblose, stark hygroskopische Flüssigkeit[11] mit einem stechenden Essig-Geruch. Sie ist gesundheitsschädlich beim Einatmen, verursacht schwere Verätzungen und ist auch in Verdünnung schädlich für Wasserorganismen. In der Hitze oder unter Ultraschall zersetzt sich Trifluoressigsäure unter Bildung von Fluorwasserstoff. Stark exotherme Reaktionen treten mit Metallen (besonders Leichtmetalle) und Laugen auf. Die Reaktion von Trifluoressigsäure mit Lithiumaluminiumhydrid führt zur Explosion.[2]
Trifluoressigsäure ist eine starke organische Säure. Sie ist mit Wasser, Fluorchlorkohlenwasserstoffen und organischen Lösungsmitteln mischbar. TFA ist stabil bis 400 °C; unter Sauerstoff ist Trifluoressigsäure stabil bis ca. 200 °C.[12] Ihr pKs-Wert beträgt 0,23.[3] Der große Unterschied des pKs-Wertes, im Vergleich zur Essigsäure, kommt durch den elektronenziehenden Effekt der Fluoratome zustande, wodurch das Säureanion stabilisiert wird.
Verwendung
Trifluoressigsäure wird in der Biotechnologie als Lösungsmittel für Proteine genutzt.[13] Problematisch ist die weitere Behandlung dieser Lösung. Im größeren Maßstab muss TFA im Hinblick auf Umweltauflagen zurückgewonnen werden (z. B. durch Destillation).
Weblinks
Einzelnachweise
- Eintrag zu Trifluoressigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Datenblatt Trifluoressigsäure (PDF) bei Merck, abgerufen am 19. Januar 2011.
- chem.wisc.edu: pKa Data, Compiled by R. Williams (PDF; 645 kB).
- Eintrag zu Trifluoressigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Mai 2014.
- Eintrag zu Trifluoroacetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- Hartmut Frank, Eugen H. Christoph, Osmund Holm-Hansen, John L. Bullister: Trifluoroacetate in ocean waters. In: Environmental Science & Technology. Band 36, Nr. 1, 1. Januar 2002, S. 12–15, doi:10.1021/es0101532, PMID 11811478.
- E.H. Christoph: Bilanzierung und Biomonitoring von Trifluoracetat und anderen Halogenacetaten, Dissertation, 2002, Universität Bayreuth
- Cormac D. Murphy: Microbial degradation of fluorinated drugs: biochemical pathways, impacts on the environment and potential applications. In: Applied Microbiology and Biotechnology. Band 100, Nr. 6, 1. März 2016, S. 2617–2627, doi:10.1007/s00253-016-7304-3.
- Marco Scheurer, Karsten Nödler: Ultrashort-chain perfluoroalkyl substance trifluoroacetate (TFA) in beer and tea – An unintended aqueous extraction. In: Food Chemistry. Band 351, 2021, S. 129304, doi:10.1016/j.foodchem.2021.129304.
- Brockhaus ABC Chemie, 3. Auflage, F.A. Brockhausverlag Leipzig 1971, S. 1436.
- F. Swarts, Bull. Acad. R. Belg. Classe Sci. 8, 343, 1922.
- Joseph J. Katz: Anhydrous Trifluoroacetic Acid as a Solvent for Proteins. In: Nature. Band 174, Nr. 4428, 11. September 1954, S. 509–509, doi:10.1038/174509a0.

