Trimethylsilylcyanid
Trimethylsilylcyanid (TMSCN) stellt eine aktivierte Form des Cyanwasserstoffs (HCN) dar, bei dem das Wasserstoffatom durch eine Trimethylsilylgruppe ersetzt ist. Bei der Cyansilylierung mit TMSCN, d. h. 1,2-Addition einer Cyano- und Trimethylsilylgruppe an eine Doppelbindung, wie z. B. an die C=O-Bindung von Aldehyden und Ketonen, werden – auch optisch aktive – Cyanhydrine in exzellenten Ausbeuten gebildet. Daneben ist Trimethylsilylnitril ein wertvolles Synthon zur Darstellung von Isonitrilen, α-Aminonitrilen, β-Hydroxynitrilen, 2-Cyanpyridinen usw. in sehr guten Ausbeuten.[5][7] TMSCN bildet mit Luftfeuchtigkeit rasch hochgiftige Blausäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trimethylsilylcyanid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H9NSi | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 99,21 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
ca. 51 hPa bei 20 °C[4] | |||||||||||||||
| Löslichkeit |
in Wasser und protischen Lösungsmitteln schnelle Zersetzung, löslich in organischen Lösungsmitteln, wie Dichlormethan und Chloroform[5][6] | |||||||||||||||
| Brechungsindex |
1,392 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Die Herstellung von Trimethylsilylcyanid beruht formal auf der Reaktion einer Trimethylsilylverbindung TMS-X, wie Chlortrimethylsilan TMS-Cl mit Cyanwasserstoff HCN oder Metallcyaniden Y-CN, wie Kaliumcyanid unter Bildung eines im organischen Medium schwerlöslichen Metallhalogenids Y-X.
Ältere Verfahren zur Herstellung von Trimethylsilylcyanid verwenden teure Reagenzien, wie z. B. Silbercyanid, den schwierig zu handhabenden gasförmigen Cyanwasserstoff oder hohe Überschüsse an Alkalicyaniden mit Phasentransferkatalysatoren und benötigen relativ lange Reaktionszeiten, um lediglich bescheidene Ausbeuten < 70 % zu erzielen. Auch die Vorschrift aus Organic Syntheses[6] mit Lithiumcyanid (aus Acetoncyanhydrin und Lithiumhydrid) und TMS-Cl erscheint aufwendig, umständlich und mit schwankenden Ausbeuten zwischen 59 und 82 % unergiebig.
Eine lösungsmittel- und katalysatorfreie Variante verwendet ein äquimolares Gemisch aus Trimethylsilylchlorid und Hexamethyldisilazan, das bei Raumtemperatur innerhalb von 1,5 Stunden mit überschüssigem Cyanwasserstoff reagiert. Nach Abfiltrieren des Nebenprodukts Ammoniumchlorid und Destillation wird TMSCN in 98%iger Reinausbeute erhalten.[8]
Aus dem Arbeitskreis von Manfred T. Reetz stammt eine Variante, bei der Trimethylsilylchlorid mit äquimolaren Mengen eines Alkalimetallcyanids in Gegenwart von katalytischen Mengen von Kaliumiodid KI und N-Methylpyrrolidon NMP bei Raumtemperatur zur Reaktion gebracht werden.[9]
Die Ausbeuten von 87 bis 90 % liegen deutlich höher als bei den älteren Verfahren mit Alkalicyaniden, die Reaktionszeit von ca. 12 Stunden bei einmolaren Ansätzen ist für einen technischen Prozess aber noch zu hoch.
Technisch leistungsfähiger erscheint eine halbkontinuierliche Verfahrensvariante, bei der TMS-Cl mit einer etwa äquimolaren Menge Alkalicyanids in Gegenwart katalytischer Mengen von Kupfer(I)-cyanid in Sulfolan als Lösungsmittel bei ca. 180 °C zur Reaktion gebracht, wobei das entstehende TMSCN mit nicht-umgesetzten TMS-Cl abdestilliert. Das Gemisch wird destillativ getrennt und das TMS-Cl in den Reaktor zurückgeführt. Innerhalb von 2 Stunden ist das zugegebene TMS-Cl vollständig umgesetzt.[10]
Bei Zudosierung von weiterem TMS-Cl und NaCN in den Sulfolan/CuCN-Reaktionsansatz kann die Reaktion erneut ablaufen, wobei eine Gesamtausbeute an Trimethylsilylcyanid von 94 % erzielt wird.
Eigenschaften
Trimethylsilylcyanid ist eine klare farblose bis gelbliche, thermisch stabile, aber brennbare Flüssigkeit, die stechend nach Blausäure riecht und sich in Wasser und protischen Lösungsmitteln, wie z. B. Methanol rasch unter Bildung von sehr giftigem Cyanwasserstoff zersetzt. In aprotischen organischen Lösungsmitteln, wie Dichlormethan oder Chloroform ist TMSCN löslich.[5]
Anwendungen
Die Umsetzung von Carbonsäurechloriden mit Trimethylsilylcyanid führt in glatter Reaktion mit hohen Ausbeuten zu den entsprechenden Acylcyaniden.[11]
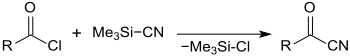
Pivaloylcyanid bzw. Benzoylcyanid als Ausgangsverbindungen für die Herbizide Metribuzin bzw. Metamitron sind auf diesem Weg einfach zugänglich.[10]
In tert-Alkylhalogeniden, die mit Alkalicyaniden meist unter Eliminierung reagieren, wird mit Trimethylsilylcyanid in Gegenwart von Zinn(IV)-chlorid in brauchbaren Ausbeuten (> 70 %) das Halogenid gegen die Nitrilgruppe ausgetauscht.[12]

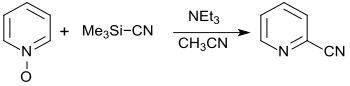
Bei der Reissert-Henze-Reaktion reagiert Cyantrimethylsilan mit Pyridin-N-oxid in Gegenwart von Triethylamin in Acetonitril in 80%iger Ausbeute zu 2-Cyanpyridin.[13]
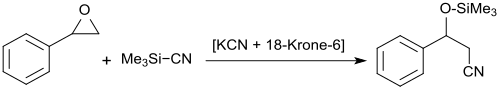
Gespannte Ringverbindungen, wie z. B. Oxirane, Oxetane oder Aziridine reagieren mit TMSCN in Gegenwart katalytischer Mengen von Kaliumcyanid und 18-Krone-6 unter Ringöffnung, wobei das Cyanidion stets an das am wenigsten substituierte Kohlenstoffatom addiert wird.[14]
Der ambidente Charakter des Cyanidanions zeigt sich bei der Katalyse von Reaktionen mit Trimethylsilylcyanid mit weichen Lewis-Säuren, wie Zinkiodid ZnI2, oder Zinn(II)-chlorid SnCl2, wobei aus Epoxiden β-Hydroxyisonitrile entstehen, die brauchbare Vorstufen für β-Aminoalkohole und Oxazoline darstellen. Im Fall des Epoxids Cyclohexenoxid entsteht durch Cyansilylierung in Gegenwart von Zinkiodid das TMS-geschützte Cyanhydrin, aus dem mit Kaliumfluorid KF die Schutzgruppe praktisch quantitativ abgespalten und das Endprodukt trans-2-Isocyanocyclohexanol in 76 % Gesamtausbeute isoliert werden kann.[15]

In einer Eintopfreaktion in Wasser bei Raumtemperatur reagieren äquimolare Mengen von Aldehyden und Aminen mit Trimethylsilylnitril in Gegenwart von Indium-Pulver in sehr guten Ausbeuten (bis 98 %) in einer Strecker-Synthese zu den entsprechenden α-Aminonitrilen, aus denen durch saure Hydrolyse α-Aminosäuren erhalten werden.[16]

Trimethylsilylcyanid ist das Standardreagenz zur Cyansilylierung, der Umsetzung von Carbonylverbindungen, wie Aldehyden und Ketonen zu achiralen und chiralen Cyanhydrinen (α-Hydroxynitrilen). Wie die Arbeitsgruppe um George A. Olah zeigen konnte, erfordert die Reaktion in Dimethylformamid DMF keine Katalysatoren, wird aber durch Zugabe von Carbonaten, wie z. B. Kaliumcarbonat K2CO3 und Phosphaten, wie z. B. Kaliumphosphat K3PO4 signifikant beschleunigt.[17]

Die erzielten Ausbeuten liegen meist deutlich über 80 %.
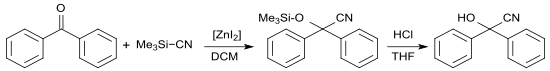
Die Cyansilylierung der reaktionsträgeren Ketone erfordert den Zusatz von Katalysatoren, wie z. B. Zinkiodid, wobei aus dem silylierten Cyanhydrin nach Hydrolyse mit verdünnter Salzsäure das Benzophenoncyanhydrin in 79- bis 86%iger Ausbeute erhalten wird.[18]
Auch empfindliche Ketone, wie 2-Acetylfuran, können mit Cyanotrimethylsilan in Gegenwart von N-Methylmorpholin-N-oxid in hoher Ausbeute (91 %) in das achirale Cyanhydrin überführt werden.[19]
Aus dem Arbeitskreis von Elias James Corey stammt eine Methode der enantioselektiven Synthese zur Darstellung chiraler Cyanhydrine mittels chiraler Borverbindungen unter Verwendung von TMSCN und Triphenylphosphinoxid mit hohen Ausbeuten und Enantiomerenüberschüssen > 90 % ee.[20]
Einzelnachweise
- Eintrag zu Trimethylsilylcyanid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Trimethylsilylcyanid 98% bei Sigma-Aldrich, abgerufen am 25. Juni 2018 (PDF).
- Datenblatt Trimethylsilyl cyanide, 98% bei AlfaAesar, abgerufen am 25. Juni 2018 (PDF) (JavaScript erforderlich).
- Datenblatt Trimethylsilylcyanid zur Synthese (PDF) bei Merck, abgerufen am 25. Juni 2018.
- W.C. Groutas, Z. Jin, H. Zhang: Cyanotrimethylsilane. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2011, doi:10.1002/047084289X.rc276.pub2.
- T. Livinghouse: Trimethylsilyl cyanide: Cyanosilation of p-benzoquinone In: Organic Syntheses. 60, 1981, S. 126, doi:10.15227/orgsyn.060.0126; Coll. Vol. 7, 1990, S. 517 (PDF).
- E. Soleimani: Trimethylsilyl Cyanide (TMSCN). In: Synlett. Band 10, 2017, S. 1625–1626, doi:10.1055/s-2007-982537.
- Patent US5258534: Preparation of trimethylsilyl nitrile. Angemeldet am 5. Februar 1993, veröffentlicht am 2. November 1993, Anmelder: Huls America, Inc., Erfinder: G.L. Larson, T.V. John, R.R. Chawla, C.S. Subramaniam.
- Patent US4429145: Preparation of trimethylsilyl cyanide. Angemeldet am 14. September 1982, veröffentlicht am 31. Januar 1984, Anmelder: Bayer AG, Erfinder: M. T. Reetz, I. Chatziiosifidis.
- Patent EP0040356A2: Verfahren zur Herstellung von Trimethylsilylcyanid. Angemeldet am 16. Mai 1980, veröffentlicht am 25. November 1981, Anmelder: Bayer AG, Erfinder: K. Findeisen, K.-H. Linker.
- R. Sustmann: Comprehensive Organic Synthesis, Volume 6, Heteroatom Manipulations, 1st Edition. Pergamon Press, Oxford 1991, ISBN 0-08-040597-5, S. 317–318.
- M.T. Reetz, I. Chatziiosifidis, H. Künzer, H. Müller-Starke: Trimethylsilyl cyanide promoted cyanation of tertiary alkyl chlorides and other SN1 active compounds. In: Tetrahedron. Band 39, Nr. 6, 1983, S. 961–965, doi:10.1016/S0040-4020(01)88594-X.
- H. Vorbrüggen, K. Krolikiewicz: Trimethylsilanol as Leaving Group; III1. A Simple One-Step Conversion of Aromatic Heterocyclic N-Oxides to α-Cyano Aromatic N-Heterocycles. In: Synthesis. Band 4, 1983, S. 316–319, doi:10.1055/s-1983-30321.
- M.B. Sassaman, G.K.Surya Prakash, G.A. Olah: Synthetic methods and reactions. 144. Regiospecific and chemoselective ring opening of epoxides with trimethylsilyl cyanide-potassium cyanide/18-crown-6 complex. In: J. Org. Chem. Band 55, Nr. 7, 1990, S. 2016–2018, doi:10.1021/jo00294a012.
- P.G. Gassman, T.L. Guggenheim: Conversion of epoxides to β-hydroxy isocyanides In: Organic Syntheses. 64, 1986, S. 39, doi:10.15227/orgsyn.064.0039; Coll. Vol. 7, 1990, S. 294 (PDF).
- D. Bandyopadhyay, J.M. Velazquez, B.K. Banik: A truly green synthesis of α-aminonitriles via Strecker reaction. In: Org. Med. Chem. Lett. Band 1, 2011, S. 1–11, doi:10.1186/2191-2858-1-11.
- G.K. Surya Prakash, H. Vaghoo, C. Panja, V. Surampudi, R. Kultyshev, T. Mathew, G.A. Olah: Effect of carbonates/phosphates as nucleophilic catalysts in dimethylformamide for efficient cyanosilylation of aldehydes and ketones. In: PNAS. Band 104, Nr. 9, 2007, S. 3026–3030, doi:10.1073/pnas.0611309104.
- P.G. Gassmann, J.J. Talley: Conversion of ketones to cyanohydrins: Benzophenone cyanohydrin In: Organic Syntheses. 60, 1981, S. 14, doi:10.15227/orgsyn.060.0014; Coll. Vol. 7, 1990, S. 20 (PDF).
- S.S. Kim, D.W. Kim, G. Rajagopal: Mild and efficient silylcyanation of ketones catalyzed by N-methylmorpholine-N-oxide. In: Synthesis. Band 2, 2004, S. 213–216, doi:10.1055/s-2003-44380.
- D.H. Ryu, E.J. Corey: Highly enantioselective cyanosilylation of aldehydes catalyzed by a chiral oxazaborolidinium ion. In: J. Am. Chem. Soc. Band 126, Nr. 26, 2004, S. 8107–8107, doi:10.1021/ja0475959.


