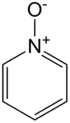
Pyridin-N-oxid
Pyridin-N-oxid ist eine organische Verbindung, welche aus einem Pyridinring besteht, der am Stickstoffatom oxidiert ist.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pyridin-N-oxid | |||||||||||||||
| Andere Namen |
Pyridin-1-oxid | |||||||||||||||
| Summenformel | C5H5NO | |||||||||||||||
| Kurzbeschreibung |
weißer, technisch auch brauner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 95,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Generell werden alle Derivate des Pyridins mit einem Sauerstoff-Atom am Ring-Stickstoff als Pyridin-N-oxide bezeichnet, wobei Pyridin-1-oxid die Stammverbindung ist.
Darstellung
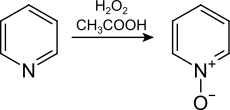
Die Verbindung kann durch die Umsetzung von Pyridin mit Peroxycarbonsäuren hergestellt werden. Die Peroxycarbonsäuren können hierbei aus der zu Grunde liegenden Säure und Wasserstoffperoxid in situ hergestellt werden.[4] Die Reaktion ähnelt mechanistisch der Prileschajew-Reaktion. Ein weiteres Oxidationsmittel zur Herstellung von Pyridin-N-oxid ist beispielsweise Carosche Säure.[6]
Eigenschaften
Die mittels DSC bestimmte Zersetzungswärme beträgt −102 kJ·mol−1 bzw. −1076 kJ·kg−1.[7]
Verwendung
Elektrophile aromatische Substitutionen an Pyridin verlaufen mit guter Selektivität in 3-Position ab, was auf die elektronische Struktur des Pyridinrings zurückzuführen ist. Die Kohlenstoffatome in 3-Position weisen die höchste Elektronendichte aller Kohlenstoffatome im Ring auf, weshalb bevorzugt an dieser Position substituiert wird. Das oxidierte Stickstoffatom im N-oxid bewirkt jedoch die Erhöhung der Elektronendichte im Ring und die Umkehr der elektronischen Struktur des Rings. Die Kohlenstoffatome in 2- und 4-Position besitzen somit im Gegensatz zu Pyridin die höchste Elektronendichte. Dies führt zu einer Umkehr der Selektivität und in elektrophilen Substitutionen werden bevorzugt die 2- und 4-substituierten Produkte erhalten. Aus diesem Grund ist Pyridin-N-oxid eine bedeutende Ausgangsverbindung zur Synthese von 2- oder 4-substituierten Pyridinen (z. B. 4-Nitropyridin-N-oxid), welche nicht durch nukleophile aromatische Substitution zugänglich sind.[4][8]
Reaktionen
Nach erfolgter Substitution kann das Stickstoffatom meist glatt reduziert werden, wobei das substituierte Pyridinderivat erhalten wird. Als Reduktionsmittel eignen sich allgemein dreiwertige Phosphorverbindungen oder zweiwertige Schwefelverbindungen, welche leicht oxidierbar sind. Als günstiges Reagenz wird häufig Triphenylphosphan eingesetzt, welches zu Triphenylphosphinoxid oxidiert wird. Des Weiteren können Samarium(II)-iodid, Zinn(II)-chlorid oder Chrom(II)-chlorid bei Raumtemperatur zur Desoxygenierung von Pyridin-N-oxid eingesetzt werden.[4] Die Reduktion mittels Ammoniumformiat in Gegenwart von Palladium auf Aktivkohle führt zur Desoxygenierung des Stickstoffs und gleichzeitig zur Hydrierung des Pyridinrings, sodass ein Derivat des Piperidins erhalten wird.[4]
Einzelnachweise
- Datenblatt Pyridin-N-oxid bei Acros, abgerufen am 1. Mai 2010.
- Datenblatt Pyridin-N-oxid bei AlfaAesar, abgerufen am 1. Mai 2010 (PDF) (JavaScript erforderlich).
- C. Rüchardt, O. Krätz, S. Eichler: Reaktionen von Pyridin-N-oxid mit Säureanhydriden. In: Chem. Ber. 102, 1969, S. 3922–3946, doi:10.1002/cber.19691021137.
- J. A. Joules, K. Mills: Heterocyclic Chemistry. 5. Auflage. Blackwell Publishing, Chichester, 2010, ISBN 978-1-4051-9365-8, S. 125–141.
- Datenblatt Pyridine N-oxide bei Sigma-Aldrich, abgerufen am 9. Mai 2017 (PDF).
- A. R. Gallopo, J. O. Edwards: Kinetics and mechanism of the oxidation of pyridine by Caro's acid catalyzed by ketones. In: J. Org. Chem. 46, 1981, S. 1684–1688; doi:10.1021/jo00321a032.
- T. Grewer, O. Klais: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften. (= Humanisierung des Arbeitslebens. Band 84). VDI-Verlag, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
- D. T. Davies: Basistexte Chemie: Aromatische Heterocyclen. 1. Auflage. Wiley-VCH, Weinheim, 1995, ISBN 3-527-29289-6.