Oxetan
Oxetan ist eine organische Verbindung. Oxetan ist der einfachste Vertreter der heterocyclischen Vierringe mit einem Sauerstoffatom im Ring und zählt deshalb zu den cyclischen Ethern.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
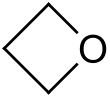 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Oxetan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,89 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
48 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (681 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,3961 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−110,8 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Oxetan ist eine reaktive, farblose, leichtflüchtige Flüssigkeit.
Synthese
Durch Reaktion von 3-Chlorpropylacetat mit Kaliumhydroxid bei ca. 140 – 150 °C.[6]
Die Ausbeute liegt allerdings nur bei etwas über 40 %, weil sich etliche Nebenprodukte bilden.
Eine andere Möglichkeit besteht darin, 3-Chlorpropan-1-ol mit einer starken Base zu cyklisieren.
Dabei ist die Ausbeute aber noch niedriger als bei der ersten Reaktion.[6]
Eine weitere Möglichkeit ist es, Oxetane durch eine Paternò-Büchi-Reaktion herzustellen.
Reaktivität
Lewis-Säuren wie Bortrifluorid (BF3) können an ein nichtbindendes Elektronenpaar am O-Atom des Oxetans addiert werden. In Dichlormethan als Lösungsmittel findet dann eine Cyclooligomerisierung statt. Als Hauptprodukt entsteht das Cyclotrimer 1:[7]
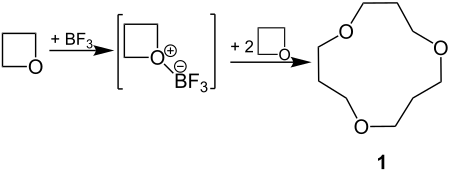
Unter anderen Reaktionsbedingungen, besonders in der Gegenwart von Wasser, entstehen lineare Polyether.[7]
Siehe auch
Einzelnachweise
- Datenblatt Oxetan (PDF) bei Merck, abgerufen am 18. Januar 2011.
- Eintrag zu 1,3-Epoxypropan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-408.
- Eintrag zu 1,2-epoxypropane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- C. R. Noller: Trimethylene Oxide In: Organic Syntheses. 29, 1949, S. 92–93, doi:10.15227/orgsyn.029.0092; Coll. Vol. 3, 1955, S. 835 (PDF).
- Theophil Eicher, Siegfried Hauptmann, Andreas Speicher: The Chemistry of Heterocycles, Wiley-VCH, 2012, ISBN 978-3-527-32747-8, S. 45–48.

