Strecker-Synthese
Die Strecker-(Aminosäure)-Synthese ist eine Namensreaktion der Organischen Chemie. Ihr Entdecker, Adolph Strecker (1822–1871), publizierte sie erstmals 1850.[1]

Es handelt sich um einen Spezialfall der Mannich-Reaktion, bei dem aus Aldehyden, Ammoniak und Cyanwasserstoff (HCN) α-Aminocarbonsäuren bzw. Aminosäuren entstehen. Die Synthese ist ferner gültig für primäre und sekundäre Amine.
Mechanismus
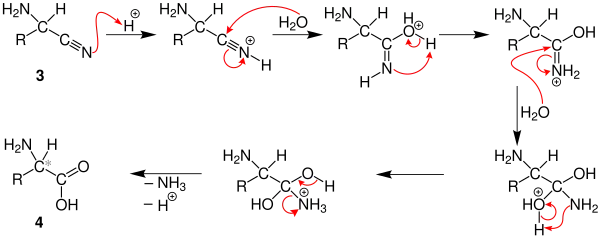
Die Reaktion verläuft über die nukleophile Addition des Ammoniaks am Aldehyd 1. Diese verläuft im Allgemeinen bis zum Imin 2. An diese ebenfalls elektrophile Spezies addiert sich das Cyanid, es entsteht so ein α-Aminonitril 3 (ein Nitril mit einer Aminogruppe):[2][3]

Das α-Aminonitril 3 wird im sauren Milieu mehrmals hydrolysiert, wodurch letztlich die α-Aminosäure 4 als Racemat entsteht:
Praxis
Nachteil der Streckersynthese ist vor allem, dass aufgrund der fehlenden asymmetrischen Induktion die Aminosäuren racemisch entstehen. Dies erhöht aufgrund der per se um 50 % verringerten Ausbeute und nachfolgender aufwendiger Trennverfahren, in der Regel die kinetische Racematspaltung, die Kosten erheblich. Ebenso ist der Umgang mit Cyanid aufgrund von dessen Toxizität problematisch. Einige Strecker-Synthesen haben sich dennoch in der technischen Großproduktion durchgesetzt, da die Edukte (insbesondere Ammoniak und Cyanwasserstoff) teilweise sehr preiswert sind und es immer noch auf diesen Synthesenweg ausgerichtete alte Anlagen gibt. Die Bucherer-Bergs-Reaktion ist beispielsweise eine eingesetzte Variante.
Es existieren auch asymmetrische Strecker-Synthesen.[4] In der Variante von Horst Kunz verwendet man einen chiralen 1-Aminozucker (β-D-Galactosamin) statt Ammoniak dessen asymmetrische Induktion ausreicht, um befriedigende Enantiomerenüberschüsse zu erzielen.[5]
Einen weiteren interessanten Zugang zur asymmetrischen Variante der Streckersynthese entwickelte die Arbeitsgruppe um Enders. Sie benutzen SAMP-Hydrazone als asymmetrische Induktion bei der Addition des Cyanids.[6]
Siehe auch
Einzelnachweise
- Adolph Strecker: Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper. In: Annalen der Chemie und Pharmacie. 75, 1850, S. 27–45, doi:10.1002/jlac.18500750103.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, S. 446–447, ISBN 978-0-12-429785-2.
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism. 5. Edition. Springer 2014. S. 591–592. doi:10.1007/978-3-319-03979-4_268
- J. Mulzer, H.-J. Altenbach, M.Braun, K. Krohn, H.-U. Reissig, Organic Synthesis Highlights, VCH, Weinheim, 1991, S. 303.
- Horst Kunz, Wilfried Sager: Diastereoselektive Strecker-Synthese von α-Aminonitrilen an Kohlenhydrat-Matrices. In: Angewandte Chemie. Band 99, Nr. 6, 1987, S. 595–597, doi:10.1002/ange.19870990629.
- Dieter Enders, Michael Moser: Asymmetric Strecker synthesis by addition of trimethylsilyl cyanide to aldehyde SAMP-hydrazones. In: Tetrahedron Letters. Band 44, Nr. 46, 2003, S. 8479–8481, doi:10.1016/j.tetlet.2003.09.098.