Oxazoline
Oxazoline (Dihydrooxazole) sind heterocyclische Verbindungen, deren Fünfring je ein Sauerstoffatom und ein Stickstoffatom sowie eine Doppelbindung im Ring enthält. Die Heteroatome Sauerstoff und Stickstoff stehen zueinander in 1,3-Stellung, wobei dem Sauerstoffatom die Position 1 und dem Stickstoffatom die Position 3 zugewiesen wird. Je nach Lage der Doppelbindung im heterocyclischen Ring gibt es mehrere zueinander isomere Oxazoline:
- 2-Oxazoline,
- 3-Oxazoline und
- 4-Oxazoline.
Synthese
2-Oxazoline entstehen bei der Dehydratisierung von N-(2-Hydroxyalkyl)amiden durch innermolekulare Cyclisierung.[1] Man kann 2-Oxazoline auch aus β-Halogenalkylamiden durch Erhitzen mit wässrigen oder alkoholischen Alkalien darstellen. Sie lassen sich auch durch die Kondensationsreaktion von 1,2-Aminoalkoholen mit Carbonsäureestern, Carbonsäureamiden oder Nitrilen gewinnen. In 2-Stellung substituierte 2-Oxazoline sind durch die Umsetzung von Benzaldehyden mit Ethanolamin unter Anwendung von 1,3-Diiod-5,5-dimethylhydantoin (DIH) als Oxidationsmittel zugänglich.[2][3][4] Die gezielte Synthese der 3-Oxazoline erfolgt analog einer Variante der Asinger-Reaktion aus 2-Halogenaldehyden, Ammoniak, Natronlauge und einer Oxokomponente (meist ein Keton).[5] Bei einigen Synthesen fallen 3-Oxazoline als Nebenprodukte an.[6]
Das erste Oxazolin wurde 1884 synthetisiert.[7]
Eigenschaften
| Unsubstituierte Oxazoline | |||
| Name | 2-Oxazolin | 3-Oxazolin | 4-Oxazolin |
| Andere Namen | 4,5-Dihydrooxazol | 2,5-Dihydrooxazol | 2,3-Dihydrooxazol |
| Strukturformel | 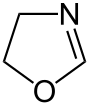 |
 |
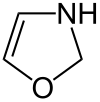 |
| CAS-Nummer | 504-77-8 | 95879-85-9 | 6569-13-7 |
| PubChem | 21865211 | ||
| Summenformel | C3H5NO | ||
| Molare Masse | 71,08 g·mol−1 | ||
| Aggregatzustand | flüssig[8] | ||
| Kurzbeschreibung | farblose Flüssigkeit[8] | ||
| Siedepunkt | 98 °C[8] | ||
| Dichte | 1,075 g·cm−3[8] | ||
- 2-Oxazoline enthalten eine C=N-Doppelbindung zwischen dem Kohlenstoffatom 2 und dem Stickstoffatom
- 3-Oxazoline enthalten eine C=N-Doppelbindung zwischen dem Kohlenstoffatom 3 und dem Stickstoffatom
- 4-Oxazoline enthalten eine C=C-Doppelbindung zwischen den Kohlenstoffatomen 4 und 5.
Am weitaus wichtigsten sind die 2-Oxazoline. Es sind meist farblose, pyridinähnlich riechende Flüssigkeiten von schwach basischem Charakter, deren niedere Glieder sich in Wasser lösen.
Reaktivität
2-Oxazoline sind cyclische Imidsäureester (Synonym: Imidoester)[9] und können mit starken Reduktionsmitteln, z. B. mit Natrium und Alkohol, unter Ringspaltung zu N-substituierten Aminoalkoholen aufgespalten werden.[10] Mit p-Toluolsulfonsäuremethylester als Initiator lassen sich 2-alkyl-substituierte 2-Oxazoline polymerisieren. Nach Verseifung entsteht daraus ein lineares Polyethylenimin.[11] 3-Oxazoline reagieren wie Imine (Schiffsche Basen).[5] 4-Oxazoline zählen zugleich zur Verbindungsklasse der Enamine.
2-Oxazolin-5-one reagieren mit Carbonylverbindungen unter Wasserabspaltung zu Azlactonen.
Durch Metallierung des 2-Alkylsubstituenten bei 2-Oxazolinen lässt sich eine große Zahl chiraler und achiraler Carbonsäure-Derivate aus den um ein Kohlenstoffatom ärmeren Säuren herstellen. Andere Umsetzungen führen zu Aldehyden, Ketonen, Lactonen, Aminosäuren, Thiiranen und Olefinen. Wegen der Beständigkeit des Oxazolinsystems gegen viele Reagentien (RMgX, LiAlH4, CrO3, schwache Säuren und Basen) kann es als Schutzgruppe für Carbonsäuren bei Reaktionen dienen, an denen diese Stoffe beteiligt sind.[12]
Siehe auch
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie. 2. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 577.
- S. Takahashi, H. Togo: An Efficient Oxidative Conversion of Aldehydes into 2-Substituted 2-Oxazolines Using 1,3-Diiodo-5,5-dimethylhydantoin. In: Synthesis. 2009, S. 2329–2332, doi:10.1055/s-0029-1216843.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Eintrag für 1,3-Diiodo-5,5-dimethylhydantoin, abgerufen am 19. Dezember 2017.
- C. Ricco: 1,3-Diiodo-5,5-dimethylhydantoin. In: Synlett. 24, 2013, S. 2173–2174, doi:10.1055/s-0033-1339477.
- Maya Weber, Jürgen Jakob, Jürgen Martens: Synthese und Reaktivität von 3-Oxazolinen. In: Liebigs Annalen der Chemie. 1992, S. 1–6, doi:10.1002/jlac.199219920102.
- Julien Capra, Thierry Le Gall: Oxidative Conversion of Imines into Azadienes. In: Synlett. 2010, S. 441–444.
- David C. Palmer: The Chemistry of Heterocyclic Compounds, Oxazoles Synthesis, Reactions, and Spectroscopy. John Wiley & Sons, 2004, ISBN 0-471-64930-9, S. 332 (eingeschränkte Vorschau in der Google-Buchsuche).
- Henry Wenker: Syntheses from Ethanolamine. V. Synthesis of Δ2-Oxazoline and of 2,2'-Δ2-Dioxazoline. In: Journal of the American Chemical Society. 60, 1938, S. 2152, doi:10.1021/ja01276a036.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 427.
- Brockhaus ABC Chemie. F. A. Brockhaus Verlag, Leipzig 1965, S. 1003.
- Blandine Brissaul u. a.: Synthesis of Linear Polyethylenimine Derivatives for DNA Transfection. In: Bioconjugate Chem. 14, 2003, S. 581–587.
- A. I. Meyers, E. D. Mihelich: Die Nützlichkeit der 2-Oxazoline in der Synthese. In: Angewandte Chemie. 88, 1976, S. 321, doi:10.1002/ange.19760881004.