Thalidomid
Thalidomid (α-Phthalimidoglutarimid) ist ein 1954 entwickelter Arzneistoff, der als Schlaf- und Beruhigungsmittel unter den Markennamen Contergan und Softenon verkauft wurde und Ende der 1950er/Anfang der 1960er-Jahre zu zahlreichen schweren Schädigungen an ungeborenem Leben (Dysmelien etc.) und damit zum Contergan-Skandal führte. Chemisch gesehen gehört es, wie auch Glutethimid, Methyprylon und Pyrithyldion, zur Gruppe der Piperidindione, einer strukturellen Abwandlung der Barbiturate. Außerdem verfügt der Wirkstoff zusätzlich zur schlaffördernden Wirkung über tumorwachstumshemmende, entzündungshemmende und blutgefäßneubildungshemmende Eigenschaften. Seit dem Jahre 1998 wird Thalidomid in den USA zur Behandlung besonders schwerer Lepraformen und seit 2009 in Deutschland zur Behandlung des multiplen Myeloms unter Beachtung strenger Sicherheitsauflagen verwendet; es wird von der Firma Celgene als Generikum angeboten.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Thalidomid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C13H10N2O4 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
L04AX02 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 258,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (45–60 mg·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Schlaf- und Beruhigungsmedikament

Im März 1954 wurde in der Forschungsabteilung des Stolberger Pharmaunternehmens Grünenthal – auf der Suche nach einer günstigen Methode zur Gewinnung von Antibiotika aus Peptiden und im Rahmen der damaligen Entwicklung neuartiger Schlafmittel wie Pyrithyldion (Persedon)[2] und Glutethimid – durch die Erhitzung des Phthaloylisoglutamin von Heinrich Mückter, Wilhelm Kunz (geb. 1920) und Herbert Keller (geb. 1925) das Phthalimidoglutarimid synthetisiert.[3] Es erhielt durch den Leiter der Forschungsabteilung, Mückter, den Namen Thalidomid[4] und bestritt im Dezember 1960 fast die Hälfte des Inlandsumsatzes von Grünenthal.[3]
Die Forschungsergebnisse von Grünenthal erbrachten für Thalidomid keine pathogenen Reaktionen oder andere positive in der Heilkunde verwertbare Ergebnisse bei (nicht trächtigen) Mäusen und Ratten. Somit schien für Grünenthal der Wirkstoff harmlos zu sein. Auch zeigten hohe Dosen keine tödliche Wirkung bei Ratten, Mäusen, Meerschweinchen, Kaninchen, Katzen und Hunden, und es wurden bei Grünenthal auch keine anderen Nebenwirkungen festgestellt. Thalidomid wurde somit als „untoxisch“ eingestuft, was für eine kommerzielle Auswertung sehr attraktiv ist. Es wurde begonnen, für die patentierte Verbindung eine Anwendung zu finden. Thalidomid stellte sich in Tierversuchen zunächst nicht als sedativ dar. Da ein nicht letales Sedativum ein großes Marktpotential haben würde, entschied die Firma, die Forschung in Richtung eines Human-Schlafmittels zu intensivieren.[4]
Zunächst wurde es zur Anfallsprophylaxe bei Epilepsie verschrieben. Es zeigte zwar keine antikonvulsive Wirkung, die Patienten berichteten jedoch von der guten schlafbringenden und entspannenden Eigenschaft des Medikamentes.[4][5]
Thalidomid durfte in Deutschland nicht verkauft werden, solange nicht seine Wirkung im Tierversuch getestet wurde. Da im Tierversuch Thalidomid keine sedierende Wirkung zeigte, wurde es an Mäusen im Schüttelkäfig getestet. Dabei wurde untersucht, inwiefern sich die Bewegungen der Mäuse in der Verum-Gruppe (Gruppe, die den Wirkstoff bekam), und der Placebogruppe unterschieden.[4]
Bevor das Mittel auf den Markt kam, nahm ein Grünenthal-Mitarbeiter eine Probe mit nach Hause und gab seiner schwangeren Frau davon, um ihr zu einem besseren Schlaf zu verhelfen. Das Kind kam ohne Ohren zur Welt und wurde so zum ersten Contergan-Opfer.[4][5]
Grünenthal vermarktete die Substanz vom 1. Oktober 1957 bis November 1961 unter dem Namen Contergan als „erstes bromfreies Schlaf- und Beruhigungsmedikament ohne größere Nebenwirkungen“. Da Contergan unter anderem auch gegen die typische morgendliche Schwangerschaftsübelkeit in der frühen Schwangerschaftsphase half, wurde es Ende der 1950er-Jahre gezielt als das Beruhigungs- und Schlafmittel für Schwangere empfohlen und beworben. Im Hinblick auf Nebenwirkungen galt es als besonders sicher, denn als bromfreies Schlafmittel sollten Nebenwirkungen wie Verwirrtheitszustände, Delirien und Stottern ausbleiben. Zudem war es deutlich weniger gefährlich als die Barbiturate, die häufig bei Suiziden benutzt wurden.[6] Thalidomid war auch in den Medikamenten Algosediv, Grippex und, als Bestandteil von Grünenthal geliefert, in dem Hustenmedikament Peracon der Kali Chemie enthalten.[7]
Contergan-Skandal
Ende der 1950er-Jahre kam es zu einer zunächst unerklärlichen Häufung von Missbildungen Neugeborener. In der Öffentlichkeit und bei dem im Verlauf der Zeit erst neugegründeten deutschen Bundesgesundheitsministerium wurde eine mögliche Schädigung durch Kernenergie und insbesondere die damals oberirdisch verlaufenden Kernwaffentests vermutet. Dabei wurde die Rate von Fehlbildungen bei Kindern untersucht und eine Zunahme statistisch verneint, allerdings mit Daten, die nur bis zum Zeitpunkt der Marktzulassung von Thalidomid reichten. Aufgrund dieser Statistik glaubte man bei den neu aufgetretenen Schädigungen erst an eine zufällige Häufung, was die Ursachenforschung deutlich verzögerte.[8]
Die fruchtschädigende Wirkung des Arzneistoffes Thalidomid wurde unabhängig voneinander in Deutschland und Australien entdeckt. Der australische Arzt William McBride veröffentlichte am 16. Dezember 1961 einen Leserbrief zu Fehlbildungen bei Neugeborenen im Zusammenhang mit der Gabe von Thalidomid in The Lancet. Zuvor hatte er sich an den Lizenznehmer in Australien gewandt, der die Warnung im November 1961 an den deutschen Hersteller Grünenthal weiterleitete. Kurz vorher, am 15. November 1961, hatte der Humangenetiker Widukind Lenz das Unternehmen über seinen Verdacht in Kenntnis gesetzt. Am 18. November berichtete er auf einem Fachkongress über seinen Verdacht.[9] Die Firma Grünenthal reagierte zunächst abwartend. Obwohl dem Stolberger Herstellerunternehmen 1961 bereits 1600 Warnungen über beobachtete Fehlbildungen an Neugeborenen vorlagen, wurde Contergan nach wie vor vertrieben. Erst nachdem ein Zeitungsartikel in der Welt am Sonntag vom 26. November 1961 den Verdacht von Lenz publik gemacht hatte, zog Grünenthal schließlich am darauffolgenden Tag Contergan aus dem Handel.
Laut Bundesverband Contergangeschädigter wurden etwa 5000 contergangeschädigte Kinder geboren. Andere Quellen sprechen von 10.000 Fällen weltweit, von denen 4000 auf die Bundesrepublik Deutschland entfielen, wovon die Hälfte bereits verstorben sei (Stand von 2007). Hinzu kommt eine unbekannte Zahl von Fehlgeburten. In der DDR hatte der Zentrale Gutachterausschuss für das Arzneimittelwesen die Herstellung und den Vertrieb von Schlafmitteln auf Basis von Thalidomid abgelehnt, da man dieses als noch nicht ausreichend überprüft einstufte.[10] Einige wenige Conterganpackungen gelangten aus der Bundesrepublik in die DDR. Insgesamt sind in der DDR 8 Fälle von Missbildungen dokumentiert, die durch Contergan bedingt waren.[11]
In Österreich und in der Schweiz hieß das Mittel Softenon und war verschreibungspflichtig. Offiziell gibt es in Österreich 13 Contergan-Opfer, da man dort damals sehr restriktiv mit der Rezeptpflicht umging. In der Schweiz wurden 9 Contergan-geschädigte Kinder geboren.[12] Softenon wurde 1962 vom Markt genommen.
Auch in Brasilien gibt es anerkannte Schadensfälle durch Thalidomid.[13] Contergan wurde auch in größeren Mengen nach Osteuropa und Vorderasien geliefert.[14]
In den USA wurde Contergan die Zulassung verweigert, es wurde aber in großen Mengen „zu Testzwecken“ verteilt, nachdem der amerikanische Hersteller Richardson-Merrell die Zulassung im September 1960 erstmals beantragt hatte. Frances Oldham Kelsey, die zuständige Pharmakologin der US-Gesundheitsbehörde Food and Drug Administration, hatte sich nicht auf die Angaben der Firma Richardson-Merrell verlassen, die keine Testergebnisse beinhalteten. Stattdessen wurden nur generelle Aussagen Grünenthals und des Marketing-Departments von Richardson-Merrell angegeben, und Geschäftsleute und Politiker übten Druck auf Kelsey aus. Sie forderte Richardson-Merrell auf, Tests durchzuführen und die Ergebnisse mitzuteilen. Die Firma weigerte sich und verlangte insgesamt sechs Mal, die Zulassung zu gestatten, was jedes Mal abschlägig beschieden wurde. Im Jahre 1962 zog Richardson-Merrell dann den Antrag auf Zulassung zurück. Trotzdem wurden insgesamt 17 Kinder mit Contergan-bedingten Missbildungen geboren.[15]
Die geballte Medienpräsenz des Themas, die durch den 50. Jahrestag der Markteinführung von Contergan und den kurz darauf ausgestrahlten Fernsehzweiteiler Contergan erzeugt wurde, führte am 7. Dezember 2007 – also 46 Jahre nach Bekanntwerden der schädigenden Wirkung – zu ersten Gesprächen zwischen Grünenthal und dem Bundesverband der Contergangeschädigten.[16][17] Auch andere Geschädigte fordern zum Dialog auf und haben dazu eine das Zitat des Produzenten des Zweiteilers aufgreifende Online-Unterschriften-Aktion gestartet.[18] Betroffenen-Verbände hoffen als Ergebnis auch auf finanzielle und andere Verbesserungen ihrer Situation.[19] Zum 1. Juli 2008 wurde die Verdoppelung der monatlichen Entschädigungszahlungen umgesetzt. Dies wird von Politik und Verbänden als „erster wichtiger Schritt“ zur Milderung der „finanziellen Auswirkungen der Spät- und Folgeschäden“[20] bezeichnet.[21] Am 8. Mai 2008 gab Grünenthal bekannt, freiwillig 50 Mio. Euro in die Conterganstiftung einzahlen zu wollen, um die Lebenssituation der Contergan-Geschädigten dauerhaft zu verbessern.[22] Dies wurde am 15. Juli 2009 umgesetzt.[23]
Schädigungen durch Thalidomid
.jpg.webp)
Thalidomid führt, innerhalb der ersten drei Monate der Schwangerschaft eingenommen, zu schweren Fehlbildungen der Gliedmaßen (Dysmelien, wie beispielsweise radiale Klumphand), speziell zum Fehlen von Röhrenknochen (Phokomelie), oder sogar zum totalen Fehlen (Aplasien) von Gliedmaßen und Organen der Kinder. Thalidomid blockiert den Wachstumsfaktor VEGF (Vascular Endothelial Growth Factor), wodurch es zu einer fehlenden Vaskularisierung (Blutgefäßbildung) in den Extremitäten des Embryos kommt. Dies führt zu einer verkürzten oder fehlenden Anlage der Arme und Beine, meist beidseitig. Zu unterscheiden ist dies von einer mechanischen Abschnürung von Gliedmaßen (siehe dazu Amniotisches-Band-Syndrom).
Als direktes, teratogenes Target wurde das Protein Cereblon identifiziert, das mit weiteren Proteinen einen Ubiquitin-Ligase-Komplex bildet.[24] Dieser Komplex steuert auch die Morphogenese von Gliedmaßen, und die Hemmung der Ligaseaktivität durch Bindung von Thalidomid an Cereblon ist eine der biologischen Hauptursachen der Missbildungen.[25][26][27][28] Dieser Mechanismus wurde im Jahr 2010 bekannt.
2018 wurde veröffentlicht, dass Thalidomid und ebenso die ähnlichen Medikamente Lenalidomid und Pomalidomid verschiedene Transkriptionsfaktoren abbauen, darunter alle drei SALL4 („Sal-like protein 4“), welche für das Wachstum nötig sind. Während beim Okihiro-Syndrom, bei dem sehr ähnliche Missbildungen auftreten können, der Ausfall von SALL4 auf dessen genetischer Mutation beruht, kommt es durch diese Medikamente nicht zu einer Mutation. Dieser Ausfall betrifft neben dem Menschen nur wenige Tierarten (Primaten und Kaninchen), bei anderen wie Mäusen kommt es wegen genetischer Unterschiede nicht zum Abbau von SALL4 durch Cereblon, weswegen die teratogenen Wirkung bei den damals üblichen Tierversuchen nicht erkannt wurde.[29][30]
Bei der Thalidomid-Embryopathie ist besonders gut untersucht, zu welchem Zeitpunkt der Einwirkung des Medikaments welche Schädigung verursacht wird:[31] So kommt es beispielsweise bei einer Einnahme zwischen dem 34. und 37. Tag nach der letzten Regelblutung zu einem Fehlen der Ohrmuschel, zwischen dem 35. und 41. Tag zu einer Unterentwicklung des Daumens, zwischen dem 38. und 45. Tag treten Arm-, zwischen dem 41. und 47. Tag Bein- und zwischen dem 46. und 50. Tag Daumenfehlbildungen auf.
In der Zeit nach 1961, nachdem Contergan vom Markt zurückgezogen worden war, wurde es weiterhin an verschiedenen Tierarten getestet. Die Resultate waren größtenteils negativ oder zeigten keine vergleichbaren Fehlbildungen am Nachwuchs. Obwohl Ratten und Mäuse durch die Substanz sediert wurden (der Grund, weshalb man überhaupt auf die sedierende Wirkung des Thalidomid gekommen war, lag darin, dass bei einem Versuch, bei dem eine völlig andere Wirkung des Wirkstoffes untersucht werden sollte, die Nagetiere, die Thalidomid erhielten, wider Erwarten einschliefen), konnte auch in klassischen Tierversuchen mit hoher Konzentration keine eindeutige fruchtschädigende Wirkung des Präparates nachgewiesen werden. Erst ab 1962 zeigte sich bei Weißen Neuseeländern – einer Kaninchenrasse, die als Versuchstier vor Markteinführung nicht als Tiermodell üblich war – eine teratogene Wirkung.[32] Diese dadurch nachgewiesene Artspezifität einer teratogenen Wirkung war bis dato unbekannt und stellte ein Ereignis mangelnder Übertragbarkeit von Tierversuchsergebnissen auf den Menschen dar.
Die Befürchtung, dass Thalidomid durch Veränderung des Erbgutes auch nachfolgende Generationen schädigen könnte, hat sich nicht bewahrheitet. Die Kinder thalidomidgeschädigter Menschen sind von dem Thalidomid-Syndrom nicht betroffen.
Beim einnehmenden Patienten selbst kann sich eine Polyneuropathie ausbilden, die bei den neuen Indikationen den bedeutendsten dosislimitierenden Faktor darstellt. Sie kann sich schnell und vollständig zurückbilden, aber auch über Jahre bestehen bleiben.[33] Zudem wird ein erhöhtes Risiko für maligne Entartungen genauer untersucht, der Hersteller hatte 2013 bereits einen Rote-Hand-Brief veröffentlicht.[34]
In mehr als 2000 Forschungsberichten sind die Ergebnisse von Studien niedergeschrieben worden, die seit 1961 den molekularen Mechanismus der Fruchtschädigung zu fassen suchten,[35] und mehr als dreißig Hypothesen zur Erklärung der Schäden wurden aufgestellt.[26]
Unterschiedliche Wirkung von (S)- und (R)-Enantiomer

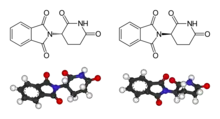
Thalidomid ist eine chirale Verbindung, die als Racemat verkauft wurde. Die sedierende Wirkung kommt dem (+)-(R)-Enantiomer zu,[36] die fruchtschädigende Wirkung wird dem (−)-(S)-Enantiomer zugeschrieben. Mittels Deuterierung des Stereozentrums konnten Thalidomid-Analoga erfolgreich stereochemisch stabilisiert werden.[37]
Pharmakokinetik
Thalidomid ist im Magen-Darm-Trakt schlecht löslich und so ist die Resorption nach peroraler Aufnahme beim Menschen langsam und umfassend. Bei einer Dosis von 200 mg wird nach 3 bis 4 Stunden eine Serumspitzenkonzentration von 1–2 mg/L erreicht. Die Eliminationshalbwertszeit beträgt etwa 6 Stunden, die, da die Eliminierung rasch verläuft, ungefähr die Resorptionsverhältnisse widerspiegelt. Thalidomid wird durch die Leber kaum metabolisiert.[38] Seine Amidbindungen werden jedoch durch Hydrolyse gespalten.[39] Die Hydroxylierung der molekularen Ringe des Thalidomids ist speziesabhängig und im Menschen von geringer Bedeutung.[40]
Die beiden Enantiomere wandeln sich im menschlichen Körper mit einer Halbwertszeit von 2 bis 6 Stunden ineinander um – sie racemisieren.[37][41] Da das (S)-Enantiomer wesentlich schneller als sein (R)-konfiguriertes Gegenstück ausgeschieden wird,[42] verbleibt im Blut ein Gleichgewichtsüberhang bei letzterem.
Synthese
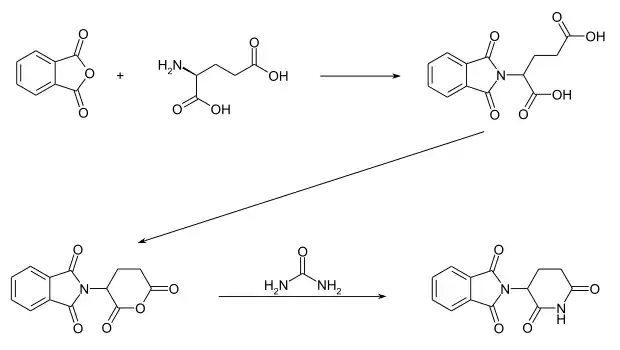
Die erste Synthesevariante von Grünenthal geht vom Phthalsäureanhydrid aus, welches im ersten Schritt in Pyridin mit L-Glutaminsäure umgesetzt wird. Das resultierende Dicarbonsäurezwischenprodukt wird danach in Gegenwart von Acetanhydrid zum Anhydrid zyklisiert. Die Zielverbindung ergibt sich dann durch eine Reaktion mit Harnstoff. Bei dieser Synthesesequenz resultiert ein Racemat.[43][44]
Neue Indikationen
In klinischen Studien zeigte Thalidomid aufgrund seiner antiinflammatorischen (entzündungshemmenden), antineoplastischen (tumorhemmenden) und antiangiogenetischen (Verminderung von Gefäßneubildung) Wirksamkeit therapeutische Effekte bei verschiedenen Krankheiten. Dazu gehören unter anderem Hauterkrankungen (Erythema nodosum leprosum, Lupus erythematodes), das multiple Myelom sowie Autoimmunerkrankungen.[8][45] Bei korrekter Anwendung wurde der Wirkstoff daher als eine hilfreiche Therapie für Patienten bewertet, für deren Krankheiten keine andere adäquate Behandlung existiert.[46] So wurde es auch erfolgreich zur Behandlung von Aphthen bei HIV-Patienten eingesetzt.[47]
Bei an Prostata-Krebs erkrankten Patienten, die sich einer intermittierenden Hormonblockade unterzogen, führte die Gabe von Thalidomid zu einer Verlängerung der Zeit bis zum Wiederanstieg des PSA-Wertes (als Zeichen einer erneuten Aktivität des Karzinoms).[48]
Lepra
Im Jahre 1964 fand der israelische Hautarzt Jacob Sheskin, der einer Lepra-Patientin Contergan aus Restbeständen verabreichte, heraus, dass sich ihre Geschwüre am nächsten Tag deutlich zurückgebildet hatten.[45] Bedingt durch diese Entdeckung wurde Thalidomid für diese Indikation getestet, vor allem in südamerikanischen Ländern wie Kolumbien und Brasilien.
Jedoch wurde das Mittel auch an Schwangere ausgegeben, und es kam in Folge wieder zu Fehlbildungen bei Neugeborenen. Da die Rate der Analphabeten in Brasilien in manchen Bevölkerungsschichten hoch ist, missverstanden viele Frauen das Etikett mit einer durchgestrichenen schwangeren Frau auf der Verpackung als Antibabypille. Dadurch kam es in Brasilien zu einer neuen Generation schwer fehlgebildeter Kinder. Infolgedessen verbot Brasilien zunächst die Herausgabe von Thalidomid an Menschen im fortpflanzungsfähigen Alter. In Brasilien gibt es insgesamt 480 anerkannte Schadensfälle durch Contergan.[49] Heute hat sich Thalidomid in Brasilien als verschreibungspflichtige Standardmedikation gegen Lepra durchgesetzt; es gilt als das wirksamste Mittel gegen die Erkrankung.
1998 beschied in den USA die Food and Drug Administration einen Zulassungsantrag positiv für ein Thalidomid-haltiges Arzneimittel zur Behandlung des Erythema Nodosum Leprosum (ENL), einer besonders schweren Verlaufsform der Lepra. Der Zulassungsinhaber Celgene hat für strenge therapiebegleitende Sicherheitsvorkehrungen zu sorgen. Ein Patient, der daran teilnimmt, muss strenge Auflagen akzeptieren und einhalten.
Multiples Myelom
Inzwischen wurde die Indikation um die Behandlung des multiplen Myeloms erweitert.[50][51] Nachdem Thalidomid 2001 bereits als so genanntes „Arzneimittel für seltene Leiden“ (orphan drug) ausgewiesen und als solches in das entsprechende EU-Gemeinschaftsregister eingetragen wurde, erteilte die EU-Kommission im April 2008 die Zulassung für eine orale Darreichungsform (50 mg Hartkapseln) zur Kombinationstherapie mit Melphalan und Prednison von Patienten mit nicht vorbehandelten multiplen Myelomen ab 65 Jahren oder Patienten, bei denen eine hoch dosierte Chemotherapie nicht in Betracht gezogen werden kann (Zulassungsinhaber: Pharmion Ltd.).[52]
Im Jahr 2019 wurde eine Cochrane-Übersichtsarbeit zu Nutzen und Schaden einiger Medikamentenkombinationstherapien zur Erstbehandlung des Multiplen Myeloms veröffentlicht. Diese Therapieform wird bei Patienten eingesetzt, die für eine Stammzelltransplantation nicht infrage kommen. Eine Medikamentenkombination mit Thalidomid war Teil der Übersichtsarbeit. Diese Kombination aus Thalidomid, Melphalan und Prednisolon verursachen wahrscheinlich eine Verlängerung des Gesamtüberlebens, im Vergleich zur alleinigen Therapie mit Melphalan und Prednisolon. Thalidomid plus Melphalan und Prednisolon verursachen vielleicht eine ausgeprägte Erhöhung des progressionsfreien Überlebens. Die Gabe von Thalidomid plus Melphalan und Prednisolon führen wahrscheinlich zu einer ausgeprägten Erhöhung von Polyneuropathien. Thalidomid plus Melphalan und Prednison verursachen eine ausgeprägte Erhöhung des Abbruchs der Studie durch die Patienten wegen unerwünschten Ereignissen. Es werden weitere Forschungsergebnisse benötigt, um die Sicherheit, Effektivität und die Auswirkungen auf die Lebensqualität dieser Therapieform einzuschätzen.[53]
Myelodysplastisches Syndrom
Die Gabe von Thalidomid zur Behandlung des myelodysplastischen Syndroms wird in multizentrischen Studien geprüft. Ein genauer Wirkmechanismus ist noch nicht bekannt, besteht aber möglicherweise in der Hemmung des Tumornekrosefaktor (TNF-α) und Stimulation von zytotoxischen T-Zellen. Vorläufige Daten zeigen, dass Thalidomid bei vielen Patienten zu einer Verbesserung der peripheren Blutzellwerte führen kann. Einige Patienten erreichen eine vollständige Normalisierung des Blutbilds.
Morbus Crohn
Durch eine starke immunmodulatorische Wirkung konnte Thalidomid auch bei der Behandlung von Kindern und Jugendlichen mit Morbus Crohn, die auf bisherige Medikamente nicht angesprochen haben, Wirkung zeigen. Als Immunsuppressivum konnte der Wirkstoff bei einer Reihe von Patienten eine lang anhaltende Remission erreichen.[54]
Indikationen in der Tiermedizin
In der Tiermedizin kann Thalidomid bei nicht Lebensmittel liefernden Tieren zur chemotherapeutischen Behandlung von bösartigen Tumoren indiziert sein.[55] Aufgrund der antiangiogenen Wirkung wurde der Einsatz zum Beispiel beim Hämangiosarkom des Hundes untersucht.[56]
In den USA und mehreren europäischen Ländern ist die Verordnung und Anwendung von Thalidomid durch Tierärzte unter gewissen Sicherheitsvorkehrungen möglich. In Deutschland ist die Verwendung des T-Rezepts exklusiv Humanmedizinern vorbehalten, was eine Anwendung in der Tiermedizin ausschließt. Obwohl das BfArM bereits im Jahr 2010 über einen entsprechenden Bedarf informierte, fehlt bislang in Deutschland eine Rechtsgrundlage zur Anwendung von Thalidomid bei Tieren.[57]
Vertrieb
Außer in den USA (seit 1998) ist Thalidomid zurzeit in Australien (seit Oktober 2003), Neuseeland (seit Dezember 2003), der Türkei (seit Juni 2004), Israel (seit September 2004) und in den Mitgliedstaaten der EU (seit April 2008) zugelassen. In den USA, China, Japan, Korea und Taiwan wird Thalidomid durch die Firma Celgene vertrieben. Diese produziert auch das dem Thalidomid ähnliche Lenalidomid. Für alle übrigen Länder hatte die britische Firma Pharmion die Vermarktungsrechte von Celgene erworben. Anfang 2008 jedoch übernahm Celgene die Firma Pharmion mit ihrem gesamten Produktportfolio. Ehemals auslizenzierte Produkte wie z. B. Thalidomid werden nun wieder ausschließlich von Celgene betreut.[58] Die Anwendung erfolgt unter strengen Sicherheitsrichtlinien.
In Deutschland ist die Abgabe thalidomidhaltiger Arzneimittel durch den § 3a der Arzneimittelverschreibungsverordnung reguliert und unterliegt der amtlichen Überwachung. Deshalb muss der Arzt für die Verordnung das so genannte T-Rezept verwenden. Es darf jeweils nur ein Präparat pro T-Rezept verordnet werden.[59] Der Arzt muss versichern, die Sicherheitsmaßnahmen gemäß der aktuellen Fachinformation einzuhalten, insbesondere auch, erforderlichenfalls ein Schwangerschafts-Präventionsprogramm durchzuführen. Ferner muss er auf der Verschreibung vermerken, ob die Behandlung innerhalb oder außerhalb (Off-Label-Use) der jeweils zugelassenen Anwendungsgebiete erfolgt.[60] Thalidomid- oder lenalidomidhaltige Arzneimittel dürfen nicht im Wege des Versandhandels in den Verkehr gebracht werden (§ 17 Abs. 2b Apothekenbetriebsordnung).
Das Unternehmen Chemie Grünenthal GmbH, das einst Contergan produzierte, verschenkte[61] Restbestände des Mittels noch bis Ende 2003 an Wissenschaftler. Die inzwischen in Aachen beheimatete Firma vertreibt heute jedoch kein Thalidomid mehr.
Siehe auch
- Contergan (Film), filmische Umsetzung aus dem Jahr 2006
- Conterganstiftung für behinderte Menschen
Literatur
- K. Roth: Eine unendliche chemische Geschichte. In: Chemie in unserer Zeit, Jahrgang 2005, Nr. 39, S. 212–217, Wiley-VCH, Weinheim, doi:10.1002/ciuz.200590038.
- Catia Monser: Contergan, Thalidomid. Ein Unglück kommt selten allein. Eggcup, Düsseldorf 1993, ISBN 3-930004-00-3, Buch einer Betroffenen.
- Beate Kirk: Der Contergan-Fall. Eine unvermeidbare Arzneimittelkatastrophe? Zur Geschichte des Arzneistoffs Thalidomid. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1999, ISBN 3-8047-1681-4 (= Greifswalder Schriften zur Geschichte der Pharmazie und Sozialpharmazie, Band 1, Zugleich Dissertation an der Universität Greifswald, 1998).
- Niklas Lenhard-Schramm: Das Land Nordrhein-Westfalen und der Contergan-Skandal. Gesundheitsaufsicht und Strafjustiz in den »langen sechziger Jahren«. Vandenhoeck & Ruprecht, Göttingen 2016, ISBN 978-3-525-30178-4.
- Ludwig Zichner, M. A. Rauschmann, K. D. Thomann u. a. (Hrsg.): Die Contergankatastrophe. Eine Bilanz nach 40 Jahren. In: Jahrbuch Deutsches Orthopädisches Geschichts- und Forschungsmuseum, Frankfurt am Main. Band 6. Steinkopff, Darmstadt 2005, ISBN 978-3-7985-1479-9.
- Henning Sjöstrom, Robert Nilsson: Thalidomide and the Power of the Drug Companies. Penguin Books, 1972; deutsche Übersetzung: Contergan oder die Macht der Arzneimittelkonzerne. VEB Verlag Volk und Gesundheit, Berlin(Ost) 1975.
- Takumi Ito u. a.: Identification of a Primary Target of Thalidomide Teratogenicity. In: Science. 327 (2010) no. 5971, S. 1345–1350, doi:10.1126/science.1177319.
- Klaus-Michael Wilsmann, Kai Zwingenberger: Die kontrastreiche Geschichte des Thalidomids. Thalidomid und seine Anwendungsgebiete. In: die waage. Zeitschrift der Grünenthal GmbH, Aachen. Band 35, 1996, Nr. 2, S. 66 f.
- Klaus-Dieter Thomann: Die Contergan-Katastrophe: Die trügerische Sicherheit der „harten“ Daten. In: Deutsches Ärzteblatt. Band 104, Nr. 41. Deutscher Ärzte-Verlag, 12. Oktober 2007, S. A-2778 / B-2454 / C-2382.
- A. Preuschhof, Einführung T-Rezept – Arzneimittelrechtliche Regelungen zur Abgabe thalidomid- oder lenalidomidhaltiger Arzneimittel, Pharmazeutische Zeitung 2009, 406.
Weblinks
- Contergan – Thalidomid: umfangreiche kommentierte Linksammlung
- Darstellung aus Sicht des Contergan-Herstellers Grünenthal
- Einträge im NIH-Studienregister
- Discovery and development of thalidomide and its analogs
- Peter-Philipp Schmitt: „Nur eine einzige Tablette im Bus“. In: FAZ vom 13. Mai 2008
- Contergannetzwerk Deutschland e. V. (CND)
Einzelnachweise
- Eintrag zu Thalidomid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- G. Mall, E. Vosseler: Klinische Erfahrungen mit „Persedon“. In: DMW – Deutsche Medizinische Wochenschrift. 75, 1950, S. 1084, doi:10.1055/s-0028-1117619.
- Wolf-Dieter Müller Jahnke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte, S. 146. 2. überarb. und erw. Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5.
- William Silverman: The Schizophrenic Career of a „Monster Drug“. In: Pediatrics. Band 110, Nr. 2, 22. April 2002, S. 404–406, doi:10.1542/peds.110.2.404.
- T. Stephens und R. Brynner: Dark Remedy – The Impact of Thalidomide and Its Revival as a Vital Medicine. Cambridge, MA; Perseus Publishing; 2001, ISBN 978-0-7382-0590-8.
- Bangen, Hans: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4, S. 78.
- Dietrich Böhm: Die Entschädigung der Contergan-Kinder. S. 159, Vorländer Verlag Siegen, 1973, angegeben in: Deutsche Gesellschaft für Soziologie: Kinder – Körper – Identitäten: Theoretische und empirische Annäherungen an kulturelle Praxis und sozialen Wandel. Hrsg.: Heinz Hengst. Beltz Juventa Verlag, Weinheim 2003, ISBN 978-3-7799-0225-6, S. 168 (eingeschränkte Vorschau in der Google-Buchsuche).
- Klaus-Dieter Thomann: Die Contergan-Katastrophe: Die trügerische Sicherheit der „harten“ Daten. In: Deutsches Ärzteblatt. Band 104, Nr. 41. Deutscher Ärzte-Verlag, 12. Oktober 2007, S. A-2778 / B-2454 / C-2382.
- W. von Lenz, K. Knapp: Die Thalidomid-Embryopathie. In: Deutsche Medizinische Wochenschrift. Stuttgart, 87(24), 1962, S. 1232–1242.
- Vgl. Silvia Ottow: DDR-Bürger schliefen ohne Contergan., Neues Deutschland, 4. Dezember 2007
- Vgl. Auch in der DDR gab es Kinder mit Missbildungen. Bundesverband: Die Betroffenen wünschen keine Öffentlichkeit. In: Mitteldeutsche Zeitung. 9. November 2007.
- Vgl. Angelika Overath: Das Janusgesicht. Contergan. In: NZZ Folio. 04/01, Thema: Pillen.
- Vgl. Stefanie Hallberg: Vom Horrormittel zum Hoffnungsträger. Comeback des Conterganwirkstoffs Thalidomid.
- Vgl. Contergan politisch kein Thema. Ausschlussfrist abgelaufen.
- Vgl. Linda Bren: Frances Oldham Kelsey: FDA Medical Reviewer Leaves Her Mark on History. In: FDA Consumer Magazine. März/April 2001.
- Pressemitteilung des Bundesverbandes (Memento vom 24. Februar 2016 im Internet Archive).
- Grünenthal-Chef trifft erstmals Contergan-Geschädigte, aachener-zeitung.de, 10. Dezember 2007.
- Unterschriften-Aktion.
- Forderungskatalog des Bundesverbandes (Memento vom 13. November 2010 im Internet Archive), neben dem weitere anderer Verbände existieren.
- Pressemitteilung des Familienministeriums zur Verdoppelung (Memento vom 15. April 2009 im Internet Archive).
- Bundesverband zur Verdoppelung (Memento vom 1. Januar 2015 im Internet Archive)
- Pressemitteilung Grünenthal: „Grünenthal bietet Contergan-Betroffenen 50 Millionen Euro an – Lösung soll Lebenssituation der Betroffenen verbessern“ Pressemitteilung der Grünenthal GmbH (PDF).
- Pressemitteilung RP-Online: „Grünenthal zahlt erneut 50 Millionen Euro für Contergan-Opfer“ (Memento vom 16. Juli 2009 im Internet Archive) RP Online.
- E. S. Fischer, K. Böhm, J. R. Lydeard et al.: Structure of the DDB1-CRBN E3 ubiquitin ligase in complex with thalidomide. In: Nature. Band 512, Nr. 7512, 2014, S. 49–53, doi:10.1038/nature13527, PMID 25043012, PMC 4423819 (freier Volltext).
- T. Ito, H. Ando, T. Suzuki et al.: Identification of a primary target of thalidomide teratogenicity. In: Science. Band 327, Nr. 5971, März 2010, S. 1345–50, doi:10.1126/science.1177319, PMID 20223979.
- T. Ito, H. Ando, H. Handa: Teratogenic effects of thalidomide: molecular mechanisms. In: Cell. Mol. Life Sci. Band 68, Nr. 9, 2011, S. 1569–79, doi:10.1007/s00018-010-0619-9, PMID 21207098.
- T. Ito, H. Handa: Molecular mechanisms of thalidomide and its derivatives. In: Proc Jpn Acad Ser B Phys Biol Sci. Band 96, Nr. 6, 2020, S. 189–203, doi:10.2183/pjab.96.016, PMID 32522938, PMC 7298168 (freier Volltext).
- T. Asatsuma-Okumura, T. Ito, H. Handa: Molecular Mechanisms of the Teratogenic Effects of Thalidomide. In: Pharmaceuticals (Basel). Band 13, Nr. 5, 2020, doi:10.3390/ph13050095, PMID 32414180, PMC 7281272 (freier Volltext).
- Contergan: Ursache für Fehlbildungen gefunden. Ärzteblatt, 3. August 2018, abgerufen am 1. März 2010.
- Katherine A Donovan et al.: Thalidomide promotes degradation of SALL4, a transcription factor implicated in Duane Radial Ray Syndrome. In: Biochemistry and Chemical Biology. 1. August 2018, doi:10.7554/eLife.38430.001.
- M. T. Miller & K. Strömland: Teratogen Update: Thalidomide: A Review, With a Focus on Ocular Findings and New Potential Uses. In: Teratology. Band 60, 1999, S. 306–321, doi:10.1002/(SICI)1096-9926(199911)60:5<306::AID-TERA11>3.0.CO;2-Y, PMID 10525208.
- Vaughan Monamy: Animal Experimentation. Cambridge University Press, 2009, ISBN 978-0-521-87879-1, S. 84.
- Empfehlungen zur Anwendung von Thalidomid bei Patienten mit einem multiplen Myelom, Konsensusgruppe der Deutschen Gesellschaft für Hämatologie und Onkologie und der Österreichischen Gesellschaft für Hämatologie und Onkologie (PDF; 313 kB)
- Rote-Hand-Brief Thalidomid (Memento vom 25. Oktober 2013 im Internet Archive) (PDF; 379 kB).
- Stand: Jahr 2000. Stephens TD, Bunde CJ, Fillmore BJ: Mechanism of action in thalidomide teratogenesis. In: Biochemical Pharmacology. Band 59, Nr. 12, 2000, S. 1489–1499, doi:10.1016/s0006-2952(99)00388-3, PMID 10799645.
- T. Eriksson, S. Björkman, B. Roth, P. Höglund: Intravenous formulations of the enantiomers of thalidomide: pharmacokinetic and initial pharmacodynamic characterization in man. In: Journal of Pharmacy and Pharmacology. Band 52, Nr. 7, 2000, S. 807–817, doi:10.1211/0022357001774660, PMID 10933131.
- Jacques V, Czarnik AW, Judge TM, Van der Ploeg LH, DeWitt SH: Differentiation of antiinflammatory and antitumorigenic properties of stabilized enantiomers of thalidomide analogs. In: Proceedings of the National Academy of Sciences U.S.A. Band 112, Nr. 12, 2015, S. E1471–9, doi:10.1073/pnas.1417832112, PMID 25775521, PMC 4378388 (freier Volltext).
- Teo SK, Colburn WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD, Laskin OL: Clinical Pharmacokinetics of thalidomide. In: Clinical Pharmacokinetics. Band 43, Nr. 5, 2004, S. 311–27, doi:10.2165/00003088-200443050-00004, PMID 15080764.
- Pischek G, Kaiser E, Koch H: Die Dünnschichtchromatographie von Thalidomid und seinen Hydrolyseprodukten. In: Microchimica Acta. Nr. 3, 1970, S. 530–5, doi:10.1007/BF01224156, PMID 5489943.
- Eriksson T, Björkman S, Roth B, Björk H, Höglund P: Hydroxylated metabolites of thalidomide: formation in-vitro and in-vivo in man. In: Journal of Pharmacy and Pharmacology. Band 50, Nr. 12, 1998, S. 1409–16, PMID 10052858.
- M. Reist, P. A. Carrupt, E. Francotte, B. Testa: Chiral inversion and hydrolysis of thalidomide: mechanisms and catalysis by bases and serum albumin, and chiral stability of teratogenic metabolites. In: Chemical Research in Toxicology. Band 11, Nr. 12, 1998, S. 1521–8, doi:10.1021/tx9801817, PMID 9860497.
- T. Eriksson, S. Björkman, B. Roth, A. Fyge, P. Höglund: Stereospecific determination, chiral inversion in vitro and pharmacokinetics in humans of the enantiomers of thalidomide. In: Chirality. Band 7, Nr. 1, 1995, S. 44–52, doi:10.1002/chir.530070109, PMID 7702998.
- Patent GB 768 821 (Chemie Grünenthal; 20. Februar 1957).
- W. Kunz u. a.: Arzneimittel-Forschung 6 (1956) 426–430.
- W. A. Silverman: The schizophrenic career of a „monster drug“. In Pediatrics. 110(2 Pt 1), Aug 2002, S. 404–406. PMID 12165600.
- L. Calabrese, A. B. Fleischer: Thalidomide: current and potential clinical applications. In: The American journal of medicine. Band 108, Nummer 6, April 2000, S. 487–495. PMID 10781782, (Review).
- Jeffrey M. Jacobson u. a.: Thalidomide for the treatment of oral aphthous ulcers in patients with human immunodeficiency virus infection. In: New England Journal of Medicine, Band 336, Nr. 21, 1997, S. 1487–1493, doi:10.1056/NEJM199705223362103.
- W. D. Figg, M. H. Hussain u. a.: A double-blind randomized crossover study of oral thalidomide versus placebo for androgen dependent prostate cancer treated with intermittent androgen ablation. In: The Journal of Urology. 181, 2009, S. 1104–1113. doi:10.1016/j.juro.2008.11.026. PMID 19167733. PMC 2838198 (freier Volltext).
- Vgl. S. Hallberg: Vom Horrormittel zum Hoffnungsträger: Comeback des Conterganwirkstoffs Thalidomid.
- S. Singhal, J. Mehta u. a.: Antitumor activity of thalidomide in refractory multiple myeloma. In: The New England Journal of Medicine. Band 341, Nummer 21, November 1999, S. 1565–1571, doi:10.1056/NEJM199911183412102. PMID 10564685.
- T. Hideshima, D. Chauhan u. a.: Thalidomide and its analogs overcome drug resistance of human multiple myeloma cells to conventional therapy. In: Blood. Band 96, Nummer 9, November 2000, S. 2943–2950. PMID 11049970.
- Anhang: Thalidomide Celgene 50 mg Hartkapseln 6. Mai 2008 (PDF, englisch; 516 kB).
- Vanessa Piechotta, Tina Jakob, Peter Langer, Ina Monsef, Christof Scheid: Multiple drug combinations of bortezomib, lenalidomide, and thalidomide for first-line treatment in adults with transplant-ineligible multiple myeloma: a network meta-analysis. In: Cochrane Database of Systematic Reviews. 25. November 2019, doi:10.1002/14651858.CD013487.
- Marzia Lazzerini, Stefano Martelossi u. a.: Effect of Thalidomide on Clinical Remission in Children and Adolescents With Refractory Crohn Disease. In: Journal of the American Medical Association. 310, 2013, S. 2164, doi:10.1001/jama.2013.280777.
- David M. Vail, Douglas H. Thamm, Julias M. Liptak: Withrow and MacEwen's Small Animal Clinical Oncology,, (Sixth Edition). ISBN 978-0-323-59496-7, S. 264ff
- J. P. Bray, G. Orbell, N. Cave, J. S. Munday: Does thalidomide prolong survival in dogs with splenic haemangiosarcoma? In: J Small Anim Pract. Band 59, Nr. 2, 2018, S. 85–91, doi:10.1111/jsap.12796 (wiley.com [abgerufen am 17. Dezember 2021]).
- BfArM: Ergebnisprotokoll der 66. Routinesitzung am 27. April 2010 Abgerufen am 17. Dezember 2021.
- Pressemitteilung von Celgene Inc. (Memento vom 11. Juli 2012 im Webarchiv archive.today).
- Bundesinstitut für Arzneimittel und Medizinprodukte: Bekanntmachung zur Arzneimittelverschreibungsverordnung vom 17. Juni 2011, BAnz, S. 99 vom 6. Juli 2011, S. 2415.
- Arzneimittelverschreibungsverordnung (AMVV) § 3a.
- Hubert Giess: ARZNEIMITTEL: Comeback für Contergan. In: Focus Online. 2. Mai 1994, abgerufen am 10. Oktober 2015.