Pomalidomid
Pomalidomid (Handelsname Pomalyst; Imnovid; Hersteller Celgene) ist ein Arzneistoff aus der Gruppe der Immunmodulatoren und wird in Kombination mit niedrig dosiertem Dexamethason bei der Behandlung des Multiplen Myeloms eingesetzt. Es wird bei Patienten angewendet, die auf Lenalidomid und Bortezomib nicht mehr ansprechen. Es führte in Studien zu einer signifikanten Verlängerung der Lebenszeit der Patienten im Vergleich zu den Kontrollgruppen.[5][6] Pomalidomid ist ein Thalidomid-Derivat.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| 1:1-Gemisch aus (R)-Isomer (oben) und (S)-Isomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Pomalidomid | |||||||||||||||||||||
| Andere Namen |
(RS)-4-Amino-2-(2,6-dioxopiperidin-3-yl)-2,3-dihydro-1H-isoindol-1,3-dion | |||||||||||||||||||||
| Summenformel | C13H11N3O4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L04AX06 | |||||||||||||||||||||
| Wirkstoffklasse |
Immunmodulator/antineoplastisch | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 273,248 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
10,75 ± 0,40[1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Zulassungsstatus
Die Erteilung des Erstpatents erfolgte in den USA im Jahre 1997 an die Firma Celgene. Die Patentnummer lautet US 5635517.[1] In der EU ist Pomalidomid seit August 2013 zugelassen und wird unter dem Handelsnamen Imnovid vermarktet.[7]
Synthese
Die Synthese von Pomalidomid beginnt mit der intramolekularen Bildung eines Imids aus Carbobenzyloxy-L-Glutamin. Dabei reagiert die Carbonsäuregruppe zunächst mit Thionylchlorid zum Carbonsäurechlorid. Diese Reaktion wird durch DMF katalysiert. Anschließend findet der Ringschluss zwischen dem Amid und dem Säurechlorid statt. Während dieser Reaktionsfolge fungiert die Carbobenzyloxygruppe als Schutzgruppe. Tetrahydrofuran ist das Lösungsmittel.[8]
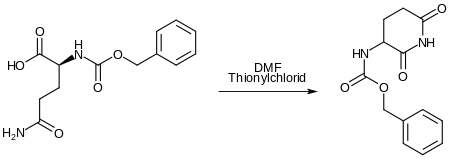
Die Abspaltung der Schutzgruppe erfolgt durch reduktive Hydrierung. Es entsteht 3-Aminopiperidin-2,6-dion.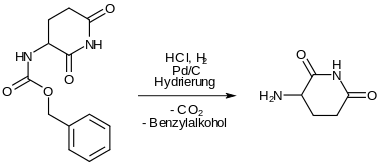
Nach Zugabe von 3-Nitrophthalsäureanhydrid entsteht unter Erhitzen ein Nitro-substituiertes Thalidomid-Analog.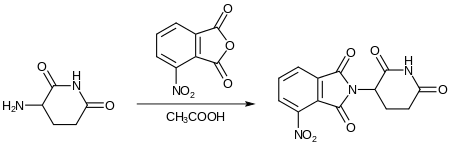
Dieses wird durch Reduktion der Nitrogruppe zu Pomalidomid reduziert.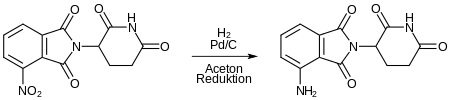
Analytik
Quantitative Reaktivitätsanalytik
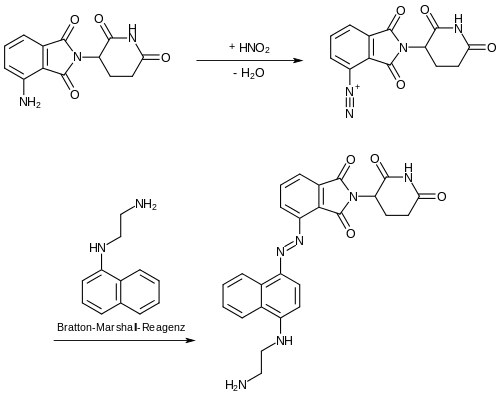
Pomalidomid weist als Strukturelement ein Derivat des Anilins auf. Der Stickstoff von primären aromatischen Aminen der Anilin-Derivate kann quantitativ über das Verfahren der Diazotitration erfasst werden.[9]
Der Glutarimidrest besitzt eine schwach NH-acide Bindung, so dass Pomalidomid mittels argontoacidimetrischer Titration analysiert werden kann. Hierbei wird das während der Titration gebildete Anion als schwerlösliches Silbersalz gefällt und die freigesetzten Protonen mit Pyridin abgefangen. Die so entstandenen Pyridinium-Ionen können anschließend als Kationensäure mit Natronlauge titriert werden.[10] Eine quantitative Bestimmung der schwachen Säure ist auch durch wasserfreie Titration möglich. Dafür kann als starke Base Tetrabutylammoniumhydroxid (TBAH) in Dimethylformamid (DMF) eingesetzt werden.[11]
Qualitative Reaktivitätsanalytik
Anilinderivate können nach Diazotierung mit N-(1-Naphthyl)ethylendiamin (Bratton-Marshall-Reagenz) oder 2-Naphthol kuppeln.[12]
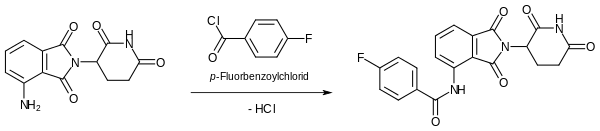
Die Umsetzung mit p-Fluorbenzoylchlorid ergibt ein N-Benzoyl-Derivat mit charakteristischem Schmelzpunkt.[13]
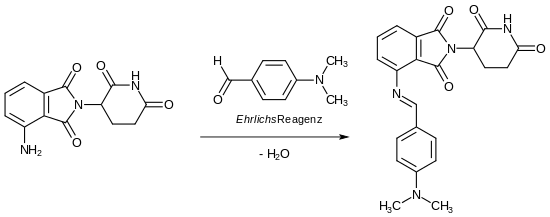
Primäre aromatische Amine reagieren mit Ehrlich-Reagenz zur Schiffschen Base.[14]
Klinische Angaben
Anwendungsgebiete (Indikationen)
Pomalidomid ist in Kombination mit Dexamethason indiziert für die Behandlung des rezidivierten und refraktären multiplen Myeloms bei erwachsenen Patienten, die mindestens zwei vorausgegangene Therapien, darunter Lenalidomid und Bortezomib, erhalten haben und unter der letzten Therapie eine Progression gezeigt haben.[15]
Gegenanzeigen (Kontraindikationen) / Toxikologie
Pomalidomid hat sich sowohl bei Ratten als auch bei Kaninchen als teratogen erwiesen, wenn es in der Phase der wesentlichen Organogenese angewendet wird. Beim Menschen ist eine teratogene Wirkung bei Einnahme während der Schwangerschaft zu erwarten. Während der Schwangerschaft und Stillzeit ist Pomalidomid absolut kontraindiziert.[16] Frauen im gebärfähigen Alter müssen darauf achten, dass sie unter der Behandlung mit Pomalidomid nicht schwanger werden. Dies gilt ab vier Wochen vor dem geplanten Therapiebeginn bis vier Wochen nach Abschluss der Therapie und auch in Therapieunterbrechungen. In diesem Zeitraum müssen sich Frauen verpflichten, zwei Methoden zur Schwangerschaftsverhütung anzuwenden. Es eignen sich jedoch nicht alle Verhütungsmethoden. So ist eine Östrogen-Gestagen-Kombination aufgrund der bereits erhöhten Thrombosegefahr nicht zu empfehlen. Zu Beginn der Therapie wird wöchentlich ein Schwangerschaftstest gemacht. Anschließend erfolgt bei regelmäßigem Menstruationszyklus eine monatliche Schwangerschaftskontrolle. Im Falle eines unregelmäßigen Menstruationszyklus erfolgt die Kontrolle alle zwei Wochen. Bei Ausbleiben der Periode oder bei Auftreten von Zwischenblutungen muss sofort ein Schwangerschaftstest durchgeführt werden und ein Arzt konsultiert werden. Sollte es trotz aller Vorsichtsmaßnahmen zu einer Schwangerschaft kommen, ist die Therapie umgehend abzubrechen und ärztlicher Rat einzuholen.[17]
Unerwünschte Wirkungen (Nebenwirkungen)
Zu den häufigsten Nebenwirkungen zählen laut klinischen Studien Erkrankungen des Blutes und des Lymphsystems, darunter Anämie (45,7 %), Neutropenie (45,3 %) und Thrombozytopenie (27 %), außerdem allgemeine Beschwerden am Verabreichungsort, darunter Fatigue (28,3 %), Pyrexie (21 %) und periphere Ödeme (13 %). Ebenfalls häufig kommen Infektionen und parasitäre Erkrankungen, einschließlich Pneumonie, vor (10,7 %). Bei 12,3 % der Patienten wurden periphere Neuropathien festgestellt und bei 3,3 % der Patienten traten venöse embolische oder thrombotische Ereignisse (VTE) ein. Zu den am häufigsten berichteten Nebenwirkungen vom Schweregrad 3 oder 4 gehören Neutropenie (41,7 %), Anämie (27 %), Thrombozytopenie (20,7 %) und Infektionen oder parasitäre Erkrankungen einschließlich Pneumonie (9 %).
Die Nebenwirkungen treten laut Studien tendenziell häufiger in den ersten beiden Behandlungszyklen mit Pomalidomid auf.[16]
Am 29. April 2015 hat der Hersteller in einem Rote-Hand-Brief bekanntgegeben, dass der Einsatz von Pomalidomid zu schweren Leberschäden, interstitiellen Lungenerkrankungen sowie Herzinsuffizienz führen kann.[18]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Pomalidomid wirkt durch eine Vielzahl von Mechanismen. So können entartete Zellen durch die Hemmung des Zellzyklus nicht weiter proliferieren. Dies geschieht über eine Aktivierung von p21WAF-1. Zudem führt Caspase 8-Aktivierung und Regulierung von Tumorsuppressor- und Onkogenen zur Apoptose der Myelomzellen. Außerdem wird die Angiogenese gehemmt. Im Rahmen der immunmodulatorischen Wirkung von Pomalidomid werden T-Zellen costimuliert und NK-Zellen stimuliert. Die Bildung von proinflammatorischen Zytokinen wie TNF-α und IL-6 wird gehemmt. Darüber hinaus werden weitere Wirkungen von Pomalidomid vermutet, die jedoch noch nicht abschließend erforscht sind.[6][19]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Pomalidomid wird schnell und gut oral absorbiert.
| Cmax | Tmax | Halbwertszeit | Plasmaproteinbindung | Verteilungsvolumen | Urin-Clearance | AUC0 |
|---|---|---|---|---|---|---|
| 13 ng/mL (2 mg, oral) | 3 h | 6,5–8 h | 12–44 % | 62–138 L | renal 73 % | 189 ng·h/mL |
Der Metabolismus von Pomalidomid erfolgt überwiegend über Hydrolyse des Glutarimid-Rings, Hydroxylierung (CYP3A4 und CYP1A2) des Phthalimid-Rings in 5-Position und anschließende Glucuronidierung. Hauptmetabolit ist das 5-Hydroxy-Glucuronid-Pomalidomid. Die Ausscheidung erfolgt zu 73 % renal und zu 15 % fäkal.[20]
Versuche haben gezeigt, dass die enantiomerenreine Form des Pomalidomids beim Menschen eine schnelle Isomerisierung zur Folge hat, so dass im Körper ein racemisches Gemisch mit gleichen Teilen der (R)- und (S)-Form vorliegt.[21]
Einzelnachweise
- SciFinder. Abgerufen am 6. Juli 2014.
- Patent: WO2013/126326 A1, CELGENE CORPORATION; COHEN, Benjamin, M.; LI, Ying; XU, Jean; LEONG, William, W.; MAN, Hon-wah; 2013.
- Produktinformation Pomalidomide (Memento vom 3. Juni 2015 im Internet Archive) bei selleckchem.com, abgerufen am 16. Juli 2014.
- Datenblatt Pomalidomide, ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 25. September 2014 (PDF).
- Myelodysplastische Syndrome (MDS) und multiples Myelom (MM). In: Wiener klinisches Magazin. 16, 2013, S. 30–31, doi:10.1007/s00740-013-0176-6.
- Pomalidomid (Imnovid ®) beim multiplen Myelom neu zugelassen. (PDF; 513 kB) In: Onkologie (International Journal for Cancer Research and Treatment), Vol. 35, No. 10, Oktober 2013; abgerufen am 5. Juli 2014.
- Nicola Siegmund-Schultze: Multiples Myelom: Pomalidomid ist eine neue Option beim Rezidiv. In: Deutsches Ärzteblatt. Band 110, Nr. 50, 13. Dezember 2013, S. A-2428 / B-2139 / C-2061.
- G. W. Muller, R. Chen, S. Y. Huang, L. G. Corral, L. M. Wong, R. T. Patterson, Y. Chen, G. Kaplan, D. I. Stirling: Amino-substituted thalidomide analogs: potent inhibitors of TNF-alpha production. In: Bioorganic & medicinal chemistry letters. Band 9, Nummer 11, Juni 1999, S. 1625–1630, PMID 10386948.
- Eberhard Ehlers: Analytik II. Kurzlehrbuch quantitative und instrumentelle Analytik. Stuttgart 2008, S. 218, 223–224.
- Eberhard Ehlers: Analytik II. Kurzlehrbuch quantitative und instrumentelle Analytik. Stuttgart 2008, S. 218, 123–124.
- Eberhard Ehlers: Analytik II. Kurzlehrbuch quantitative und instrumentelle Analytik. Stuttgart 2008, S. 218, 141–142.
- A. Calvin Bratton, E. K. Marshall, Jr. and with the technical assistance of Dorothea Babbitt and Alma R. Hendrickson: A new coupling component of sulfanilamide determination. In: The Journal of Biological Chemistry. 128, Mai 1939, S. 537–550.
- Michael J. Robarge, Roger Shen-Chu Chen, George W. Muller, Hon-Wah Man: Isoindole-imide compounds, compositions, and uses thereof. Patent: US2003/45552 A1, 2003.
- N. M. Ibrahim, K. J. Hamad, S. H. Al-Joroshi: Synthesis and characterization of some Schiff bases. In: Asian Journal of Chemistry. 18, Nr. 3, 2006, S. 2404–2406.
- Fachinfo Imnovid. November 2015.
- Rote-Hand-Brief zu Imnovid. (PDF) Abgerufen am 6. Juli 2014.
- Medication Guide Pomalyst®. (PDF; 109 kB) fda.gov. Abgerufen am 24. Juli 2014.
- Pomalidomid (Imnovid®): Neue wichtige Sicherheitshinweise zur Minimierung des Risikos einer schwerwiegenden Hepatotoxizität, interstitiellen Lungenerkrankung und Herzinsuffizienz. (PDF) Celgene GmbH, 29. April 2015, abgerufen am 30. April 2015.
- Assessment report Pomalidomide Celgene (PDF; 1,7 MB) European Medicines Agency.
- Hoffmann M, Kasserra C, Reyes J, Schafer P, Kosek J, Capone L, Parton A, Kim-Kang H, Surapaneni S, Kumar G.: Absorption, metabolism and excretion of [14C]pomalidomide in humans following oral administration. In: Cancer Chemotherapy and Pharmacology. 72, Nr. 2, Februar 2013, S. 489–591. doi:10.1007/s00280-012-2040-6. PMID 23203815.
- Yan Li, Simon Zhou, Matthew Hoffmann, Gondi Kumar, Maria Palmisano: Modeling and Simulation to Probe the Pharmacokinetic Disposition of Pomalidomide R- and S-Enantiomers. In: Journal of Pharmacology and Experimental Therapeutics. 350, S. 265–272. doi:10.1124/jpet.114.215251. PMID 24833703.