Barbiturate
Barbiturate sind Salze und Derivate der Barbitursäure. Im pharmazeutischen Sinne sind sie Barbitursäureabkömmlinge mit einer nennenswerten Wirkung an GABAA-Rezeptoren und damit Angehörige der Gruppe der GABAergika. In der Regel haben sie eine dämpfende Wirkung auf das Zentralnervensystem.
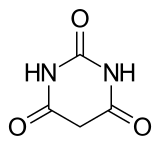
Barbiturate waren ab dem frühen 20. Jahrhundert für viele Jahrzehnte der Inbegriff des Schlafmittels. Aufgrund unerwünschter Nebenwirkungen sind sie in Deutschland und der Schweiz seit 1992 als Schlafmittel nicht mehr zugelassen und in der modernen psychopharmakologischen Verschreibungspraxis vor allem durch Benzodiazepine, Z-Drugs und Neuroleptika verdrängt worden. Von wenigen Ausnahmen abgesehen, unterliegen sie in Deutschland der Betäubungsmittel-Verschreibungsverordnung (BtMVV). Thiopental und Methohexital stehen als Kurzzeit-Injektionsnarkotika zur Verfügung. Barbital dient in der Biochemie als Puffer in Form des Veronal-Acetat-Puffers.
Barbitursäure (Malonylharnstoff) wurde erstmals 1864 von Adolf von Baeyer hergestellt.[1] Das erste Barbiturat mit schlafanstoßender Wirkung, Barbital, wurde 1902 von Emil Fischer synthetisiert[2] und als Veronal bekannt. Als Mononarkotika und Einschlafmittel bei Kombinationsnarkosen fanden N-alkylierte und Thiobarbiturate dann größte Verbreitung.[3] Mehr als 2500 Derivate sind heute bekannt. Nicht-GABAerge Barbiturate werden in ihrer Wirkung auf Enzyme[4][5] und in ihren antioxidativen Eigenschaften[6] erforscht.
Wirkmechanismus
Der Wirkungsmechanismus ist noch nicht in allen Einzelheiten geklärt. Erkannt wurde eine Wirkung an ionotropen Rezeptoren. Die Interaktion vollzieht sich im membranären Rezeptorabschnitt an den Schnittstellen (Interfaces)[A 1] der Untereinheiten.
An GABAA-Rezeptoren vom synaptischen Typ αβγ entfalten Barbiturate ähnliche Wirkungen wie Etomidat und Propofol. Es gibt Hinweise, dass sie die Etomidat-homologe Bindungsstelle an γ+β−[A 2] besetzen und dort als allosterische Co-Agonisten wirken.[7] Sie verlängern die Dauer der durch den Neurotransmitter GABA bewirkten Öffnung des Kanals, vergrößern moderat dessen Lumen und erhöhen damit den Anioneneinstrom in die Zelle. Charakteristisch ist die Linksverschiebung der GABA-Dosis-Wirkungs-Kurve und die gleichzeitige moderate Erhöhung der GABA-Effizienz (Emax).[8] Stärke und Richtung der Modulation hängen ab von den Substituenten in Molekülstellung 5. In der Regel und in therapeutisch erwünschter Weise erhöhen sie die Funktion des Rezeptors. Dem gegenüber sind Barbiturate bekannt, welche die GABAA-Rezeptorfunktion hemmen und z. B. Konvulsionen bewirken.[9] Dieser Effekt, der in der Regel dem R(+)-Isomer innewohnt, ist bemerkbar bei sterisch sperrigeren und konformationell starreren Substituenten, z. B. Phenyl. Bei (ehemals) arzneilich genutzten Razematen schlägt eine derartige anti-GABAerge Wirkung nicht durch, es überwiegt die pro-GABAerge Wirkung.
An Nikotinrezeptoren vom Typ Torpedo α2βγδ wirken Barbiturate am γ+α−-Interface.[10]
In subanästhetischer Dosierung hemmen Barbiturate den exzitatorischen (erregenden) glutamatergen AMPA-Rezeptor, in anästhetischen Dosen hemmen sie zudem bestimmte (tetrodotoxinempfindliche) spannungsabhängige Natriumkanäle.[11]
Pharmakokinetik
Die Natur der Substituenten prägt die Pharmakokinetik der Verbindungen, indem sie den Grad der Lipophilie bestimmt. Innerhalb gewisser Grenzen wird die Lipophilie begünstigt durch den Einbezug eines Aromaten, eine hohe Anzahl an Kohlenstoffatomen in den Seitenketten und den Ersatz eines Carbonyl-Sauerstoffatoms gegen Schwefel. Je lipophiler das Derivat ist, desto effizienter überquert es die Blut-Hirn-Schranke, desto schneller ist sein Wirkungseintritt, und desto kürzer wirkt es insgesamt, weil es sich schneller umverteilt (verschiedene Kompartimente). Ein mehr lipophiles Derivat wird mehr hepatisch metabolisiert, ein mehr hydrophiles wird eher unverändert renal ausgeschieden.[11] Die Metabolisierungsrate ist stereoselektiv.
Wirkungen
Aus der Affinität zu verschiedenen Rezeptortypen ergibt sich auch ein breites Wirkspektrum. Sie wirken dosisabhängig, von sedierend über hypnotisch (Schlaf) bis zu narkotisch. Daneben wirken sie auch antikonvulsiv (gegen Epilepsie) und hyperalgetisch (schmerzfördernd).[11]
Nebenwirkungen
- In hypnotischer Dosierung („Schlafmittel“)
- Morgendlicher Hangover, paradoxe Erregung (vor allem bei Kindern und Senioren; eine Hemmung kann in Form einer Hemmung der Hemmung unter Umständen auch erregend wirken), allergische Reaktion, Gefahr der Porphyrie mit akutem Anfall. Die durch Barbiturate in den ersten Nächten der Einnahme verlängerte Gesamtschlafdauer wird durch Toleranzentwicklung binnen kurzer Zeit – meist 8 bis 10 Tagen – wieder auf den Ausgangswert und sogar darunter reduziert. Darüber hinaus von Bedeutung ist das hohe Abhängigkeitspotential mit schwieriger, im Extremfall lebensgefährlicher Entzugssymptomatik beim Absetzen, vergleichbar mit Alkohol (siehe alkoholinduzierter Delirium tremens).
- In narkotischer Dosierung
- Atemdepression und Abnahme des Herzzeitvolumens.[11]
Eines der größten Probleme bei der Therapie mit Barbituraten ist die Tatsache, dass sie eine sehr geringe therapeutische Breite besitzen, das heißt, es kann leicht überdosiert werden. Dabei besteht die Gefahr einer zentralen Atemlähmung (siehe Intoxikation). Eine versehentliche paravenöse oder arterielle Injektion von stark basischen Barbituratsalzen kann Gewebsschäden verursachen.
Indikation
Da die meisten Präparate aus dem Verkauf genommen wurden, werden im Wesentlichen nur noch drei medizinisch verwendet:
- Das langwirksame (10 bis 18 Stunden) Phenobarbital wird als Antikonvulsivum 2. und 3. Wahl in der Behandlung der Epilepsie eingesetzt.[11][12] Es kann als funktioneller Antagonist bei konvulsiv wirkenden Substanzen wie DDT, Strychnin, Aminophenazon, Pentetrazol und Bemegrid eingesetzt werden, jedoch nicht bei der Tetanusintoxikation.
- Die kurzwirksamen (10 bis 14 Minuten) Barbiturate Thiopental und Methohexital sind als intravenöse Anästhetika zur Narkoseeinleitung zugelassen,[11] wurden jedoch von der barbituratfreien Substanz Propofol weitgehend verdrängt.[13]
Im Vergleich zu Benzodiazepinen wirken Barbiturate nicht nur schlafanstoßend, sondern, in höherer Dosierung, schlaferzwingend, so dass sie in sehr seltenen Ausnahmesituationen im zulassungsüberschreitenden Einsatz bei ansonsten nicht beherrschbaren Schlafstörungen eingesetzt werden können. Barbiturate wurden in den meisten Anwendungsbereichen von den Benzodiazepinen verdrängt.
Anwendung außerhalb der Humanmedizin
Schnell wirksame Barbiturate werden in den Vereinigten Staaten in Kombination mit anderen Wirkstoffen auch zur Hinrichtung mittels Injektion verwendet. Im Rahmen der Sterbehilfe in der Schweiz wird beispielsweise Pentobarbital von den Sterbehilfeorganisationen EXIT und Dignitas verwendet. In der Tiermedizin wird es zum Einschläfern von Tieren verwendet.
Wechselwirkungen
Barbiturate induzieren bei chronischer Anwendung Cytochrom-p450-3A-Enzyme in der Leber und beschleunigen dadurch ihren eigenen Abbau – was zu vermehrter Toleranzentwicklung führt – sowie jenen einiger weiterer Medikamente und schwächt somit deren Wirkung ab. Dazu gehören u. a. orale Gerinnungshemmer vom Cumarin-Typ, orale Kontrazeptiva (Anti-Baby-Pille), verschiedene andere Antiepileptika, Glucocorticoide, u. v. m.[14]
Daneben interagieren Barbiturate natürlich mit allen anderen sedierenden und atemdepressiven Medikamenten wie Alkohol, Benzodiazepinen, Opiaten u. a. Valproinsäure und Monoaminooxidase-Hemmer jeglicher Art verstärken die Barbituratwirkung.[11]
Intoxikation
- Akute Vergiftung
- Zuerst stellen sich Bewusstseinsstörungen bis zum tiefen Koma ein. Kritisch ist die zentrale Atemlähmung, welche mittelfristig zur Sauerstoffunterversorgung des Gehirns führt. Sie ist entscheidend für die Letalität der Barbituratvergiftung.
- Therapie der Vergiftung
- An erster Stelle steht die Sicherstellung einer ausreichenden Sauerstoffversorgung. Der Patient muss gegebenenfalls beatmet werden. Bei Kreislaufstillstand ist die Herz-Lungen-Wiederbelebung durchzuführen.
Die Eliminierung wird durch Alkalisierung des Blutes mit Natriumhydrogencarbonat gefördert. Bei langwirkenden Barbituraten ist die forcierte Diurese empfehlenswert.[15] Darüber hinaus können verschiedene Maßnahmen getroffen werden, das Gift aus dem Körper zu entfernen: Magenspülung unter Intubationsschutz, Aktivkohle, osmotische Laxantien, Dialyse bei voraussichtlich langer Narkose.[11]
Die Suizidgefahr war ein großes Problem bei der Therapie mit Barbituraten. Ende der 1960er Jahre starben in Großbritannien durchschnittlich 3 Menschen im Jahr durch einen Suizid mit dem Schlafmittel. Dies war auch ein Grund für den großen Erfolg der weniger toxischen Benzodiazepine.[16]
Herstellung
Barbiturate lassen sich aus (di)substituierten Malonsäureestern durch Kondensation mit Harnstoff oder Dicyandiamid synthetisieren. Bei Verwendung von Thioharnstoff werden analog Thiobarbiturate erhalten.[17]
Vertreter
Den GABAergen Barbituraten ist gemein, dass sie am fünften Ringatom des Barbitursäurerings mit organischen Resten zweifach substituiert sind (R1, R2). Das Sauerstoffatom am zweiten Ringglied ist bei Thio-Barbituraten durch Schwefel ersetzt.
| Name | Struktur | R1 | R2 | |
|---|---|---|---|---|
| Barbitursäure1) | Barbiturate | 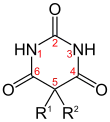 | –H | –H |
| Allobarbital | –CH2–CH=CH2 | –CH2–CH=CH2 | ||
| Amobarbital | –C2H5 | –(CH2)2–CH(CH3)2 | ||
| Barbital | –C2H5 | –C2H5 | ||
| Butabarbital | –C2H5 | –CH(CH3)–C2H5 | ||
| Butalbital | –CH2–CH=CH2 | –CH2–CH(CH3)2 | ||
| Cyclobarbital | –C2H5 | –C6H9 (Cyclohexenyl-1) | ||
| Heptabarbital | –C2H5 | –C7H11 (Cycloheptenyl-1) | ||
| Methohexital1) | ||||
| Pentobarbital | –C2H5 | –CH(CH3)–C3H7 | ||
| Phenobarbital1)2) | –C2H5 | –C6H5 (Phenyl) | ||
| Secobarbital | –CH2–CH=CH2 | –CH(CH3)–C3H7 | ||
| Vinylbital | –CH=CH2 | –CH(CH3)–C3H7 | ||
| Thialbarbital | Thio-Barbiturate | 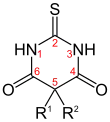 | –CH2–CH=CH2 | –C6H9 (Cyclohexenyl-1) |
| Thiobarbital | –C2H5 | –C2H5 | ||
| Thiopental1) | –C2H5 | –CH(CH3)–C3H7 |
1) Noch als Arzneistoff im Handel
2) Das reine R(+)-Isomer wirkt prokonvulsiv. Siehe Distomer.
Weitere Derivate sind nicht mehr als Medikament erhältlich: Aprobarbital, Alphenal, Barbexaclon, Brallobarbital, Butobarbital, Butallylonal, Crotylbarbital, Cyclopal, Ethallobarbital, Hexethal, Hexobarbital, Mephobarbital, Metharbital, Methylphenobarbital, Narcobarbital, Probarbital, Propallylonal, Proxibarbal, Proxibarbital, Reposal, Secbutabarbital, Talbutal, Thiamylal, Thiobutabarbital und Vinbarbital.
Chemischer Nachweis
Mittels Zwikker-Reaktion werden mit jenen Barbituraten, die am Stickstoff nicht substituiert sind, farbige Komplexe gebildet. Zur Analyse angewendet werden des Weiteren chromatographische Methoden (Dünnschicht- und Gaschromatographie), Massenspektrometrie und Radioimmunassays.[17]
Weblinks
- Barbiturate. In: Erowid. (englisch)
Anmerkungen
- Dies sind Kontaktflächen, an denen sich die Untereinheiten eines Kanals gegenüberstehen.
- Die genetisch unterschiedlichen Untereinheiten wurden mit griechische Buchstaben bezeichnet. Um Schnittstellen unterscheiden zu können, werden die sich gegenüberliegenden Seiten der Untereinheiten nach folgendem Ordnungsprinzip mit Plus und Minus gekennzeichnet. In der Draufsicht vom Extrazelluärraum wird eine Seite einer jeden Untereinheit mit Plus gekennzeichnet, die zweite Seite im Uhrzeigersinn mit Minus.
Einzelnachweise
- Adolf Baeyer: Untersuchungen über die Harnsäuregruppe. In: Justus Liebigs Annalen der Chemie, Bd. 131, Nr. 3, 1864, S. 291–302. doi:10.1002/jlac.18641310306
- E. Fischer, Josef von Mering: Über eine neue Klasse von Schlafmitteln. In: Therapie der Gegenwart. Band 44, 1903, S. 97–101.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 16.
- A. M. Qureshi, S. Mumtaz, A. Rauf, M. Ashraf, R. Nasar, Z. H. Chohan: New barbiturates and thiobarbiturates as potential enzyme inhibitors. In: J Enzyme Inhib Med Chem. Band 30, Nr. 1, 2015, S. 119–125, doi:10.3109/14756366.2014.895717, PMID 24666295.
- J. Figueiredo, J. L. Serrano, E. Cavalheiro, L. Keurulainen, J. Yli-Kauhaluoma, V. M. Moreira, S. Ferreira, F. C. Domingues, S. Silvestre, P. Almeida: Trisubstituted barbiturates and thiobarbiturates: Synthesis and biological evaluation as xanthine oxidase inhibitors, antioxidants, antibacterial and anti-proliferative agents. In: Eur J Med Chem. Band 143, 2018, S. 829–842, doi:10.1016/j.ejmech.2017.11.070, PMID 29223098.
- K. M. Moon, B. Lee, J. W. Jeong, D. H. Kim, Y. J. Park, H. R. Kim, J. Y. Park, M. J. Kim, H. J. An, E. K. Lee, Y. M. Ha, E. Im, P. Chun, J. Y. Ma, W. K. Cho, H. R. Moon, H. Y. Chung: Thio-barbiturate-derived compounds are novel antioxidants to prevent LPS-induced inflammation in the liver. In: Oncotarget. Band 8, Nr. 53, 2017, S. 91662–91673, doi:10.18632/oncotarget.21714, PMID 29207675, PMC 5710955 (freier Volltext).
- S. S. Jayakar, X. Zhou, P. Y. Savechenkov, D. C. Chiara, R. Desai, K. S. Bruzik, K. W. Miller, J. B. Cohen: Positive and Negative Allosteric Modulation of an α1β3γ2 γ-Aminobutyric Acid Type A (GABAA) Receptor by Binding to a Site in the Transmembrane Domain at the γ+-β- Interface. In: J. Biol. Chem. Band 290, Nr. 38, 2015, S. 23432–23446, doi:10.1074/jbc.M115.672006, PMID 26229099, PMC 4645599 (freier Volltext).
- A. M. Ziemba, S. A. Forman: Correction for Inhibition Leads to an Allosteric Co-Agonist Model for Pentobarbital Modulation and Activation of α1β3γ2L GABAA Receptors. In: PLoS ONE. Band 11, Nr. 4, 2016, Artikel e0154031, doi:10.1371/journal.pone.0154031, PMID 27110714, PMC 4844112 (freier Volltext).
- R. Desai, P. Y. Savechenkov, D. Zolkowska, R. L. Ge, M. A. Rogawski, K. S. Bruzik, S. A. Forman, D. E. Raines, K. W. Miller: Contrasting actions of a convulsant barbiturate and its anticonvulsant enantiomer on the α1 β3 γ2L GABAA receptor account for their in vivo effects. In: J. Physiol. (Lond.). Band 593, Nr. 22, 2015, S. 4943–4961, doi:10.1113/JP270971, PMID 26378885, PMC 4650410 (freier Volltext).
- A. K. Hamouda, D. S. Stewart, D. C. Chiara, P. Y. Savechenkov, K. S. Bruzik, J. B. Cohen: Identifying barbiturate binding sites in a nicotinic acetylcholine receptor with [3H]allyl m-trifluoromethyldiazirine mephobarbital, a photoreactive barbiturate. In: Mol. Pharmacol. Band 85, Nr. 5, 2014, S. 735–746, doi:10.1124/mol.113.090985, PMID 24563544, PMC 3990015 (freier Volltext).
- T. Karow, R. Lang-Roth: Allgemeine und spezielle Pharmakologie und Toxikologie. Auflage 19. 2011, S. 967–970.
- C. Gleixner, M. Müller, S. Wirth u. a.: Neurologie und Psychiatrie für Studium und Praxis. 2011, ISBN 978-3-929851-57-1, S. 51.
- Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Bd. 45, 1996, S. 881–883, hier: S. 883.
- siehe: P450 Drug Interaction Table. iupui.edu, abgerufen am 4. Juli 2012.
- Gudrun Späth: Vergiftungen und akute Arzneimittelüberdosierungen. 1982.
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4, S. 24.
- Eintrag zu Barbiturate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. April 2011.