Lenalidomid
Lenalidomid (Handelsname: Revlimid, Hersteller: Celgene) ist ein Arzneistoff aus der Gruppe der Immunmodulatoren. Es ist strukturell mit dem Thalidomid und Pomalidomid verwandt und wird wie diese zur Behandlung des multiplen Myeloms, der myelodysplastischen Syndrome (MDS) und des Mantelzelllymphoms eingesetzt.[3] Lenalidomid wurde vom Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur als Arzneimittel für seltene Leiden (Orphan-Arzneimittel) ausgewiesen und als solches im Gemeinschaftsregister der Europäischen Union eingetragen.[4][5]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
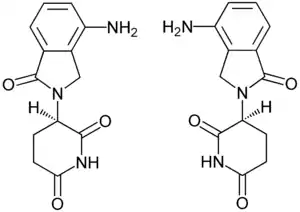 | ||||||||||||||||||||||
| 1:1-Gemisch aus (R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Lenalidomid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H13N3O3 | |||||||||||||||||||||
| Kurzbeschreibung |
fast weißes bis blass-gelbes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L04AX04 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 259,26 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
269–271 °C[2] | |||||||||||||||||||||
| Löslichkeit |
in organischen Lösungsmitteln besser löslich, zeigt jedoch die beste Löslichkeit in 0,1 N HCl-Pufferlösung[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendungsgebiete / Zulassungsstatus
Lenalidomid wird eingesetzt in der Behandlung von erwachsenen Patienten mit unbehandeltem multiplem Myelom, die nicht transplantierbar sind.[6]
Lenalidomid ist in den USA, der Europäischen Union, der Schweiz, in Argentinien und Kanada für eine Kombinationstherapie mit Dexamethason bei Patienten mit einem multiplen Myelom zugelassen, die bereits eine Standardtherapie erhalten haben. Darüber hinaus ist Lenalidomid in Verbindung mit Dexamethason in Australien zur Behandlung von Patienten mit multiplem Myelom zugelassen, deren Krankheit sich nach einer Therapie verschlimmerte.[7][3][8][9]
Im New England Journal of Medicine (NEJM) wurden im Mai 2012 die Ergebnisse dreier Phase-III-Studien zu Lenalidomid an Probanden mit neu diagnostiziertem multiplen Myelom veröffentlicht.[10][11][12]
Im Jahr 2019 haben Piechotta et al. eine Cochrane-Übersichtsarbeit durchgeführt, um zu evaluieren, inwieweit Lenalidomid zur Behandlung des multiplen Myeloms mit anderen Medikamenten verglichen werden kann. Dies wurde mit der alleinigen Therapie mit Melphalan und Prednison verglichen. Es ergaben sich die folgenden Ergebnisse: Lenalidomid plus Dexamethason und die fortlaufende Gabe von Bortezomib plus Lenalidomid plus Dexamethason verursachen wahrscheinlich eine Erhöhung des Gesamtüberlebens. Lenalidomid plus Dexamethason und die fortlaufende Gabe von Bortezomib plus Lenalidomid plus Dexamethason verursachen vielleicht eine starke Verlängerung des progressionsfreien Überlebens. Die Gabe von Lenalidomid plus Dexamethason verursacht eventuell eine Verringerung von Polyneuropathien. Die andere Kombination wurde hier nicht evaluiert. Lenalidomid plus Dexamethason und die fortlaufende Gabe von Bortezomib plus Lenalidomid plus Dexamethason verursachen eine ausgeprägte Erhöhung des Abbruchs der Studie seitens der Patienten wegen unerwünschten Ereignissen.[13]
Lenalidomid ist indiziert für die Behandlung von Patienten mit transfusionsabhängiger Anämie infolge myelodysplastischer Syndrome mit Niedrig- oder Intermediär-1-Risiko in Verbindung mit einer isolierten Deletion 5q als zytogenetische Anomalie, wenn andere Behandlungsoptionen nicht ausreichend oder nicht angemessen sind.[6]
In verschiedenen Studien wird zurzeit überprüft, inwieweit Lenalidomid zur Erhaltungstherapie bzw. Therapie der Chronisch Lymphatischen Leukämie (CLL) eingesetzt werden kann.[14] Die ORIGIN-Studie (geplante Laufzeit bis 2018) für die Prüfung von Sicherheit und Wirksamkeit von Lenalidomid als Erstlinientherapie der CLL wurde aufgrund von einer erhöhten Sterblichkeitsrate von der US-amerikanischen Food and Drug Administration (FDA) abgebrochen. Die FDA fordert deswegen auch Ärzte dazu auf, Lenalidomid nicht im Off-Label-Use bei CLL zu verschreiben.[15]
Wirkungsmechanismus
Lenalidomid gehört wie auch Thalidomid und Pomalidomid zu einer Gruppe peroral bioverfügbarer immunmodulierender Substanzen (engl. immunmodulatory drugs), die das Pharmaunternehmen Celgene unter der Marke IMiDs eingetragen hat. Seine Wirkung beruht auf verschiedenen Mechanismen:
- Hemmung der Proliferation bestimmter hämatopoetischer Tumorzellen
- Hemmung der Produktion entzündungsfördernder (proinflammatorischer) Zytokine, insbesondere TNF-α und Interleukin-6 und Interleukin-12
- Antiangiogenese (Verhinderung oder Minderung der Gefäßneubildung)
- Stimulation von T-Zellen und natürlichen Killerzellen (NK-Zellen) und in der Folge Verbesserung der durch diese Zellen vermittelte Immunität gegen Tumorzellen
- Erhöhung der natürlichen Killer-T-Zellen (NKT-Zellen)
- Steigerung der Blutbildung (Erythropoese)
Auf molekularer Ebene geht die Wirkung von Lenalidomid davon aus, dass es die Proteinkinase Casein-Kinase-1-Alpha (CK1α) zur Ubiquitinierung bringt, wodurch diese im Proteasom abgebaut wird. Die CK1α ist eine Serin-Threonin-Kinase, die TP53 negativ reguliert, das wiederum apoptotisch wirkt. Darüber aktiviert sie den onkogenen Wnt/β-Catenin-Signalweg. Das Gen für CK1α heißt CSNK1A1 und befindet sich auf Chromosom 5 im Abschnitt 5q. Dies erklärt, warum Lenalidomid bei einem myelodysplastischen Syndrom mit 5q-Deletion (del[5q]) und entsprechender Haploinsuffizienz sehr gut wirkt.[16]
Sicherheitsvorkehrungen und Anwendungsbeschränkungen
Bei der Anwendung von Lenalidomid müssen wichtige Aspekte beachtet werden. Weil Lenalidomid vermutlich auch beim Menschen fruchtschädigend wirkt, gehört ein Schwangerschaftsverhütungsprogramm für gebärfähige Frauen und deren Partner dazu. Eine mögliche Myelosuppression macht die wöchentlichen Blutbildkontrollen in den ersten acht Behandlungswochen erforderlich. Weiterhin zu beachten sind das erhöhte Risiko venöser Thromboembolien mit dem möglichen Einsatz einer antithrombotischen Prophylaxe und die Dosisreduktion bei Niereninsuffizienz. In Deutschland ist die Abgabe lenalidomidhaltiger Arzneimittel durch den § 3a Arzneimittelverschreibungsverordnung reguliert und unterliegt der amtlichen Überwachung, deshalb muss der Arzt für die Verordnung das so genannte T-Rezept verwenden. Der Arzt muss versichern, die Sicherheitsmaßnahmen gemäß der aktuellen Fachinformation einzuhalten, insbesondere auch, erforderlichenfalls ein Schwangerschafts-Präventionsprogramm durchzuführen. Ferner muss er auf der Verschreibung vermerken, ob die Behandlung innerhalb oder außerhalb (Off-Label-Use) der jeweils zugelassenen Anwendungsgebiete erfolgt.[17]
Im Dezember 2012 verschickte der Hersteller Celgene eine Mitteilung an Angehörige der Heilberufe (Rote-Hand-Brief) zum Risiko des Auftretens von Lebererkrankungen in Zusammenhang mit der Anwendung von Lenalidomid bei Vorliegen von anderen Risikofaktoren.[18]
Nebenwirkungen
Als häufigste Nebenwirkungen werden Abnahme der weißen Blutkörperchen (Neutropenie), der Blutplättchen (Thrombozytopenie) und der roten Blutkörperchen (Anämie), Müdigkeit, Kraftlosigkeit, Übelkeit, Verstopfung, Durchfall, Muskelkrämpfe, Schwellungen in Armen und Beinen und Hautausschlag beobachtet.
Chemische Eigenschaften
Lenalidomid ist chiral und kann daher in den optisch aktiven enantiomeren Formen (S)-(−) und (R)-(+) vorliegen, pharmazeutisch verwendet wird das Racemat [1:1-Gemisch von (S)-(−)-Form und (R)-(+)-Form]. Lenalidomid ist in 0,1 N Salzsäure gut löslich.
Handelsnamen
Revlimid (EU, CH, USA)
Einzelnachweise
- FDA Drug Details Revlimid (Lenalidomide)
- Sicherheitsdatenblatt 3-(4-Amino-1-oxo-1,3-dihydro-2H-isoindol-2-yl)piperidine-2,6-dione (PDF; 30 kB) bei Matrix Scientific, abgerufen am 30. August 2017.
- Zusammenfassung des EPAR für die Öffentlichkeit. (PDF; 188 kB) Europäische Arzneimittelagentur (deutsch).
- Orphan Designation (EU/3/03/177) by the European Commission (englisch).
- Orphan Designation (EU/3/07/494) by the European Commission (englisch).
- Fachinformation Revlimid. September 2016.
- Produktinformation der Europäischen Arzneimittelagentur (englisch).
- Meletios Dimopoulos et al.: Lenalidomide plus Dexamethasone for Relapsed or Refractory Multiple Myeloma. In: N Engl J Med. Nr. 357, 2007, S. 2123–2132, doi:10.1056/NEJMoa070594 (freier Volltext).
- Donna M. Weber et al.: Lenalidomide plus Dexamethasone for Relapsed Multiple Myeloma in North America. In: N Engl J Med. Nr. 357, 2007, S. 2133–2142, doi:10.1056/NEJMoa070596 (freier Volltext).
- Antonio Palumbo et al.: Continuous Lenalidomide Treatment for Newly Diagnosed Multiple Myeloma. In: N Engl J Med. Nr. 366, 2012, S. 1759–1769, doi:10.1056/NEJMoa1112704 (freier Volltext).
- Philip L. McCarthy et al.: Lenalidomide after Stem-Cell Transplantation for Multiple Myeloma. In: N Engl J Med. Nr. 366, 2012, S. 1770–1781, doi:10.1056/NEJMoa1114083 (freier Volltext).
- Attal, Michel et al.: Lenalidomide Maintenance after Stem-Cell Transplantation for Multiple Myeloma. In: N Engl J Med. Nr. 366, 2012, S. 1782–1791, doi:10.1056/NEJMoa1114138 (freier Volltext).
- Vanessa Piechotta, Tina Jakob, Peter Langer, Ina Monsef, Christof Scheid: Multiple drug combinations of bortezomib, lenalidomide, and thalidomide for first-line treatment in adults with transplant-ineligible multiple myeloma: a network meta-analysis. In: Cochrane Database of Systematic Reviews. 25. November 2019, doi:10.1002/14651858.CD013487 (wiley.com [abgerufen am 16. Juli 2020]).
- Studien Klinik I für Innere Medizin, Uniklinik Köln. (Memento vom 10. Dezember 2012 im Internet Archive; PDF; 67 kB).
- FDA Statement: FDA halts clinical trial of drug Revlimid (lenalidomide) for chronic lymphocytic leukemia due to safety concerns.
- Benjamin L. Ebert, Jan Krönke: Inhibition of Casein Kinase 1 Alpha in acute myeloid leukemia. New England Journal of Medicine 2018, Band 279, Ausgabe 19 vom 8. November 2018, Seiten 1873–1874, [DOI:10.1056/NEJMcibr1811318].
- Rote Hand Info von Celgene Juni 2008, akdae.de (PDF; 1,5 MB).
- Rote Hand Brief von Celgene im Dezember 2012. Abgerufen am 10. Dezember 2012.