Phthalsäureanhydrid
Phthalsäureanhydrid (nach IUPAC-Nomenklatur: 2-Benzofuran-1,3-dion, abgekürzt auch PSA genannt) ist eine organisch-chemische Verbindung aus der Stoffgruppe der aromatischen Carbonsäureanhydride, genauer ist es das Anhydrid der Phthalsäure. Die Verbindung ist ein wichtiger Ausgangsstoff für die Herstellung von Kunstharzen, daneben auch von Farbstoffen oder Farbpigmenten. Außerdem zählt sie zu den Grundchemikalien und wird als Zwischenprodukt in der Chemischen Industrie eingesetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
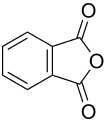 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phthalsäureanhydrid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H4O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis weißliche Kristallnadeln mit aromatischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 148,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,53 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
285 °C[2] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 1 mg·m−3[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Industrielle Synthese
Die großtechnische Herstellung von Phthalsäureanhydrid erfolgt heute durch die katalytische Oxidation von o-Xylol mit Luftsauerstoff in der Gasphase bei Temperaturen von 375–410 °C. Als Katalysatoren werden Gemische von Vanadiumpentoxid (V2O5) und Titandioxid (TiO2), welche auf Keramikringe geträgert sind und teilweise Promotoren enthalten können, eingesetzt.[6][3]
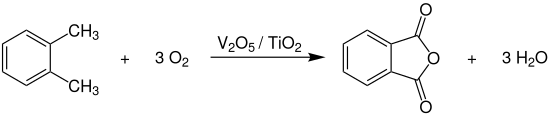
Die komplette Reaktion wird dabei in Rohrbündelreaktoren, bei denen die beträchtliche Reaktionswärme (ΔHR= –1110 kJ·mol−1) mithilfe von Salzschmelzen abgeführt und zur Erzeugung von überhitztem Hochdruckdampf genutzt wird, durchgeführt. Der Katalysator ist bei diesem Verfahren als Festbett angeordnet. Die Ausbeute an Phthalsäureanhydrid liegt bei 87 % und man erhält es nach zweistufiger Destillation in einer Reinheit von 99,8 %.[6][3]
Bis in die 1960er Jahre wurde Phthalsäureanhydrid nach dem Gibbs-Wohl-Verfahren durch Luftoxidation von Naphthalin, welches wiederum aus Steinkohlenteer gewonnen wurde, hergestellt.
Die Produktionskapazitäten für Phthalsäureanhydrid betrugen 2010 weltweit etwa 3,0 Millionen Jahrestonnen.[3]
Labormaßstab
Im Labor kann Phthalsäureanhydrid durch Erhitzen von Phthalsäure (C8H6O4) unter Wasserabspaltung hergestellt werden:[7]
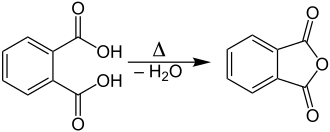
Bei geeigneten Bedingungen – vorzugsweise verringerter Druck – destilliert bzw. sublimiert das Phthalsäureanhydrid ab und kondensiert ohne das Wasser in einer Vorlage.
Eigenschaften
Physikalische Eigenschaften
Phthalsäureanhydrid hat eine relative Gasdichte von 5,11 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck). Außerdem löst es sich wenig in kaltem Wasser, Ethanol und Diethylether, dagegen gut in Estern, Ketonen, Halogenkohlenwasserstoffen und Benzol. Technisches oder in nicht vollkommen dicht schließenden Gefäßen gelagertes Phthalsäureanhydrid kann einen beträchtlichen Anteil an Phthalsäure enthalten, da das Anhydrid mit der Luftfeuchtigkeit langsam zur Säure umgesetzt wird. Dann muss es destilliert bzw. sublimiert werden, vorzugsweise bei verringertem Druck.
Chemische Eigenschaften
Phthalsäureanhydrid ist ein brennbarer, jedoch schwer entzündbarer Feststoff aus der Stoffgruppe der Carbonsäureanhydride. Bei Kontakt mit Oxidationsmitteln, Salpetersäure, Glycerin (Hitze), Kupferoxid (Hitze), Luft (Phthalsäureanhydridstaub), Natriumnitrit (Wärme) können explosionsartige Reaktionen eintreten. Mit starken Basen, Alkoholen in Verbindung mit Wärme, Metallen sowie mit heißem Wasser können gefährliche chemische Reaktionen eintreten.[2]
Verwendung
Phthalsäureanhydrid ist ein großindustrielles Massenprodukt, welches zahlreiche Anwendungen findet. Hauptsächlich wird es als Ausgangsstoff für die Herstellung von Weichmachern in Form von Phthalsäureester für Kunststoffe (insbesondere PVC) verwendet. Des Weiteren ist es ein wichtiges Zwischenprodukt bei der Herstellung von Estern, Alkydharzen, Polyesterharzen, Polyimiden, Phthalocyaninfarbstoffe sowie Heterocyclen. Außerdem dient es als Feinchemikalie und Vorstufe für funktionalisierte Aromaten, Anthrachinone, Anthrachinonfarbstoffe, Indanthren-Farbstoffe, Xanthenfarbstoffe, Phenolphthalein und Phthalimide. Ebenso wird aus Phthalsäureanhydrid Isatosäureanhydrid und Saccharin hergestellt. Ferner wird es als Vernetzer für Epoxidharze, in Drucktinten, Lacken, photographischen Materialien, lithographischen Druckplatten, Treibstoffadditiven und Beschichtungsmaterialien eingesetzt. In geringen Mengen wird es auch zur Modifikation von Polymeren, Holz und Cellulose verwendet.[3]
Sicherheitshinweise
Der Staub von Phthalsäureanhydrid kann mit Luft bei feiner Verteilung und in Anwesenheit einer Zündquelle explosive Gemische bilden. Hauptsächlich wird Phthalsäureanhydrid über den Atemtrakt aufgenommen. Außerdem wurde eine Resorptionsmöglichkeit über den Verdauungstrakt belegt. Bei Aufnahme oder Exposition kommt es akut zu Reiz- bis Ätzwirkung auf Augen, Atemwege und die Haut. Des Weiteren tritt eine sensibilisierende Wirkung (bevorzugt inhalativ) sowie allergische Sofortreaktionen ein. Chronische kann es zu allergischen Atemwegserkrankungen wie Rhinitis oder Asthma bronchiale kommen. In mikrobiologischen Tests konnte eine Mutagenität ausgeschlossen werden. Zur Reproduktionstoxizität und Kanzerogenität liegen derzeit keine ausreichenden Angaben vor. Phthalsäureanhydrid weist eine untere Explosionsgrenze (UEG) von 1,7 Vol.‑% (100 g/m3) und eine obere Explosionsgrenze (OEG) von 10,5 Vol.‑% (650 g/m3) auf. Der untere Explosionspunkt liegt bei 136 °C. Die Zündtemperatur beträgt 580 °C. Mit einem Flammpunkt von 152 °C gilt Phthalsäureanhydrid als schwer entzündbar.[2]
Einzelnachweise
- Eintrag zu PHTHALIC ANHYDRIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Eintrag zu Phthalsäureanhydrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Juli 2019. (JavaScript erforderlich)
- Eintrag zu Phthalsäureanhydrid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Juli 2019.
- Eintrag zu Phthalic anhydride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 22. Juli 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 85-44-9 bzw. Phthalsäureanhydrid), abgerufen am 5. Oktober 2019.
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 605.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 441, ISBN 3-342-00280-8.


