Silbertrifluormethansulfonat
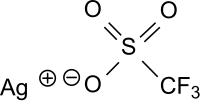
Silbertrifluormethansulfonat (Silbertriflat, AgOTf) ist das Silbersalz der Trifluormethansulfonsäure mit der Formel CF3SO3–Ag+, das in Wasser, aber auch in unpolaren Lösungsmitteln, wie z. B. in Benzol löslich ist. Silbertriflat ist ein vielseitiges Reagens und ein Katalysator für Acylierungen,[8] Cyclisierungen[9] oder Friedel-Crafts-Acylierungen und Friedel-Crafts-Alkylierungen.[5]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Silbertrifluormethansulfonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CAgF3O3S | |||||||||||||||
| Kurzbeschreibung |
Weißes bis leicht blass-gelbes Kristallpulver[1] bzw. beige kristalline Substanz[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 256,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser, Aceton, Ethanol und Diethylether, löslich in vielen organischen Lösungsmitteln, wie z. B. Acetonitril, aber auch in Benzol[7] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen und Darstellung
Eine frühe Darstellungsroute geht aus vom Bariumsalz der Trifluormethansulfonsäure (TfOH), aus dem mit verdünnter Schwefelsäure die freie TfOH entsteht, die anschließend mit Silbercarbonat Ag2CO3 neutralisiert wird.[7][6]
Das Silbertriflat wird dabei in einer Ausbeute von 95 % erhalten und kann zur Reinigung aus Benzol/Tetrachlormethan oder Ether/Tetrachlormethan umkristallisiert werden.
In einer von George Whitesides verbesserten Variante wird verdünnte TfOH mit Silber(I)-oxid Ag2O zur Reaktion gebracht, die AgOTf in 98%iger Ausbeute erzeugt.[9]
Eigenschaften
Silbertrifluormethansulfonat ist ein weißer bis beiger, kristalliner, geruchloser, lichtempfindlicher und hygroskopischer Feststoff, der in Wasser und vielen organischen Lösungsmitteln löslich ist.[7]
Anwendungen
Aktivierung von Alkylhalogeniden und Grignard-Verbindungen mit Silbertriflat
Aus Silbertrifluormethansulfonat und Methyliodid ist das Methylierungsagens Methyltrifluormethylsulfonat (Methyltriflat, MeOTf) in 69%iger Ausbeute zugänglich.[6][10]
Silbertriflat reagiert mit primären Grignard-Verbindungen oder Lithiumorganylen unter milden Bedingungen und mit guten Ausbeuten unter C-C-Verknüpfung. Die Reaktion lässt sich bei Verwendung von α,ω-Di-Grignard-Verbindungen – ausgehend z. B. von cis-1,2-Bis(chlormethyl)cyclohexan – zur Darstellung carbocyclischer Vier-, Fünf- oder Sechsringe einsetzen.[9]
octan.svg.png.webp)
Die Ablösung von Halogenidionen aus Alkylhalogeniden wird von Silbertriflat katalysiert, was z. B. zur Reaktion von gem-Dibromalkanen mit Grignard-Verbindungen unter Allylierung bzw. Benzylierung genutzt werden kann.[11]

Bromierungs-, Friedel-Crafts- und Sulfonierungsreaktionen mit Silbertriflat
In den 1970er Jahren erschloss der Arbeitskreis von Franz Effenberger mehrere unterschiedliche Anwendungen für Silbertrifluormethansulfonat.
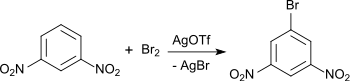
Silbertriflat katalysiert unter Bildung von Trifluormethylsulfonylbromid CF3SO2OBr mit Brom die Bromierung von elektronenarmen Aromaten, wie z. B. 1,3-Dinitrobenzol in konzentrierter Schwefelsäure zum 1-Brom-3,5-dinitrobenzol in 71%iger Ausbeute.[12]
Mit aromatischen Carbonsäurehalogeniden reagiert Silbertrifluormethansulfonat zu den gemischten Anhydriden, die ohne zusätzlichen Katalysator mit Aromaten in einer Friedel-Crafts-Acylierung aromatische Ketone bilden.[13]
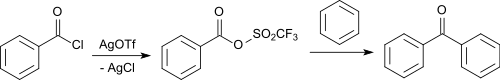
So entsteht mit Benzoylchlorid als Carbonsäurechlorid und Silbertriflat in 90%iger Ausbeute das gemischte Anhydrid, das mit Benzol in 90%iger Ausbeute Benzophenon bildet.
Mit Alkyl-Sulfonsäurebromiden und Silbertriflat sind analog die entsprechenden gemischten Alkyl-Sulfonsäureanhydride zugänglich.[14]
Aus Ethylsulfonylbromid Et-SO2Br (aus Ethylbromid, Magnesium und Schwefeldioxid[15]) entsteht bei Reaktion mit Silbertriflat das gemischte Sulfonsäureanhydrid in 83%iger Ausbeute, das ohne Katalysatorzusatz mit Benzol zum Ethylphenylsulfon reagiert.
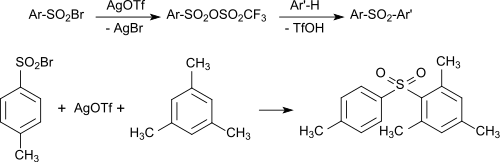
Die mit Silbertriflat und Aryl-Sulfonsäurebromiden gebildeten gemischten Aryl-Sulfonsäureanhydride können auch in einem Eintopfverfahren erzeugt und direkt mit Aromaten zu den entsprechenden Diaryl-Sulfonen umgesetzt werden.[16]
Veretherungen und Veresterungen mit Silbertriflat
In Gegenwart nicht-nukleophiler Aminbasen, wie z. B. 2,6-Di-tert-butylpyridin, reagieren auch empfindliche Alkohole mit Silbertriflat und primären Alkylhalogeniden zu den entsprechenden Alkylethern.[17]
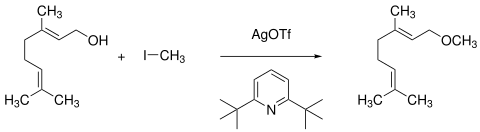
So wird aus dem Terpenalkohol Geraniol – vermutlich unter Bildung des Alkylierungsmittels Methyltrifluormethylsulfonat – mit dreifachem Überschuss der Reagentien Geraniolmethylether in 95%iger Ausbeute erhalten.
Silylierte Carbonsäuren können mit Silbertriflat und katalytischen Mengen der Lewis-Säure Titantetrachlorid mit silylierten Alkoholen in Gegenwart von 4-Trifluormethylbenzoesäureanhydrid in sehr hohen Ausbeuten zu den entsprechenden Estern umgesetzt werden.[18]
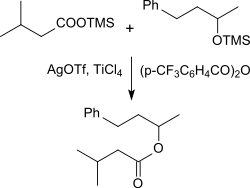
So bildet Trimethylsilyl-Isovaleriansäure mit Silbertriflat das gemischte Carbonsäure-Trifluormethansulfonsäure-Anhydrid, das mit silyliertem 4-Phenyl-2-butanol in 94%iger Ausbeute zum Ester reagiert.
Silbertriflat katalysiert bereits in 1 molprozentigem Zusatz – durch Reaktion mit Acetanhydrid und intermediärer Bildung des gemischten Anhydrids CH3CO-O-SO2CF3 – in glatter Reaktion (60 °C, 1–20 min Reaktionsdauer) die Bildung der entsprechenden Acetylierungsprodukte einer Reihe von Alkoholen, Thiolen, Phenolen und Aminen in praktisch quantitativen Ausbeuten (96–98 %).[8]

Lactonisierungen mit Silbertriflat
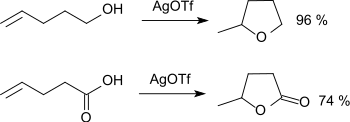
Die intramolekulare Addition von Hydroxygruppen und Carboxygruppen an Doppelbindungen unter Bildung von fünf-(γ-) und/oder sechs-(δ-)gliedrigen cyclischen Ethern bzw. Lactonen wird durch Silbertrifluormethansulfonat mit sehr hohen Ausbeuten katalysiert.[19]
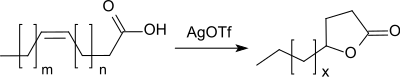
Selbst ungesättigte Fettsäuren können mit Silbertriflat bei 130–160 °C in brauchbaren Ausbeuten (51–71 %) unter Verschiebung der Doppelbindung und selektiver Bildung von Fünfring-(γ-)Lactonen intramolekular cyclisiert werden.[20]
Glycosylierungen mit Silbertriflat
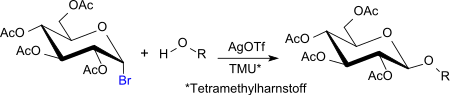
Eine Abwandlung der gängigen Koenigs-Knorr-Methode zum Aufbau von Disacchariden aus dem Glycosyldonor 2,3,4,6-Tetra-O-acetyl-α-D-glucopyranosylbromid (Acetobromglucose) verwendet als Promotor Silbertrifluormethansulfonat in äquimolaren Mengen und als Protonenakzeptor Tetramethylharnstoff.[21] Das Verfahren zeichnet sich durch vereinfachte Prozessführung, sowie hohe Anomerenreinheit und Ausbeuten der Produkte aus.
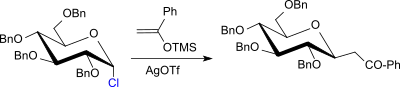
Mit Silylenolethern, wie z. B. 1-Phenyl-1-trimethylsiloxyethen (Acetophenonenol-trimethylsilylether), das einfach aus Acetophenon, Triethylamin, Chlortrimethylsilan und Natriumiodid in Acetonitril zugänglich ist,[22] reagieren Glycosylhalogenide, wie z. B. 2,3,4,6-Tetra-O-benzyl-α-D-glucopyranosylchlorid in hohen Ausbeuten zum entsprechenden β-Glucosid.[23]
Auch die von Richard R. Schmidt als vielseitige Glycosyldonoren beschriebenen O-Glycosyl-trichloracetimidate[24] lassen sich mittels Silbertriflat aktivieren.[25][26]
In Kombination mit Iodchlorid katalysiert Silbertrifluormethansulfonat die Glycosylierung von Thioglycosiden unter Bildung von O-Glycosiden in brauchbaren bis guten (46–82 %) Ausbeuten.[27]

Literatur
- T.H. Black: Handbook of Reagents for Organic Synthese: Reagents for Heteroarene Functionalization. Hrsg.: A.B. Charette. Wiley, 2015, ISBN 978-1-118-72659-4, S. 636–648.
Einzelnachweise
- Eintrag zu Silver Trifluoromethanesulfonate bei TCI Europe, abgerufen am 18. Februar 2017.
- Datenblatt Silver trifluoromethanesulfonate bei Sigma-Aldrich, abgerufen am 23. Oktober 2021 (PDF).
- Datenblatt Silbertrifluormethansulfonat zur Synthese (PDF) bei Merck, abgerufen am 18. Februar 2017.
- Datenblatt Silver trifluoromethane bei AlfaAesar, abgerufen am 18. Februar 2017 (PDF) (JavaScript erforderlich).
- T.H. Black, K.A. Stubbs, R.V. Stick, J.-M. Weibel, P. Pale, C.L. Ladd: Silver(I) Trifluoromethanesulfonate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2015, doi:10.1002/047084289X.rs032.pub4.
- T. Gramstadt, R.N. Haszeldine: 33. Perfluoroalkyl derivatives of sulphur. Part IV. Perfluoroalkanesulphonic acids. In: J. Chem. Soc. 1956, S. 173–180, doi:10.1039/JR9560000173.
- R.N. Haszeldine, J.M. Kidd: Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid. In: J. Chem. Soc. 1954, S. 4228–4232, doi:10.1039/JR9540004228.
- R. Das, D. Chakraborty: Silver triflate catalyzed acetylation of alcohols, thiols, phenols, and amines. In: Synthesis. 2011, S. 1621–1625, doi:10.1055/s-0030-1259999.
- G.M. Whitesides, F.D. Gutowski: Reaction of α, ω-di-Grignard reagents with silver(I) salts form carbocyclic rings. In: J. Org. Chem. Band 41, Nr. 17, 1976, S. 2882–2885, doi:10.1021/ja00879a019.
- T. Gramstadt, R.N. Hazeldine: 806. Perfluoroalkyl derivatives of sulphur. Part VII. Alkyl trifluoromethanesulphonates as alkylating agents, trifluoromethanesulphonic anhydride as a promoter for esterification, and some reactions of trifluoromethanesulphonic acid. In: J. Chem. Soc. 1957, S. 4069–4079, doi:10.1039/JR9570004069.
- Y. Mitamura, H. Someya, H. Yorimitsu, K. Oshima: Silver-catalyzed diallylation and dibenzylation of gem-dibromoalkanes with Grignard reagents. In: Synlett. 2010, S. 309–312, doi:10.1055/s-0029-1219168.
- K. Huthmacher, F. Effenberger: Neue reaktive Bromierungsreagentien. In: Synthesis. Band 9, 1978, S. 693–694, doi:10.1055/s-1978-24861.
- F. Effenberger, G. Epple: Trifluormethansulfonsäure-carbonsäure-anhydride, hochwirksame Acylierungsmittel. In: Angew. Chem. Band 84, Nr. 7, 1972, S. 294–295, doi:10.1002/ange.19720840710.
- F. Effenberger, K. Huthmacher: Darstellung und Reaktionen von Trifluormethansulfonsäure-sulfonsäure-anhydriden. In: Angew. Chem. Band 86, Nr. 11, 1974, S. 409–410, doi:10.1002/ange.1974086116.
- G. Geiseler, R. Kuschmiers: Die Schwingungsspektren der Methan- und Äthansulfohalogenide. In: Chem. Ber. Band 93, Nr. 9, 1960, S. 2014–2047, doi:10.1002/cber.19600930920.
- F. Effenberger, K. Huthmacher: Darstellung und Reaktionen von Arylsulfonsäure-trifluormethansulfonsäure-anhydriden. In: Chem. Ber. Band 109, Nr. 6, 1976, S. 2315–2326, doi:10.1002/cber.19761090636.
- R.M. Burk, T.S. Gac, M.B. Roof: A mild procedure for etherification of alcohols with primary alkyl halides in the presence of silver triflate. In: Tetrahedron Lett. Band 35, Nr. 44, 1994, S. 8111–8112, doi:10.1016/0040-4039(94)88256-8.
- T. Mukaiyama, I. Shiina, M. Miyashita: An efficient method for the preparation of carboxylic esters via mixed anhydride by the promotion of a catalytic amount of Lewis acid. In: Chem. Lett. Band 21, Nr. 4, 1992, S. 625–628, doi:10.1246/cl.1992.625.
- C.-G. Yang, N.W. Reich, Z. Shi, C. He: Intramolecular additions of alcohols and carboxylic acids to inert olefins catalyzed by silver(I) triflate. In: Org. Lett. Band 7, Nr. 21, 2005, S. 4553–4556, doi:10.1021/ol51065f.
- L.J. Gooßen, D.M. Ohlmann, D. Dierker: Silvertriflate-catylyzed synthesis of γ-lactones from fatty acids. In: Green Chem. Band 12, 2010, S. 197–200, doi:10.1039/B916853B.
- S. Hanessian, J. Banoub: Chemistry of the glycosidic linkage. An efficient synthesis of 1,2-trans-disaccharides. In: Carbohydr. Res. Band 53, Nr. 1, 1977, S. C13–C16, doi:10.1016/S0008-6215(00)85468-3.
- T. Mukaiyama, K. Narasaka: 3-Hydroxy-3-methyl-1-phenyl-1-butanone by crossed aldol reaction In: Organic Syntheses. 65, 1987, S. 2, doi:10.15227/orgsyn.065.0006; Coll. Vol. 8, 1993, S. 210 (PDF).
- P. Allevi, M. Anastasia, P. Ciuffreda, A. Fiecchi, A. Scala: C-Glucopyranosyl derivatives from readily available 2,3,4,6-tetra-O-benzyl-α-D-glucopyranosyl chloride. In: Chem. Commun. Nr. 2, 1987, S. 101–102, doi:10.1039/C39870000101.
- R.R. Schmidt: Neue Methoden zur Glycosid- und Oligosaccharidsynthese – gibt es Alternativen zur Koenigs-Knorr-Methode? In: Angew. Chem. Band 98, Nr. 3, 1986, S. 213–236, doi:10.1002/ange.19860980305.
- S.P. Douglas, D.M. Whitfield, J.J. Krepinsky: Silver trifluoromethanesulfonate (triflate) activation of trichloroacetimidates in glycosylation reactions. In: J. Carbohydr. Chem. Band 12, Nr. 1, 1993, S. 131–136, doi:10.1080/07328309308018547.
- G. Wei, G. Gu, Y. Du: Silver triflate. A mild alternative catalyst for glycosylation conditions using trichloroacetimidates as glycosyl donors. In: J. Carbohydr. Chem. Band 22, Nr. 6, 2003, S. 385–393, doi:10.1081/CAR-120025325.
- T. Ercegovic, A. Meijer, G. Magnusson, U. Ellervik: Iodine monochloride/silver trifluoromethanesulfonate (ICl/AgOTf) as a convenient promotor system for O-glycoside synthesis. In: Org. Lett. Band 3, Nr. 6, 2001, S. 913–915, doi:10.1021/ol015547c.
