Rüsselratte
Die Rüsselratte (Petrodromus tetradactylus), auch Vierzehen-Rüsselratte, ist eine Säugetierart aus der Ordnung der Rüsselspringer (Macroscelidea). Sie gehört zu den größeren Vertretern dieser Gruppe und ist wie andere Rüsselspringer auch durch einen großen Kopf mit einer typischen, rüsselartig verlängerten Nase sowie langen Hinter- und kurzen Vorderbeinen charakterisiert. Ein besonderes Merkmal stellen borstenartige Haare an der Schwanzunterseite dar, die manchmal ein knopf- oder knotenartiges Ende aufweisen und deren Funktion nicht vollständig geklärt ist. Insgesamt erscheint die Rüsselratte sehr variantenreich, was in zahlreichen Unterarten resultiert. Ihr Verbreitungsgebiet umfasst das zentrale, östliche und südöstliche Afrika. Dadurch gehören vorrangig Wälder, Flussauen und Buschlandschaften zu den bewohnten Landschaften. Die Hauptnahrung besteht aus Insekten, seltener werden auch Pflanzen verspeist. Die Tiere leben in monogamen Paaren, deren Nachwuchs aus einem oder zwei Jungen je Wurf besteht. Sie unterhalten Eigenreviere mit einem dichten Netz aus Pfaden und Wegen. Diese verbinden die einzelnen Aktivitätsgebiete und Unterschlupfmöglichkeiten. Die wissenschaftliche Ersterwähnung der Art erfolgte im Jahr 1846. Der Gesamtbestand der Rüsselratte gilt als ungefährdet.
| Rüsselratte | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Rüsselratte (Petrodromus tetradactylus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Petrodromus | ||||||||||||
| Peters, 1846 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Petrodromus tetradactylus | ||||||||||||
| Peters, 1846 |
Beschreibung
Habitus

Die Rüsselratte ist ein mittelgroßer Vertreter der Rüsselspringer und der größte aus der gemeinsamen Verwandtschaftsgruppe mit den Elefantenspitzmäusen (Elephantulus) und mit Macroscelides. Sie erreicht eine Gesamtlänge von 31,8 bis 38 cm, die Kopf-Rumpf-Länge beträgt 16,3 bis 21 cm, der Schwanz wird 14,7 bis 18,7 cm lang. Damit besitzt der Schwanz rund 85 % der Länge des restlichen Körpers. Das Gewicht beträgt 129 bis 280 g. Im Küstengebiet Ostafrikas konnte kein ausgesprochener Geschlechtsdimorphismus ausgemacht werden, weiter im Landesinnern und nach Süden hin sind Weibchen im Durchschnitt etwas größer als Männchen. So betrug das Gewicht der Männchen im Arabuko Sokoke Forest im östlichen Kenia durchschnittlich 198 g, das der Weibchen 208 g.[1] In KwaZulu-Natal in Südafrika wurde für Männchen ein mittleres Gewicht von 182 g, für Weibchen von 204 g ermittelt. Wie andere Rüsselspringer auch zeichnet sich die Rüsselratte durch einen großen Kopf mit rüsselartig verlängerter Nase und gegenüber den Hinterbeinen vergleichsweise kurzen Vorderbeinen aus. Das Fell ist äußerst weich, die Haare am Rücken sind länger als am Bauch. Die Farbe des Rückenfells erscheint variantenreich von rost- über sandfarben zu dunkelbraun bis hin zu grau. Bei einigen Vertretern kann ein undeutlicher, breiter sowie dunkler Streifen entlang der Mitte des Rückens ausgebildet sein. Die Körperseiten zeigen eine gelblichbraune über orangegraue bis hellgraue Färbung, teilweise ist ein grauer oder brauner Streifen vorhanden. Der Bauch kann bei manchen Weibchen eine ausgewaschen ockergraue Färbung besitzen, er ist ansonsten überwiegend weißlichgrau getönt, ebenso wie die Beine. Der nur spärlich behaarte Schwanz zeigt sich oberseits schwarz, unterseits aber heller. An der Basis tritt ein unbehaarter Hautfleck auf. Auffallend sind borstenartige Haare von bis zu 7 mm Länge, die das hintere Drittel der Schwanzunterseite bedecken und teilweise in eine knoten- oder knopfartige Verdickung enden.[2][3][4][5]
Der große Kopf besitzt eine moderat verlängerte Schnauze. Die Oberlippen, das Kinn und die Kehle sind weißlich gefärbt, vor den Augen weist die Schnauze einen rötlichbraunen Ton auf. Die großen Augen werden von einem deutlichen, hellen Augenring umrahmt, der an den Ohren erweitert ist. Unterhalb dieser Erweiterung tritt ein dunkler Fleck auf, der hier den Augenring teilweise unterbricht. Die Ohren stehen weit auseinander, sind breit und von rostfarbener bis gelblichbrauner Färbung, im Innern wachsen weiße Haare. Die Länge der Ohren beträgt 34 bis 39 mm. Die Oberseite der krallenbewehrten Füße ist gelblichbraun. Der Vorderfuß verfügt über fünf Zehen, der dritte und vierte Strahl sind am längsten ausgebildet, der zweite und fünfte stehen um Nagellänge zurück, während der innerste Zeh nur bis zu Basis des nächstäußeren (zweiten) reicht. Abweichend von den Elefantenspitzmäusen und Macroscelides sind am Hinterfuß nur vier Zehen ausgebildet, die Größe der Strahlen entspricht der des Vorderfußes mit der Ausnahme, dass der innerste Zeh vollständig reduziert ist.[6] Die Länge des Hinterfußes variiert von 51 bis 58 mm.[2][3][4] Ebenfalls abweichend von Macroscelides und Elephantulus besitzt das Weibchen der Rüsselratte nur zwei Zitzenpaare, je eins in der Brust- und eins in der Bauchgegend.[7][5]
Schädel- und Gebissmerkmale
Der Schädel erreicht eine Länge von 54,3 bis 58,5 mm, an den Jochbögen ist er 28,1 bis 30,5 mm breit. Er zeigt in der Aufsicht einen sehr schmalen Bau, in der Seitenansicht ist eine domartige Aufwölbung des hinteren Schädels sichtbar. Die Jochbögen sind gut entwickelt, ebenso die Paukenblase, die prominente Anteile am Keilbein und am Paukenteil aufweist. Sie ist aber nicht so aufgebläht wie bei Macroscelides. Der Scheitelkamm beschränkt sich auf die hintere Hälfte der Scheitelbeine. Das Tränenbein ist insgesamt sehr groß. Im Gaumenbein bestehen drei Paare von Öffnungen, die Anzahl und Größe entsprechen der bei den Elefantenspitzmäuse und den Macroscelides-Arten, weichen aber von den Rüsselhündchen (Rhynchocyon) ab. Allerdings fehlen im Unterschied zu den beiden erstgenannten größere Öffnungen zwischen den ersten hinteren Backenzähnen. Das Gebiss umfasst 40 Zähne und besitzt folgende Zahnformel: . Der erste Schneidezahn überragt die beiden äußeren um das Doppelte an Länge und hat eine eckzahnartige (caniniforme) Gestalt. Der äußere (dritte) Schneidezahn steht isoliert zu den vorderen und ist etwas größer als der zweite. Während der Eckzahn, der durch ein Diastema von den Schneidezähnen getrennt ist und rund 4 mm hoch wird, in seiner Form dem dritten Schneidezahn entspricht (incisiform), gleicht der erste Prämolar wiederum einem Eckzahn. Der dritte Prämolar ist den Molaren ähnlich (molariform). Die Länge der oberen Zahnreihe beträgt 28,1 bis 30,5 mm.[2][3][8][5]
Verbreitung
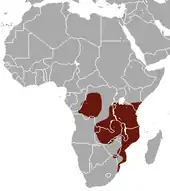
Die Rüsselratte lebt im zentralen, östlichen und südöstlichen Afrika. Ihr Verbreitungsgebiet erstreckt sich von der Demokratischen Republik Kongo über Uganda und Kenia sowie dem größten Teil Tansanias und Sambias bis nach Mosambik, dem südöstlichen Simbabwe, dem östlichsten Teil Angolas und dem nördlichen Südafrika. Außerdem ist sie auf den vorgelagerten Inseln Sansibar und möglicherweise Mafia[9] anzutreffen. Berichte von Sichtungen aus dem Caprivizipfel von Namibia konnten bisher nicht bestätigt werden. Das Vorkommen im Kongobecken ist räumlich getrennt vom restlichen Verbreitungsgebiet der Art. Die hauptsächlich bewohnten Landschaften setzen sich aus der Sambesi-Waldlandzone, den Küstenwäldern mit offenen Mosaiklandschaften und den südlichen Regenwald-Savannenlandschaften zusammen, deren Niederschlagsmenge wenigstens 700 mm jährlich beträgt. Eine Unterart bewohnt zudem die tropischen Regenwälder des Kongobeckens, dort scheint sie aber nicht nördlich des Kongos aufzutreten. Die Höhenverbreitung reicht vom Meeresspiegelniveau bis in Hochlandlagen um etwa 1400 m, in den Taita-Bergen im südöstlichen Kenia möglicherweise bis auf 2200 m.[10][4][5]
Die Habitate der Rüsselratte bestehen aus Uferwäldern und Wäldern mit dichtem Unterholz, teilweise auch aus Buschland. Die Art ist allgemein relativ häufig, die Populationsdichte variiert aber mit den einzelnen Habitaten und mit der Jahreszeit. In den Küstenwäldern im nordöstlichen Tansania wurde eine fast doppelt so häufige Anwesenheit der Rüsselratte während der Trockenzeit gegenüber der Regenzeit vermerkt.[11] Im Arabuko Sokoke Forest, einem rund 420 km² großen Küstenwald in Kenia südlich des Tana kommt sie überwiegend in Landschaften mit Cynometra-Vegetationsgemeinschaften vor, mit etwa der Hälfte an Nachweisen ist sie in Gebieten mit Afzelia-Beständen deutlich seltener, während sie in Brachystegia-Landschaften kaum beobachtet wurde. In den Afzelia-Pflanzenbeständen konnte eine Populationsdichte von etwa 2,1 Individuen je Hektar ausgemacht werden. in den küstennahen Wäldern Kenias tritt die Rüsselratte zudem sympatrisch mit dem Goldenen Rüsselhündchen (Rhynchocyon chrysopygus) auf, das ein ähnliches Habitat bewohnt. Allerdings nutzt die Rüsselratte dabei Regionen mit dichterer Untergrund- oder Gebüschvegetation.[1] Im Kongobecken teilt sich die Rüsselratte die Landschaftsräume mit dem Dunklen Rüsselhündchen (Rhynchocyon stuhlmanni), sie ist aber dort eher mit alten, ursprünglichen Landschaften assoziiert, wo zumeist Pfeilwurzgewächse oder Entandrophragma-Gewächse dominieren, zudem ist sie häufiger in Flussgebieten zu beobachten.[12] Im Tembe Elephant Park von KwaZulu-Natal im südlichsten Teil des Verbreitungsgebietes der Rüsselratte, wo Wälder auf Sandböden gedeihen, konnte allgemein nur eine sehr geringe Populationsdichte festgestellt werden.[13][4][14][5]
Lebensweise
Territorialverhalten

Die Rüsselratte ist polyzyklisch aktiv, zumeist aber während der Dämmerungszeit und tagsüber. Die Hauptaktivitäten finden morgens von 05.00 bis 10.00 Uhr und abends von 16.00 bis 20.00 Uhr, teilweise auch bis 22:00 Uhr statt, während der heißesten Phase des Tages ruht die Rüsselratte überwiegend. Die Zeiten der Aktivitäten werden manchmal durch kurze Ruhephasen unterbrochen, die aber nicht länger als 30 Minuten anhalten. Während dieser liegt ein Tier nicht seitlich und schließt selten die Augen vollständig, so dass es immer alarmiert ist.[15] Die Rüsselratte lebt bodenbewohnend und kann sich sehr schnell (cursorial) vierfüßig laufend und springend fortbewegen, wobei der Schwanz aufrecht gehalten wird. Ihre Lebensweise ist allerdings sehr versteckt, so dass sie teilweise nur über ihre Aktivitätsspuren in einer Region nachgewiesen werden kann.[10] Zum Komfortverhalten gehören unter anderem das „Gesichtwaschen“ mit den Vorderpfoten, Kratzen und ausgiebige Sandbäder.[1][16][4][5]
Die einzelnen Individuen unterhalten Aktionsräume. Diese besitzen laut Untersuchungen im kenianischen Arabuko Sokoke Forest bei Weibchen eine Ausdehnung von etwa 1,4 ha und sind damit nur wenig größer als die der Männchen mit 1,1 ha.[1] Ähnliche Werte ergaben Beobachtungen im Sodwana-Bay-Nationalpark im östlichen KwaZulu-Natal.[16] Im Tembe Elephant Park, ebenfalls KwaZulu-Natal, dagegen verfügen Männchen mit 1,2 ha über fast doppelt so große Gebieten wie Weibchen, deren Aktionsräume nur 0,7 ha umfassen.[13] Bei einigen Weibchen wurden hier aber auch deutlich größere Reviere festgestellt. Abhängig von der Dichte der Population einer Region können sich die angrenzenden Territorien von Geschlechtsgenossen teilweise überlappen, was aber zumeist weniger als ein Drittel der Fläche beansprucht. Innerhalb der Aktionsräume gibt es eine oder mehrere Kernzonen, die von den einzelnen Tieren benutzt werden. Diese können zwischen 2 und 11, im Durchschnitt 5 Unterschlupfmöglichkeiten enthalten, die aus Baumhöhlen, umgefallenen Stämmen oder dichter Vegetation, seltener aus Erdhöhlen anderer, grabender Tiere bestehen. Eigene Baue und spezielle Nester legt die Rüsselratte nicht an.[13] Die verschiedenen Aufenthaltsgebiete im Territorium sind durch ein dichtes Wegenetz miteinander verbunden. Die Wege und Pfade besitzen eine Breite von rund 10 cm und werden von der Rüsselratte mit fegenden Bewegungen der Vorderbeine angelegt. Manchmal bestehen sie auch nur aus einer Aneinanderreihung von gesäuberten Flecken von 10 bis 20 cm Durchmesser, die in einem Abstand von rund 30 cm zueinander liegen. Vor allem in dichter Untergrundvegetation können sie über eine längere Zeit Bestand haben, in etwas offenerem Gelände sind sie eher instabil und werden häufig in einem Zeitraum von wenigen Wochen durch neue ersetzt.[16] Sie dienen hauptsächlich der schnellen Fortbewegung oder der Flucht.[2][3][4][5]
Wie bei anderen Rüsselspringern auch lebt die Rüsselratte in monogamen Paarbeziehungen, die meist über das gesamte Leben anhalten. Bei den gebundenen Tieren überlappen sich die Territorien der einzelnen Partner teilweise oder vollständig. Das vollständige Überlappen der Reviere ist wahrscheinlich abhängig von der Dichte der Population in den bewohnten Region und tritt vor allem dann auf, wenn sie besonders hoch ist. Gemeinsame Aktivitäten der Partner finden außerhalb der Paarungszeit aber nur selten statt. In der Regel zieht sich jedes Tier in seinen eigenen Unterschlupf zurück, die Pfade innerhalb der Territorien werden von beiden Partnern genutzt, selten aber zur gleichen Zeit am gleichen Ort.[1][13] Bei Untersuchungen im Sodwana-Bay-Nationalpark konnte auch ein gewisses polygynes Verhalten beobachtet werden,[16] was aber darauf zurückgeführt wird, dass die Männchen ein subadultes Alter aufwiesen.[13] Ob die Rüsselratte wie einige andere Rüsselspringer auch territorial ist, lässt sich aus Beobachtungen in freier Wildbahn bisher nicht eindeutig belegen. Bei Tieren in Gefangenschaft konnte dies zwischen Geschlechtsgenossen aber aufgezeigt werden.[2][3][4][5]
Die innerartliche Kommunikation findet häufig über Duftmarken statt. Eventuell dienen auch die borstenartigen Haare an der Schwanzunterseite zum Verteilen derartiger Sekrete, da sich dort zahlreiche Drüsen befinden und die Tiere häufig mit seitlichen Bewegungen des Schwanzes über den Boden streifen (teilweise wurden die Borsten auch mit dem Aufspüren von Bodenvibrationen oder mit dem Anlegen der Pfade in Verbindung gebracht ebenso wie sie ursprünglich als Ergebnisse von Buschbränden angesehen wurden[17]). Lautäußerungen sind nur wenige bekannt. Sie reichen von einem Schnurren und Klicken zu einem Schreien bei Störungen. Charakteristisch ist das Fußtrommeln mit den Hinterbeinen auf dem Untergrund, das recht laut sein kann und über mehrere Meter zu hören ist.[2][3][4]
Ernährung
Die Nahrung der Rüsselratte besteht hauptsächlich aus Insekten, von denen sie überwiegend Ameisen, Termiten und Käfer verzehrt. Die bevorzugte Beute umfasst Tiere von 2 bis 5 mm Länge. Darüber hinaus gehören auch grüne Pflanzenteile, Früchte und Samen zum Speiseplan. Nach Untersuchungen von Mageninhalten im östlichen Küstenwaldgebiet von Kenia betrug der Anteil an pflanzlichem Material gut 4,6 %. Die Wirbellosen enthielten mit 22,5 % eine große Menge an Käfern, daneben kamen auch Tausendfüßer, Schaben und Grillen vor. Etwa 0,9 % bestand aus sonstigem Material wie Zweige, Haare, Federn und Steinchen. Im Arabuko-Sokoke-Nationalpark zeigte sich, dass die Rüsselratte vor allem während der Trockenzeit hauptsächlich Ameisen frisst. Dabei variiert auch die Größe der einzelnen Territorien mit der Anzahl an Ameisen, so dass sich bei einer hohen Ameisendichte die Ausdehnung der Aktionsräume verringert, wobei die Größenschwankungen bei 10 % liegen.[1] In Uganda ergaben Analysen von Magenresten zum größten Teil Ameisen.[18] Die Nahrung wird überwiegend durch Scharren mit den Hinterbeinen im Blätterabfall am Boden gesucht, zusätzlich auch über die mobile Nase und somit mit dem Geruchssinn. Je nach Erfolg der Nahrungssuche legt ein Tier zwischen 10 und 100 m, durchschnittlich 40 m in je halbe Stunde zurück.[16] Für die Nahrungsaufnahme wird die lange Zunge eingesetzt.[2][3][4] Die Rüsselratte trinkt regelmäßig Wasser, wobei sie die verlängerte Nase nach oben biegt.[18][5]
Die Körpertemperatur der Rüsselratte beträgt 33 bis 37,5 °C, sie liegt damit um durchschnittlich einen Grad niedriger als bei den Elefantenspitzmäusen. Dagegen deckt die Thermoneutralität der Rüsselratte im Vergleich zu den Elefantenspitzmäusen und der Arten der Gattung Macroscelides eine weite Spanne von 25 bis 34 °C ab, was die Bevorzugung mesischer bis feuchter Habitate widerspiegelt. Als Folge davon sind die Nieren nicht darauf ausgelegt, Urin anzureichern. Den dadurch bedingten starken Wasserverlust bei hohen Außentemperaturen begegnet die Rüsselratte mit dem Aufsuchen kühlerer Unterschlüpfe und mit Gefäßerweiterungen (Vasodilation). Ein Torpor bei kühlen Außentemperaturen, wie bei einigen Elefantenspitzmäusen bekannt, tritt nicht ein.[19][20][21]
Fortpflanzung
Über die Fortpflanzung der Rüsselratte liegen nur wenige Informationen vor. Möglicherweise bringen die Weibchen in äquatornahen Gebieten das ganze Jahr über Nachwuchs zur Welt, in weiter südlicheren Regionen könnte die Reproduktionsphase eingeschränkt sein. Im südlichen Afrika finden Geburten zumeist kurz vor dem Einsetzen oder während der Regenzeit statt, die von August bis Oktober anhält, trächtige Weibchen wurden im Januar, Juli und Oktober beobachtet. Im östlichen Afrika hingegen liegen für fast alle Monate Sichtungen von Jungtieren vor. Häufig wird nur ein Junges, teilweise auch zwei geboren, Untersuchungen in Sambia zufolge trägt jedes zweite Weibchen zwei Embryos, in Zimbabwe waren es zwei von drei Weibchen. Ein Neugeborenes wiegt im Durchschnitt 31,5 g und besitzt eine Kopf-Rumpf-Länge von rund 7,5 cm.[18] Es ist weit entwickelt mit voll ausgebildetem Fellkleid, geöffneten Augen und befähigt, innerhalb kürzester Zeit zu laufen (Nestflüchter). Die tägliche Gewichtszunahme beträgt etwa 2 g. Der Zeitpunkt der Entwöhnung und des Eintretens der Geschlechtsreife wurden bisher nicht dokumentiert, es dürfte aber wie bei anderen Rüsselspringern relativ früh sein.[2][3][4] Die Lebenserwartung in freier Wildbahn ist unbekannt, in Gefangenschaft wurden Tiere bis zu sechs Jahre und sieben Monate alt.[22][5]
Fressfeinde und Parasiten
Zu den natürlichen Fressfeinden zählen die Östliche Gabunviper, Greifvögel und Raubtiere, möglicherweise auch verwilderte Katzen. Vor diesen flüchtet die Rüsselratte in der Regel in Erd- oder Baumlöcher. Äußere Parasiten sind mit verschiedenen Vertretern von Zecken nachgewiesen, etwa Ixodes, Rhipicephalus und Haemaphysalis, die sich häufig am Ohr- und Schwanzansatz sammeln.[23] Darüber hinaus kommen mit Chimaeropsylla, Neolinognathus, Ctenocephalides und Echidnophaga auch mehrere Formen der Flöhe und zusätzlich einige Milben vor.[24] Daneben konnte auch eine Vielzahl innerer Parasiten festgestellt werden, darunter Kratzwürmer wie Cloeascaris, Subulura und Travasospirura und zusätzlich einige Blutparasiten, etwa Plasmodium und Trypanosoma.[2][4]
Systematik
Innere Systematik der Rüsselspringer nach Heritage et al. 2020[25]
|
Die Rüsselratte ist die einzige Art aus der demzufolge monotypischen Gattung Petrodromus. Sie gehört zur Ordnung der Rüsselspringer (Macroscelidea). Die Rüsselspringer stellen eine Gruppe kleinerer Säugetiere dar, die endemisch in Afrika verbreitet sind insgesamt sechs Gattungen und zwei Familien umfassen.[26] Eine der Familien, die Rhynchocyonidae, wird durch die Rüsselhündchen (Rhynchocyon) gebildet und ist somit ebenfalls monotypisch. Sie sind die größten Vertreter der Rüsselspringer und bewohnen überwiegend bewaldete Habitate. Die zweite Familie wird durch die Macroscelididae repräsentiert, zu der neben der Rüsselratte auch die Elefantenspitzmäuse (Elephantulus) sowie die Gattungen Macroscelides, Galegeeska und Petrosaltator zählen. Der überwiegende Teil der Vertreter der Macroscelididae ist an deutlich trockenere Offenlandschaften angepasst, lediglich die Rüsselratte kommt auch in Gebieten mit geschlossener Vegetation vor.[27][8] Die beiden Familien trennten sich laut molekulargenetischen Analysen bereits im Unteren Oligozän vor etwa 32,8 Millionen Jahren. Eine stärkere Diversifizierung der Macroscelididae setzte dann im Oberen Oligozän vor rund 28,5 Millionen Jahren ein. Petrodromus bildet gemeinsam mit Patrosaltator, Gelegeeska und Macroscelides die Unterfamilie der Macroscelidinae, Elephantulus hingegen steht alleinig in der Unterfamilie der Elephantulinae.[28][25]
Innere Systematik der Elefantenspitzmäuse nach Smit et al. 2011 (verkürzt) und die Position der Rüsselratte[28]
|
Die Stellung von Petrodromus innerhalb der heutigen Familie der Macroscelididae und die sich dadurch ergebende nahe Verwandtschaft zu Elephantulus und Macroscelides konnte durch die genetischen Analysen bestätigt werden. Als problematisch erwiesen sich aber die genaueren Beziehungen der einzelnen Vertreter zueinander. Generell ist die Rüsselratte nahe mit Macroscelides verwandt, darüber hinaus besteht eine weitaus engere Verbindung zur Nordafrikanischen Elefantenspitzmaus (Petrosaltator rozeti) und zur Somali-Elefantenspitzmaus (Galegeeska revoili); beide galten lange Zeit als zu den Elefantenspitzmäusen gehörig. Die enge Verwandtschaft der Rüsselratte vor allem zur Nordafrikanischen Elefantenspitzmaus findet neben den molekulargenetischen Hinweisen auch durch morphologische und anatomische Befunde eine Bestätigung. Unter anderem zeigt sich dies im ähnlichen Bau des Penis, der bei beiden Vertretern zwei seitlich ausgebildete Lappen nahe der Spitze besitzt,[29] oder im Auftreten von Milchdrüsen auch bei männlichen Tieren. Unterschiede liegen hier allerdings wiederum mit der Anzahl der Zitzenpaare vor, die bei Elephantulus und Macroscelides generell drei, bei Petrodromus dagegen nur zwei beträgt.[7] Die Rüsselratte besitzt darüber hinaus Ähnlichkeiten im Schädelbau, die sie wiederum mit der Nordafrikanischen Elefantenspitzmaus und den übrigen Elefantenspitzmäusen verbindet, während die Macroscelides-Arten durch die aufgewölbten Paukenblasen hier stärker abweichen.[30] In der Struktur des Basicraniums stimmen wiederum Macroscelides, Petrodromus und die Nordafrikanischen Elefantenspitzmaus stärker überein,[31] des Weiteren verfügen alle drei Vertreter über einen verknöcherten Nervenkanal am Innenohr.[32] Aufgrund der zahlreichen Indizien für eine nähere Verwandtschaft von Petrodromus mit Elephantulus rozeti, wie die ursprüngliche Bezeichnung der Nordafrikanischen Elefantenspitzmaus lautete, und Macroscelides wurden die drei Taxa vorläufig in einer gemeinsamen Panelephantulus clade vereint.[31][32] Daraus ergab sich aber eine tiefe Einbettung von Petrodromus und Macroscelides in die Gattung Elephantulus, wodurch wiederum letztere paraphyletisch wurde.[28][33] Eine als notwendig erachtete Neubewertung der gesamten Verwandtschaftsgruppe hielt zwei Möglichkeiten bereit: die Zusammenführung der Nordafrikanischen Elefantenspitzmaus und der Rüsselratte in eine Gattung oder aber auch die Vereinigung aller Gattungsvertreter der heutigen Macroscelididae in einem einzigen Taxon.[28][32] Im Jahr 2016 wurde letztendlich die Nordafrikanische Elefantenspitzmaus aus der Gattung Elephantulus herausgelöst und in die eigene Gattung Petrosaltator gestellt. Gleichzeitig erhielt die Panelephantulus clade den Status einer Tribus mit der Bezeichnung Macroscelidini,[34] welche später auf die Ebene einer Unterfamilie verschoben wurde.[26] Bezüglich der Verwandtschaft der Rüsselratte mit der Somali-Elefantenspitzmaus ergaben sich hier erst Hinweise durch genetische Untersuchungen aus dem Jahr 2020, weswegen letztere in die neu geschaffene Gattung Galegeeska überführt wurde. Die Aufspaltung des gesamten Verwandtschaftskomplexes der Macroscelidinae datiert in das Obere Oligozän vor rund 25,5 Millionen Jahren.[25]
Die Rüsselratte ist sehr variantenreich, die Unterscheidungen erfolgen zumeist aufgrund unterschiedlicher Farbgebungen des Fells. Die Aufteilung in Unterarten ist vorläufig, möglicherweise müssen einige Formen als klinal angesehen werden. Zumeist werden folgende Unterarten angegeben:[8][2][4]
- P. t. beirae Roberts, 1913; Mosambik südlich des Sambesi; diffuser Mittelstreifen auf dem Rücken; Körperseiten hell gelblichbraun, deutlich abgesetzt vom weißlichen Bauch; keine borstenartigen Haare entlang der Mittellinie auf der Schwanzunterseite; Schwanzoberseite nahezu nackt.
- P. t. rovumae Thomas, 1897; östliches Tansania, nordöstliches Mosambik; kein deutlicher Mittelstreifen auf dem Rücken; weißlicher Bauch mit einem Gelblichbraun durchsetzt; Haare entlang der Mittellinie auf der Schwanzunterseite borstenartig mit knotenartigem Ende.
- P. t. sangi Heller, 1912 (wird teilweise auch innerhalb von P. t. sultan geführt); nur aus den Taita-Bergen von Kenia bekannt; schmaler und diskreter gelblichbraun aufgehellter Mittelstreifen auf dem Rücken, von grauen Zonen flankiert; lange, borstenartige Haare entlang der Mittellinie auf der Schwanzunterseite mit knotenartigem Ende, Schwanzoberseite nahezu nackt.
- P. t. schwanni Thomas & Wroughton, 1907; nur aus Coguno in der Provinz Inhambane in Mosambik bekannt; diffuser, grauer Mittelstreifen auf dem Rücken; Körperseiten grau mit leichtem gelbbraunen Einschlag, unscharf zum ebenfalls gelblichbraunen Bauch abgesetzt; borstenartige Haare entlang der Mittellinie auf der Schwanzunterseite mit knotenartigem Ende.
- P. t. sultan Thomas, 1897; Küstengebiet von Kenia und Tansania vom Galana bis zum Pangani; schmaler und diskreter rötlichbrauner Mittelstreifen auf dem Rücken, von grauen Zonen flankiert; Bauch eher gelblichbraun; lange, borstenartige Haare entlang der Mittellinie auf der Schwanzunterseite mit knotenartigem Ende, Schwanzobernseite nahezu nackt; große Form mit oberer Zahnreihenlänge über 28 mm.
- P. t. swynnertoni Thomas, 1918; bei Chimanimani in Simbabwe; matter als P. t. beirae und P. t. tetradactylus; Schwanz kaum behaart.
- P. t. tetradactylus Peters, 1846; vom Sambesi nordwärts über Sambia, Malawi bis nach Tansania und Ruanda sowie im Südosten der Demokratischen Republik Kongo; kein deutlicher Mittelstreifen auf dem Rücken; weißlicher Bauch; Haare entlang der Mittellinie auf der Schwanzunterseite verlängert.
- P. t. tordayi Thomas, 1910; am Sankuru in der Demokratischen Republik Kongo; sehr dunkle Rückenfärbung ohne Mittelstreifen; auffallende gelbbraune Streifen an den Körperseiten; cremefarbener Bauch, teils verwaschen gelbbraun; Schwanz nahezu nackt.
- P. t. warreni Thomas, 1918; Zululand in KwaZulu-Natal in Südafrika; kein deutlicher Mittelstreifen auf dem Rücken; Körperseiten grau mit sehr wenig Gelbbraun; weißlicher Bauch; Haare entlang der Mittellinie auf der Schwanzunterseite unspezialisiert, Schwanz dünn behaart.
- P. t. zanzibarensis Corbet & Neal, 1965; auf den Inseln Sansibar und Mafia; leicht rötlichbrauner Mittelstreifen auf dem Rücken, durch graue Zonen von den gelblichbraunen Körperseiten abgesetzt; Haare entlang der Mittellinie der Schwanzunterseite mit knotenartigem Ende; kleiner als P. t. sultan mit oberer Zahnreihenlänge unter 28 mm.
Stammesgeschichte
Fossilfunde der Rüsselratte sind nicht bekannt.[35] Die nahe Verwandtschaft mit der Nordafrikanischen Elefantenspitzmaus befürwortet eine zeitlich frühe Abspaltung der beiden voneinander. Die molekulargenetisch Untersuchungen datieren dies in das ausgehende Mittlere Miozän vor rund 11 Millionen Jahren. Möglicherweise spielte dabei die Herausbildung der Sahara eine große Rolle, die die einst weiter verbreiteten Vorläufer der beiden Arten voneinander abtrennte und so zu ihrer heutigen Verbreitung beitrug.[36]
Forschungsgeschichte

Gattung und Art wurden im Jahr 1846 von Wilhelm Peters wissenschaftlich erstbeschrieben. Für die Benennung stand ihm ein Individuum aus Tete am Sambesi in Mosambik zur Verfügung, das er dort selbst beobachtet und gefangen hatte, der Ort gilt auch als Typuslokalität. Peters erkannte aufgrund der rüsselartig verlängerten Nase und der langen Hinterbeine große Ähnlichkeiten der Rüsselratte zu Macroscelides, beide ordnete er zusammen in die Gruppe der „Rohrüssler“. Als Unterschied merkte er den nur vierzehigen Hinterfuß an. Der wissenschaftliche Gattungsname Petrodromus setzt sich aus den griechischen Wörtern πέτρα (petra „Fels“) sowie δρομος (dromos „Läufer“) zusammen und bezieht sich auf die Annahme, die Tiere würden in felsigen Landschaften leben. Der Artname tetradactylus ist ebenfalls griechischen Ursprungs (τέσσαρες (tessares), abgeleitet τετρα (tetra „vier“) und δάκτυλος (daktylos „Finger“)) und hebt die vierstrahligen Hinterfüße als Merkmal hervor.[37][2] In seinem Bericht Naturwissenschaftliche Reise nach Mossambique aus dem Jahr 1852 beschrieb Peters dann die Rüsselratte eingehend und ging dabei sowohl auf äußere als auch auf innere anatomische Eigenschaften ein, als weitere Fundorte benannte er Sena und Boror.[6] Albert Günther machte 1881 erstmals auf die knotenartigen Verdickungen der Haare der Schwanzunterseite aufmerksam.[38] Im Jahr 1897 vermutete Oldfield Thomas, dass die Gattung Petrodromus unter anderem aufgrund der Gestaltung beziehungsweise An- oder Abwesenheit dieser besonderen Schwanzhaarenden mehrere Arten beinhalten könnte. Er führte zu diesem Zeitpunkt unter anderem P. t. rovumae und P. t. sultan, später auch P. t. tordayi als eigenständige Arten ein.[39][40] Andere Autoren folgten ihm teilweise,[41] so dass die Gattung Petrodromus in den ersten beiden Jahrzehnten des 20. Jahrhunderts aus mehreren Arten mit verschiedenen Unterarten bestand. Im Jahr 1916 kreierte Ned Hollister die Untergattungsbezeichnung Cercoctenus, die er von Petrodromus anhand der Ausprägung der knotenartigen Enden an den Schwanzborsten und der Gestaltung der Höckerchen an den Prämolarenunter unterschied. Er vereinte in Cercoctenus unter anderem die Formen P. t. sultan, P. t. sangi und P. t. schwanni.[42] Oldfield Thomas diskutierte zwei Jahre darauf die borstenartigen Haare erneut und etablierte mit Mesoctenus eine weitere Untergattung, in die er P. t. rovumae stellte. Seiner Meinung nach bestand die Gattung Petrodromus aus drei Untergattungen, einerseits die Nominatform mit einfachen, verlängerten Borsten und andererseits Mesoctenus und Cercoctenus, die sich durch besondere Ausprägung der Spitzen der Borsten auszeichneten, wobei erstere nur leichte Verdickungen besaß, letzterer aber deutlich knopf- oder knotenartige Bildungen.[43] In der Gesamtrevision der Rüsselspringer aus dem Jahr 1968 durch Gordon Barclay Corbet und John Hanks berücksichtigten diese die einzelnen Untergattungen nicht und vereinten die verschiedenen Arten zu einer mit insgesamt neun Unterarten. Sie gaben aber an, dass P. t. tordayi aufgrund seiner abgetrennten Verbreitung im Kongobecken ohne Verbindung zum restlichen Vorkommen der Rüsselratte ein möglicher Kandidat für eine eigene Art wäre, die allopatrisch entstand. Sie konnten aber keine definierenden Merkmale vorlegen.[8]
Rüsselratte und der Mensch
Darstellungen der Rüsselratte
Im Gegensatz zu zahlreichen anderen afrikanischen Säugetieren, die häufig in der lokalen prähistorischen Felsmalerei abgebildet wurden, sind Darstellungen der Rüsselratte praktisch unbekannt. In der Nähe von Springbok in der südafrikanischen Provinz Nordkap befinden sich auf den dunkel gefärbten Doleritblöcken der Karoo allerdings einige wenige Abbildungen eines Tieres, das mit großem Kopf und verlängerter Nase an Rüsselspringer denken lässt. Charakteristische senkrechte Linien an der Unterseite des Schwanzes erinnern an die Borsten der Rüsselratte. Die Felsmalereien sind Teil des Kulturkreises der Khoisan-Volksgruppen, ihr Alter ist unbekannt, könnte aber bis zu 6000 Jahre betragen. Bemerkenswert ist, dass sie rund 1000 bis 1200 km westlich bis südwestlich der nächsten heutigen Populationen der Rüsselratte auftreten. Die Landschaft gehört heute zu den semiariden Gebieten der Karoo, ob die Rüsselratte hier ursprünglich ebenfalls verbreitet war, ist unbekannt.[44][17]
Bedrohung und Schutz
Größere Bedrohungen für den Bestand der Rüsselratte sind nicht bekannt. Sie gehört zu den am weitesten verbreiteten Arten der Rüsselspringer und wird daher von der IUCN als „nicht gefährdet“ (least concern) eingestuft. Sie ist in zahlreichen geschützten Gebieten vertreten unter anderem im Arabuko-Sokoke-Nationalpark.[14] Allerdings sind die einzelnen Unterarten unterschiedlichen Einflüssen ausgesetzt. Für die auf die Taita-Berge in Kenia beschränkte Unterart P. t. sangi wird aufgrund der Zerstörung der Wälder eine stärkere Bedrohung angenommen, möglicherweise ist sie bereits ausgestorben. Die Unterart P. t. beirae aus dem südöstlichen Afrika gilt allgemein als sehr selten. Im östlichen Kenia wird die Rüsselratte teilweise zu Nahrungszwecken bejagt. Die Giriami erbeuten einer Studie aus dem Anfang der 1990er Jahre zufolge im rund 350 km² großen Arabuko-Sokoke-Waldgebiet jährlich bis zu 5700 Individuen mit einer Gesamtbiomasse von rund 1,1 t. Die Rüsselratte stellt dabei mit einem Anteil von 35 % die am häufigsten erlegte Art dar. Nach Berechnungen entspricht die Menge etwa 15 Individuen je Quadratkilometer je Jahr, was bei einer Populationsdichte von 2,1 bis 3,9 Individuen je Hektar als vertretbar angesehen wird.[45][4] Die Rüsselratte wird nur selten in zoologischen Gärten gezeigt, einziger Halter der europäischen Zoogeschichte war, in den 1960er Jahren, London.[46] Einzelne Tiere befinden sich aber auch in privaten Einrichtungen.[47]
Literatur
- Mark R. Jennings und Galen B. Rathbun: Petrodromus tetradactylus. Mammalian Species 682, 2001, S. 1–6 (Volltext)
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 (S. 230) ISBN 978-84-16728-08-4
- Ronald M. Nowak: Walker's Mammals of the World. Johns Hopkins University Press, 1999 ISBN 0801857899
- Galen B. Rathbun: Petrodromus tetradactyla Peters, 1846 - Four-toed elephant-shrew. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 24–25
- Galen B. Rathbun: Petrodromus tetradactyla Peters, 1846 - Four-toed elephant-shrew. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 279–281
Einzelnachweise
- Clare D. FitzGibbon: Comparative ecology of two elephant-shrew species in a Kenyan coastal forest. Mammal Review 25 (1/2), 1995, S. 19–30
- Mark R. Jennings und Galen B. Rathbun: Petrodromus tetradactylus. Mammalian Species 682, 2001, S. 1–6
- Galen B. Rathbun: Petrodromus tetradactyla Four-toed Sengi (Four-toed Elephant-shrew). In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 24–25
- Galen B. Rathbun: Petrodromus tetradactyla Peters, 1846 - Four-toed elephant-shrew. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 279–281
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 (S. 230) ISBN 978-84-16728-08-4
- Wilhelm Peters: Naturwissenschaftliche Reise nach Mossambique: auf Befehl seiner Majestät des Königs Friedrich Wilhelm IV in den Jahren 1842 bis 1848 ausgeführt. Berlin, 1852, S. 1–205 (S. 92–100) ()
- Gea Olbricht und William T. Stanley: The topographic distribution of the penis and mammary glands in sengis (Macroscelidea) and its usefulness for taxonomic distinctions. Zoosystematics and Evolution 85 (2), 2009, 297–303
- G. B. Corbet und J. Hanks: A revision of the elephant-shrews, Family Macroscelididae. Bulletin of the British Museum (Natural history) Zoology 16, 1968, S. 47–111
- Dieter Kock und William T. Stanley: Mammals of Mafia Island, Tanzania. Mammalia 73, 2009, S. 339–352
- N. Oguge, R. Hutterer, R. Odhiambo und W. Verheyen: Diversity and structure of shrew communities in montane forests in Southeast Kenya. Mammalian Biology 69, 2004, S. 289–301
- Hyd Kiwia: Species richness and abundance estimates of small mammals in Zararinge coastal forest in Tanzania. Tanzanian Journal of Science 32 (2), 2006, S. 51–60
- K. Kaswera: The ecology and morphology of sengis in DRC. Afrotherian Conservation 6, 2008, S. 11–12
- Katherine H. Oxenham und Michael R. Perrin: The spatial organization of the four-toed elephant-shrew (Petrodromus tetradactylus) in Tembe Elephant Park, KwaZulu-Natal, South Africa. African Zoology 44 (2), 2009, S. 171–180
- C. FitzGibbon, M. Perrin, C. Stuart (IUCN SSC Afrotheria Specialist Group) und H. Smit (Stellenbosch University): Petrodromus tetradactylus. The IUCN Red List of Threatened Species. Version 2014.3. (); zuletzt aufgerufen am 26. Mai 2015
- Galen B. Rathbun: The social structure and ecology of Elephant-shrews. Zeitschrift für Tierpsychologie Beiheft 20 (Fortschritte der Verhaltensforschung), 1979, S. 1–76
- Ian Linn, Michael R. Perrin und Kay Hiscocks: Use of space by the four-toed elephant-shrew Petrodromus tetradactylus (Macroscelidae) in Kwazulu-Natal (South Africa). Mammalia 71, 2007, S. 30–39
- Galen B. Rathbun: Tales of sengi tails. Afrotherian Conservation 6, 2008, 8–10
- Arthur Loveridge: Notes on East African Mammalia (other than horned ungulates) collected or kept in captivity 1915–1919, part 2. Journal of the East African and Uganda Natural History Society 5 (17), 1922, S. 39–69
- Mike Perrin: Comparative aspects of the metabolism and thermal biology of elephant-shrews (Macroscelidea). Mammal Review 25, 1995, S. 61–78
- Colleen T. Downs: Renal structure, and the effect of an insectivorous diet on urine composition of Southern African Elephant-Shrew species (Macroscelidea). Mammalia 60 (4), 1996, S. 577–589
- Colleen T. Downs und Mike R. Perrin: The thermal biology of three Southern African Elephant-shrews. Journal of thermal Biology 20 (6), S. 445–450
- Gea Olbricht: Longevity and fecundity in sengis (Macroscelidea).Afrotherian Conservation 5, 2007, S. 3–5
- Ivan G. Horak, Shaun Welman, Stacey L. Hallam, Heike Lutermann und Nomakwezi Mzilikazi: Ticks of four-toed elephant shrews and Southern African hedgehogs. Onderstepoort Journal of Veterinary Research 78 (1). 2011, Art. 243 doi:10.4102/ojvr.v78i1.243
- L. J. Fourie, J. S. du Toit, D. J. Kok und I. G. Horak: Arthropod parasites of elephant-shrews, with particular reference of ticks. Mammal Review 25, 1995, S. 31–37
- Steven Heritage, Houssein Rayaleh, Djama G. Awaleh und Galen B. Rathbun: New records of a lost species and a geographic range expansion for sengis in the Horn of Africa. PeerJ 8, 2020, S. e9652, doi:10.7717/peerj.9652
- Brigitte Senut und Martin Pickford: Micro-cursorial mammals from the late Eocene tufas at Eocliff, Namibia. Communications of the Geological Survey of Namibia 23, 2021, S. 90–160
- Mike Perrin und Galen B. Rathbun: Order Macroscelidea – Sengis (Elephant-shrews). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 258–260
- H. A. Smit, B. Jansen van Vuuren, P. C. M. O’Brien, M. Ferguson-Smith, F. Yang und T. J. Robinson: Phylogenetic relationships of elephant-shrews (Afrotheria, Macroscelididae). Journal of Zoology 284, 2011, S. 133–143
- P. F. Woodall: The penis of elephant shrews (Masmmalia: Macroscelididae). Journal of Zoology 237, 1995, S. 399–410
- Fabiana Panchetti, Massimiliano Scalici, Giuseppe Maria Carpaneto und Giancarlo Gibertini: Shape and size variations in the cranium of elephant-shrews: a morphometric contribution to a phylogenetic debate. Zoomorphology 127, 2008, S. 69–82
- Massimiliano Scalici und Fabiana Panchetti: Morphological cranial diversity contributes to phylogeny in soft-furred sengis (Afrotheria, Macroscelidea). Zoology 114, 2011, S. 85–94
- Julien Benoit, Nick Crumpton, Samuel Merigeaud und Rodolphe Tabuce: Petrosal and Bony Labyrinth Morphology Supports Paraphyly of Elephantulus Within Macroscelididae (Mammalia, Afrotheria). Journal of Mammalian Evolution 21, 2014, S. 173–193
- Matjaž Kutner, Laura J. May-Collado und Ingi Agnarsson: Phylogeny and conservation priorities of afrotherian mammals (Afrotheria, Mammalia). Zoologica Scripta 40, 2011, S. 1–15
- John P. Dumbacher, Elizabeth J. Carlen und Galen B. Rathbun: Petrosaltator gen. nov., a new genus replacement for the North African sengi Elephantulus rozeti (Macroscelidea; Macroscelididae). Zootaxa 4136 (3), 2016, S. 567–579
- Patricia A. Holroyd: Macroscelidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 89–98
- Christophe J. Douady, François Catzeflis, Jaishree Raman, Mark S. Springer und Michael J. Stanhope: The Sahara as a vicariant agent, and the role of Miocene climatic events, in the diversification of the mammalian order Macroscelidea (elephant shrews). PNAS 100 (14), 2003, S. 8325–8330
- Wilhelm Peters: Über neue Säugethiergattungen aus den Ordnungen der Insectenfresser und Nagethiere. Bericht über die zur Bekanntmachung geeigneten Verhandlungen der Koniglichen Preussischen Akademie der Wissenschaften 1846, S. 257–259 ()
- Albert Günther: Notes on the species of Rhynchocyon and Petrodromus. Proceedings of the Zoological Society of London, 1881, S. 163–164 ()
- Oldfield Thomas: Exhibition of small mammals from North Nyasaland, with a note on the genus Petrodromus. Proceedings of the Zoological Society of London, 1897, S. 430–436 ()
- Oldfield Thomas: New African mammals. Annals and Magazine of Natural History 5, 1910, S. 83–92()
- Austin Roberts: The collection of mammals in the Transvaal Museum registered up to the 31st march, 1913, with description of new species. Annals of the Transvaal Museum 4 (2), 1913, S. 65–107
- N. Hollister: Descriptions of a new genus and eight new species of African mammals. Smithsonian miscellaneous collections 66, 1917, S. 1–8 ()
- Oldfield Thomas: Notes on Petrodromus and Rhynchocyon. The Annals and magazine of natural history 9 (1), 1918, S. 364–370 ()
- Janette Deacon und Craig Foster: My Heart Stands in the Hill. London, Kapstadt, Sydney, 2005, S. 1–191 (S. 135)
- Clare D. FitzGibbon, Hezron Mogaka und John H. Fanshawe: Subsistence Hunting in Arabuko-Sokoke Forest, Kenya, and Its Effects on Mamml Populations. Conservation Biology 9 (5), 1995, S. 1116–1126
- Zootierliste (), zuletzt abgerufen am 15. Juni 2015
- Gea Olbricht und Alexander Sliwa: Elefantenspitzmäuse – die kleinen Verwandten der Elefanten? Zeitschrift des Kölner Zoos 53 (3), 2010, S. 135–147
Weblinks
- Petrodromus tetradactylus in der Roten Liste gefährdeter Arten der IUCN 2013.1. Eingestellt von: FitzGibbon, C., Perrin, M., Stuart, C. (IUCN SSC Afrotheria Specialist Group) & Smit, H. (Stellenbosch University), 2008. Abgerufen am 26. Mai 2015.
- California Academy of Sciences: Foto einer Rüsselratte