Östliche Klippen-Elefantenspitzmaus
Die Östliche Klippen-Elefantenspitzmaus (Elephantulus myurus), auch Klippen-Rüsselspringer oder Östliche Elefantenspitzmaus genannt, ist eine Art der Elefantenspitzmäuse aus der Ordnung der Rüsselspringer (Macroscelidea). Sie kommt im südöstlichen Afrika von Südafrika bis Simbabwe vor. Ihr Lebensraum umfasst die teils trockenen Graslandschaften des Veld, wo sie relativ häufig auftritt. Die Art teilt die für alle Vertreter der Elefantenspitzmäuse charakteristische rüsselartige Nase ebenso wie die langen Hinterbeine und demgegenüber kurzen Vorderbeine. Sie lebt bodenbewohnend und bildet monogame Paare, deren Bindung aber eher schwach ist. Die Fortpflanzung erfolgt abhängig von den Jahreszeiten, ein Wurf besteht aus zwei, teilweise auch nur einem Jungtier. Die Nahrung umfasst überwiegend Insekten, daneben werden deutlich seltener Pflanzen verzehrt. Die Erstbeschreibung der Östlichen Klippen-Elefantenspitzmaus erfolgte 1906 als Unterart der Westlichen Klippen-Elefantenspitzmaus. Als eigenständige Art ist sie erst seit 1935 anerkannt. Der Bestand wird als nicht gefährdet eingestuft.
| Östliche Klippen-Elefantenspitzmaus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Östliche Klippen-Elefantenspitzmaus (Elephantulus myurus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Elephantulus myurus | ||||||||||||
| Thomas & Schwann, 1906 |
Beschreibung
Habitus
Die Östliche Klippen-Elefantenspitzmaus ist ein mittelgroßer bis großer Vertreter der Elefantenspitzmäuse und erreicht eine Gesamtlänge von 20,2 bis 29,2 cm. Davon nimmt der Schwanz zwischen 10,1 und 16,0 cm ein, was etwa – oder etwas mehr (110 %) als – der restlichen Körperlänge entspricht. Das Gewicht variiert von 41 bis 98 g. Ein ausgeprägter Sexualdimorphismus zwischen den Geschlechtern liegt nicht vor. Männliche Tiere wiegen im Durchschnitt 60,9 g, weibliche 60,0 g. Eine Untersuchung von mehr als 115 Individuen im Goro-Wildreservat im nordöstlichen Südafrika ergab im Mittel ein Gewicht von 51,1 g für Männchen und 51,9 g für Weibchen.[1] Allgemein ähnelt die Östliche Klippen-Elefantenspitzmaus den anderen Elefantenspitzmäusen und zeichnet sich durch einen großen Kopf mit verlängerter, rüsselartiger Nase sowie kurzen Vorder- und langen Hinterbeinen aus. Das Fell ist weich und wollig. Die einzelnen Haare können am Rücken bis zu 13 mm lang werden. Sie sind glänzend schwarz gefärbt, die Spitze erscheint dagegen gelblichbraun. Im Fell verstreut treten lange, vollständig schwarze Haare auf, die möglicherweise eine Tastfunktion haben. Der Rücken und die Oberseite des Kopfes zeigen eine insgesamt gelblichgraubraune Färbung, die zu den Seiten und nach unten mehr grau wird. Der Bauch hebt sich durch eine hellgraue bis weißliche Tönung ab. Die Schnauze besitzt eine ausgewaschene bis fahlgraue Farbe. Die Ohren sind 18 bis 30 mm lang und an den Spitzen leicht gerundet. Ihre überwiegend braune Farbe wird nur an den Innenrändern der Ohrmuschel durch hellgraue oder weißlich-graue Haare unterbrochen, die an der Basis teils schiefergrau wirken. Hinter den Ohren befindet sich ein gelblichbrauner Fleck, der aber nicht so deutlich ausgeprägt ist wie bei der Westlichen Klippen-Elefantenspitzmaus (Elephantulus rupestris). Die Augen sind groß und werden von einem schmalen, weißlich grauen Ring umrahmt. Der lange, schmale Schwanz ist oberseits dunkel, unterseits hell gefärbt, zur Spitze hin aber vollständig dunkel. Er hat abweichend von der Westlichen Klippen-Elefantenspitzmaus nur eine spärliche Fellbedeckung bestehend aus kurzen Haaren. Außerdem fehlt ihm der für diese Art oder auch für die Kap-Elefantenspitzmaus (Elephantulus edwardii) charakteristische Haarbüschel am Ende. Die Vorder- und Hinterbeine enden in fünfstrahlige Hände und Füße, die kurze, gekrümmte Krallen tragen. Die Oberseite ist zumeist hellgrau bis weißlich gefärbt, die Unterseite ist mit einem dicken, schwarzfarbenen Hautpolster versehen. Die Hinterfußlänge beträgt 29 bis 42 mm.[2][3][4]
Schädel- und Gebissmerkmale
Der Schädel ist durchschnittlich 38,5 mm lang, seine Breite an den Jochbögen liegt bei 20,4 mm. Die Länge des Nasenbeins beträgt etwa 15 mm.[5] Die Paukenblase zeichnet sich durch eine deutliche Schwellung aus. Die Knochennaht zwischen dem Mittelkieferknochen und dem Oberkiefer verläuft leicht geschwungen. Das Gebiss setzt sich aus 40 Zähnen zusammen und besitzt folgende Zahnformel: . Der innere Schneidezahn (I1) der oberen Zahnreihe ist deutlich größer als die beiden äußeren. Der Eckzahn besitzt nur eine geringe Größe und ist spitz. Dem ersten oberen Prämolaren fehlen im Gegensatz zur Westlichen Klippen- und zur Trockenland-Elefantenspitzmaus (Elephantulus intufi) die zungenseitigen Höckerchen auf der Kauoberfläche. Am zweiten oberen Prämolar tritt meist nur ein zungenseitiges Höckerchen auf, das sich manchmal aber auch in zwei, eng zusammenstehende teilt. Dieses ist zudem nur halb so hoch wie die Höckerchen auf der Zahnwangenseite. Die gesamte obere Zahnreihe vom ersten Schneidezahn bis zum letzten Molaren erreicht 20,6 mm.[2][3][6][4]
Verbreitung
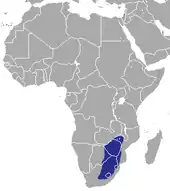
Die Östliche Klippen-Elefantenspitzmaus ist endemisch in Afrika verbreitet, wo sie im südöstlichen Teil des Kontinents vom östlichen Südafrika über den Südwesten von Mosambik, den Südosten von Botswana bis nach Simbabwe vorkommt. In Eswatini konnte die Art bisher nicht nachgewiesen werden. Ursprünglich in den 1990er Jahren auch aus dem westlichen Lesotho belegt,[7] fehlt sie dort in den Feldstudien seit dem Jahr 2000.[8] Ihr Lebensraum umfasst die halbtrockenen Graslandschaften des Highveld und die Sambesi-Waldland-Biozone. Dort bewohnt sie vor allem felsige Landschaften an Hügel- und Berghängen, Kopjes oder auf Geröllfeldern, in denen aber Felshöhlen- und -spalten als Grundvoraussetzung für die Anwesenheit der Tiere vorhanden sein müssen. Zudem sind überhängende Felsen oder gebietsweise Vegetation notwendig, die während der Aktivitätsphasen Schutz vor Greifvögeln und anderen Beutegreifern gewährleisten können. Lokal kann die Östliche Klippen-Elefantenspitzmaus sehr häufig auftreten, die jeweilige Populationsdichte ist aber von ökologischen Faktoren abhängig. In Zeiten mit erhöhtem Niederschlag und daraus resultierend großem Nahrungsangebot kann ein Hektar bis zu 88 Individuen beherbergen. Diese hohe Dichte löst sich dann meist mit Beginn der Trockenzeit in isolierte Gruppen auf. Teilweise überschneidet sich das Verbreitungsgebiet mit dem der Kurznasen-Elefantenspitzmaus (Elephantulus brachyrhynchus), die aber sandigere und ebenere Habitate bevorzugt.[2][3][4]
Lebensweise
Territorialverhalten

Die Östliche Klippen-Elefantenspitzmaus ist hauptsächlich tagaktiv mit einer Hauptphase während der Dämmerungszeit. Sie kann aber auch nachts auftreten. Die Zeiten mit der geringsten Aktivität umfassen dadurch die Stunden um und bis weit nach Mitternacht (23:00 bis 05:00 Uhr) sowie vom Mittag bis zum späten Nachmittag (12:00 bis 17:00 Uhr).[9] Vor allem in den frühen Morgenstunden tätigen die Tiere ausgiebige Sonnenbäder auf Felsblöcken. Sie sind schnelle (cursoriale) Bodenläufer, die sich teils vierfüßig springend fortbewegen. Dabei können sie Abstände von bis zu einem Meter zwischen zwei Felsblöcken springend überwinden. Die einzelnen Individuen unterhalten Aktionsräume, innerhalb derer sich zahlreiche Unterschlüpfe in Form von Felsspalten, -löchern oder -überhängen befinden. Spezielle Nester werden aber nicht angelegt. Die Grenzen der Streifgebiete sind stark variierend. Gemäß Untersuchungen im Weenen-Naturreservat in der südafrikanischen Provinz KwaZulu-Natal beträgt die Größe bei Männchen für einen monatlichen Aktivitätszyklus circa 0,4 ha, bei Weibchen etwa 0,2 ha. Innerhalb von fünf Monaten kann die genutzte Fläche bei Männchen durchschnittlich 1 ha, bei Weibchen rund 0,36 ha betragen.[10] Vergleichbare Werte ergaben sich während einer vierjährigen Studie im Goro-Wirltierreservat in der Provinz Limpopo. Hier weisen die Männchen eine Reviergröße von durchschnittlich 0,68 ha und Weibchen von 0,5 ha auf. Variationen ergeben sich vor allem während der Fortpflanzungsphase. Dann wächst ihre Ausdehnung auf nahezu das Doppelte an, was möglicherweise durch den höheren Energiebedarf während dieser Zeit verursacht wird. Der durchschnittliche Abstand zwischen den Aktivitätszentren der Reviere beträgt 114 m. Auffallend hier ist, dass weibliche Tiere eine deutlich höhere Distanz zueinander halten, als es unter männlichen der Fall ist.[11] Bei Untersuchungen nördlich von Bethulie in der südafrikanischen Provinz Freistaat in rund 1600 m Geländehöhe konnten durchschnittlich größere Reviere beobachtet werden, die bei Männchen bis zu 3,96 ha, bei Weibchen rund 1,1 ha erreichten. Als Besonderheit erwiesen sich die Aktionsräume in steilen Hängen mit dichter Buschvegetation als markant kleiner mit nur einem Fünftel der Größe von denen in flachen Ebenen.[12][4]
Die Sozialstruktur besteht aus monogamen Paaren. Die Reviere der gebundenen Tiere überschneiden sich häufig, wobei das des Weibchens vom assoziierten Männchen verteidigt wird. Über die Fortpflanzung hinausgehende gemeinsame Aktivitäten finden jedoch kaum statt. Nach dem Tod oder Verschwinden eines Partners kommt es schnell zu neuen Paarbildungen mit ungebundenen, teilweise aber auch mit gebundenen Tieren, wodurch sich auch in der Regel die Reviergrenzen verschieben. Eventuell besteht unter Männchen eine größere Konkurrenz um ungebundene Weibchen, was auch die auffallend größeren Aktionsräume der männlichen Tiere erklären könnte. Diese überlappen sich deutlich häufiger mit den Streifgebieten der weiblichen Tiere als umgekehrt, was den Männchen die Möglichkeit gibt, die Grenzen ihrer Gebiete nach freiwerdenden Weibchen abzusuchen. Insgesamt können die Paarbindungen innerhalb der Östlichen Klippen-Elefantenspitzmaus als eher schwach angesehen werden.[10][2][3][4]
Die innerartliche Kommunikation findet auf verschiedenen Wegen statt. Typisch ist ein katzenartiges „Miau“ bei einer Frequenz von 1,47 kHz, das bis zu 468 ms anhält. Beim Ausstoßen des Lautes streckt ein Tier den Kopf nach oben, zieht die rüsselartige Nase zurück und hält das Maul geöffnet. Daneben kommt ein charakteristisches Trommeln zum Einsatz, das mit Schlägen der Hinterfüße auf den Boden erzeugt wird. Dieses Fußtrommeln besteht aus eine Folge von 3 bis 4 regelmäßigen Schlägen mit einem Abstand von 25 bis 40 ms, der sich eine weitere Folge nach einer Pause von 250 bis 350 ms anschließt. Eine gesamte Serie derartiger trommelartiger Geräusche kann zwischen 5 und 20 Sekunden, teilweise aber auch mehrere Minuten andauern.[13][2][3]
Ernährung
Die Östliche Klippen-Elefantenspitzmaus ernährt sich hauptsächlich von Insekten. Untersuchungen von Kotresten in den Grasländern des Highveld bei Marondera im nordöstlichen Zimbabwe ergaben, dass die Nahrung zu rund 90 % aus Wirbellosen besteht. Etwa 22,4 % der konsumierten Nahrungsmenge umfassten Ameisen, weitere 19,5 % Termiten. Darüber hinaus werden auch Käfer gefressen, die 15,1 % ausmachten. Unter diesen dominierten weitgehend Schwarzkäfer und Rüsselkäfer. Vergleichsweise gering war der Anteil der sonstigen Wirbellosen, die hauptsächlich Gliederfüßer wie Webspinnen, Schmetterlinge oder Zweiflügler darstellten. Die restlichen 10 % der Nahrungsmenge verteilten sich auf Pflanzenreste. Hier dominierten vor allem Süßgräser und Samen von Kräutern.[14] Zur Nahrungssuche verwenden die Tiere ihren ausgezeichneten Geruchssinn und stöbern mit ihren langen Nasen in Felsspalten und zwischen Geröllen nach Beute. Die Aufnahme der Beute erfolgt mit der langen Zunge. Größere Beutetiere wie Grashüpfer fängt die Östliche Klippen-Elefantenspitzmaus mit kurzen Sprüngen und verzehrt sie an versteckten Plätzen. Wie in ihrem gesamten Habitat bevorzugt sie steinigen Untergrund für die Nahrungssuche und meidet Sandflächen.[15][2][3][4]
Die durchschnittliche Körpertemperatur der Östlichen Klippen-Elefantenspitzmaus liegt bei 35,7 bis 37,7 °C und schwankt im Verlauf des Tages nur minimal.[16] Die jährlichen Außentemperaturen im Verbreitungsgebiet variieren dagegen beträchtlich und können in der kalten Jahreszeit bis zum Gefrierpunkt absinken. Unter ungünstigen Bedingungen, etwa bei niedrigen Außentemperaturen, gehen die Tiere in einen Starrezustand über (Torpor). Dieser kann bereits bei 25 °C einsetzen, ist dann aber mit rund 12 Minuten eher kurz. Im Durchschnitt dauern die Starrephasen etwa 9 bis 10 Stunden. Der längste dokumentierte Torpor dauerte bei einer Außentemperatur von 3,7 °C 20 Stunden und 18 Minuten an. Verbunden ist der Torpor nicht nur mit einer Verringerung der Atemleistung auf rund 2 %, sondern auch mit einem Absinken der Körpertemperatur. Der niedrigste gemessene Wert lag hier bei 7,5 °C, während die Umgebungstemperatur 2,7 °C betrug. In der Regel treten solche körperlichen Erstarrungen in der kalten Jahreszeit auf und beginnen dann während der Abenddämmerung, selten zur Morgendämmerung. Zudem konnten sie bei weiblichen Tieren häufiger festgestellt werden.[17][18] Allerdings kann der Torpor auch bei ungünstigen Nahrungsbedingungen außerhalb der kalten Jahreszeit einsetzen. In diesem Fall dauert er nie länger als 18 Stunden.[19]
Fortpflanzung
Der Nachwuchs kommt überwiegend während der warmen und feuchten Jahreszeit zwischen September und März zur Welt. Eine direkte Beeinflussung der Fortpflanzung durch die Dauer und Intensität der Sonneneinstrahlung in Folge jahreszeitlicher Zyklen ist nicht nachweisbar,[20] die Beschränkung auf die Regenzeit kann so wohl durch das stärkere Pflanzenwachstum und die höhere Aktivität der Beutetiere erklärt werden. Dadurch beginnen die männlichen und weiblichen Individuen der Östlichen Klippen-Elefantenspitzmaus auch ihren Fruchtbarkeitszyklus mit dem sich anbahnenden Wechsel von der Trocken- zur Regenzeit. Männchen besitzen allgemein nur kleine Hoden im Vergleich zu etwa gleich großen Tieren. Die Spermaproduktion ist während der Trockenzeit relativ gering, steigt aber mit dem Ende der Jahreszeit deutlich an, was auch mit einem Anschwellen der Hoden einhergeht. Die Hauptaktivität der Fortpflanzung der Männchen findet zwischen Oktober und Dezember statt.[21][22] Etwa zur selben Zeit treten Weibchen in die Östrusphase ein, was unter anderem durch das Anschwellen des Eierstocks und einem Anstieg der Konzentration an Progesteron angezeigt wird. Der Östrus hält bei weiblichen Tieren teilweise bis in den März an.[23] Dadurch gehört die Östliche Klippen-Elefantenspitzmaus neben der Nordafrikanischen Elefantenspitzmaus (Elephantulus rozeti) und teilweise auch der Trockenland-Elefantenspitzmaus (Elephantulus intufi) zu den wenigen Vertretern der Gattung, bei denen die Reproduktionsphase jahreszeitlich strikt begrenzt ist.[1][4]
Die Tragzeit beträgt rund acht Wochen. In der Regel besteht ein Wurf aus zwei Jungtieren, es gibt aber auch zahlreiche Hinweise auf nur singuläre Jungen. Die Neugeborenen besitzen eine Kopf-Rumpf-Länge von etwa 5 cm sowie ein Gewicht von rund 8 g[24] und sind mit einem ausgeprägten, weichen Fell und geöffneten Augen relativ weit entwickelt. Zudem können sie schon kurz nach der Geburt eigenständig laufen. Die erste Zeit verbringen sie in einem Versteck, eine väterliche Betreuung findet nicht statt.[10] Der tägliche Gewichtszuwachs liegt bei etwa 1 g, mit einem Körpergewicht von etwa einem Drittel eines ausgewachsenen Tieres verlassen die Jungtiere den Unterschlupf und nehmen feste Nahrung zu sich. Weibliche Tiere erreichen mit etwa fünf bis sechs Wochen ihre Geschlechtsreife.[25][2][3] Die bisher bekannte Lebenserwartung in freier Wildbahn ist mit einem Jahr und einem Monat und im Maximum einem Jahr und sieben Monaten relativ kurz und deutlich kürzer als bei den anderen Elefantenspitzmausarten.[26][4]
Während einer Fortpflanzungsphase können weibliche Tiere insgesamt dreimal Nachwuchs bekommen. Die niedrige Lebenserwartung und der zeitlich begrenzte Reproduktionszyklus haben zur Folge, dass sie in ihrem gesamten Leben nur drei bis viermal Junge gebären. Das Maximum liegt bei sechs Würfen, was aber nur selten erreicht wird. Früh in der Reproduktionsphase geborene Weibchen bekommen während dieser zweimal Junge und gehen dann in die Anöstrus-Phase, während sehr spät geborene nach ihrer Geschlechtsreife direkt in die Sexualpause wechseln. Ihren ersten Nachwuchs erhalten sie demzufolge erst in der nächsten Fortpflanzungsphase. Weibchen, die beim Einsetzen des Anöstrus trächtig sind, verlieren die Embryos durch Abortion.[23][2]
Fressfeinde und Feindverhalten
Zu den bedeutendsten Fressfeinden gehören Schleiereule und Kap-Uhu. Teilweise wird die Östliche Klippen-Elefantenspitzmaus auch durch Schlangen wie den Rhomben-Schafstecher erbeutet, Untersuchungen an 94 Mageninhalten aus dem Oranje-Freistaat erbrachten aber nur einen Hinweis.[27][3] Bei Störungen flüchtet ein Tier in ein Versteck, erscheint aber nach Abzug der Gefahr sehr schnell wieder an der Oberfläche. Generell sind die einzelnen Individuen stets alarmiert.[2]
Parasiten
Es sind zahlreiche äußere Parasiten der Östlichen Klippen-Elefantenspitzmaus bekannt. Hierzu gehören unter anderem Zecken wie Amblyomma, Ixodes und Rhipicephalus. Vor allem letztere Gattung tritt häufig auf, die Größe des Befalls ist abhängig von den Jahreszeiten, der Regenmenge und den Außentemperaturen. So kann während der Fortpflanzungsphase ein geringerer Parasitenbefall beobachtet werden. Da diese Phase in die wärmere Jahreszeit mit höherem Nahrungsangebot fällt, wird angenommen, dass die kühleren Temperaturen und die geringere Nahrungsmenge außerhalb der Fortpflanzungsperiode mit einer verringerten Funktion des Immunsystems der Elefantenspitzmausart einhergeht und so der höhere Zeckenanteil begünstigt wird. Allerdings werden Weibchen während der Reproduktionsphase durchschnittlich häufiger befallen als Männchen, was wiederum mit den höheren energetischen Kosten während der Trächtigkeit und der Aufzucht der Jungen erklärt wird.[28][29] Rhipicephalus gilt weiterhin auch als Wirt des Bakteriums Anaplasma, einem Erreger der Anaplasmose, der teilweise auf die Östlichen Klippen-Elefantenspitzmaus übertragen wird.[30][31] Als weitere Parasiten sind Milben und Läuse zu nennen.[32] Zu den inneren Parasiten zählen Zungen-, Band- und Fadenwürmer, von letzteren ist vor allem die Gattung Maupasina dominant vertreten.[33]
Systematik
Innere Systematik der Rüsselspringer nach Heritage et al. 2020[34]
|
Die Östliche Klippen-Elefantenspitzmaus ist eine Art aus der Gattung der Elefantenspitzmäuse (Elephantulus). Diese recht formenreiche, in weiten Teilen des südlichen und östlichen Afrikas vorkommende Gattung umfasst derzeit insgesamt acht Arten. Die Elefantenspitzmäuse bilden einen Teil der Ordnung der Rüsselspringer (Macroscelidea). Die Rüsselspringer sind eine Gruppe kleinerer Säugetiere, die endemisch in Afrika auftritt. Sie können heute in zwei Familien unterschieden werden.[35] Die eine stellen die Rhynchocyonidae dar, die nur die Rüsselhündchen (Rhynchocyon) enthalten und somit monotypisch sind. Sie bilden die größten Vertreter der Rüsselspringer und bewohnen überwiegend dicht bewaldete Habitate. Als ihre Schwestergruppe treten die Macroscelididae auf, denen neben den Elefantenspitzmäusen auch die Rüsselratte (Petrodromus), die Nordafrikanische Elefantenspitzmaus (Petrosaltator) sowie die Arten der Gattungen Galegeeska und Macroscelides angehören. Als Bewohner eher trockener und offenerer Landschaften kommen die Vertreter der Macroscelididae in Savannen bis hin zu wüstenartigen Regionen vor. Die beiden Familien trennten sich laut Molekulargenetischen Untersuchungen im Unteren Oligozän vor etwa 32,8 Millionen Jahren voneinander ab. Eine stärkere Aufsplitterung der Macroscelididae fand ab dem Oberen Oligozän vor rund 23,5 Millionen Jahren statt.[36][37][34]
Innere Systematik der Elefantenspitzmäuse nach Krásová et al. 2021[38]
Unberücksichtigt bleibt die Position von Elephantulus fuscipes, da von der Art bisher kaum genetisches Material vorliegt. |
Molekulargenetischen Analysen aus dem Jahr 2011 ergaben, dass die Elefantenspitzmäuse eine paraphyletische Gruppe formen, da Petrosaltator, Petrodromus und Macroscelides tief in die Gattung Elephantulus eingebettet sind. Allerdings besteht eine durch die genetischen Untersuchungen gut unterstützte Gruppe süd- und ostafrikanischer Arten. Die nächsten Verwandten der Östlichen Klippen-Elefantenspitzmaus sind die Kap-Elefantenspitzmaus (Elephantulus edwardii) und die erst 2008 neu beschriebene Karoo-Klippen-Elefantenspitzmaus (Elephantulus pilicaudus), alle drei Vertreter bilden eine gemeinsame Klade. Etwas außerhalb dieser Verwandtschaftsgruppe stehen weitere Formen des südlichen Afrikas, so die Westliche Klippen-Elefantenspitzmaus (Elephantulus rupestris) ebenso wie die Trockenland-Elefantenspitzmaus (Elephantulus intufi). Möglicherweise waren die Vorfahren der Artengruppe ursprünglich im östlichen Afrika beheimatet. Während einer Phase zunehmender Aridisierung des Kontinentes vor rund 11,5 Millionen Jahren zu Beginn des Oberen Miozäns wanderten sie in Richtung Süden und Südwesten und somit zu den heutigen Verbreitungsgebieten ab. In Folge weitere Austrocknung der Landschaften des südlichen Afrikas im Übergang vom Oberen Miozän zum Pliozän vor rund 6 Millionen Jahren kam es dann zur weiteren Diversifizierung.[36]
Vor allem in der ersten Hälfte des 20. Jahrhunderts wurden einzelne Unterarten beschrieben, etwa E. m. jamesoni (um Johannesburg), E. m. mapogonensis (Limpopo) und E. m. centralis (südliches Verbreitungsgebiet). Es sind jedoch keine starken morphologischen Unterschiede etwa in der Fellfärbung erkennbar, sodass diese meist nicht anerkannt werden. Lediglich eine Abnahme der Größe von Süd nach Nord (messbar in der Länge der oberen Zahnreihe) konnte festgestellt werden. Dies wird aber als nicht ausreichend zur Abtrennung von Unterarten angesehen. Allerdings könnte E. m. fitzsimonsi aus der Nähe von Nyanga in Simbabwe eine von der Nominatform abweichende Unterart sein. Sie zeichnet sich durch eine mehr graue Rückenfärbung, eine schwarze Schwanzoberseite und einen deutlicheren gelblichbraunen Fleck hinter dem Ohr aus.[6][3] Fossilfunde der Östlichen Klippen-Elefantenspitzmaus sind nicht bekannt.[39]
Die wissenschaftliche Erstbeschreibung der Östlichen Klippen-Elefantenspitzmaus datiert in das Jahr 1906. Sie wurde von Oldfield Thomas und Harold Schwann durchgeführt, wobei ihnen ein weibliches Exemplar von 12,7 cm Körperlänge und 15,4 cm Schwanzlänge zur Verfügung stand. Dieses war Mitte Mai 1905 in Woodbush in der Provinz Limpopo im nordöstlichen Südafrika gefangen worden, der Ort stellt auch die Typusregion dar. Beide Autoren sahen die Östliche Klippen-Elefantenspitzmaus aber als Unterart der Westlichen Klippen-Elefantenspitzmaus an. Die Unterschiede zur westlichen Art liegen in einem weniger stark behaarten Schwanz und den fehlenden Haarbusch am Schwanzende. Darauf bezieht sich auch der Artname myurus, der aus dem Griechischen stammt (μείουρος oder μύουρος) und so viel wie „kurzschwänzig“ oder „mäuseschwänzig“ bedeutet.[5] Erst im Jahr 1935 hob Austin Roberts die östliche Form auf Artebene an.[40] In den 1950er und 1960er Jahren wurde die Kap-Elefantenspitzmaus teilweise der Östlichen Klippen-Elefantenspitzmaus zugewiesen. Jedoch bestehen zahlreiche diagnostische Zahnmerkmale zur Unterscheidung der beiden Arten.[2]
Bedrohung und Schutz
Es sind derzeit keine größeren Bestandsbedrohungen für die Östliche Klippen-Elefantenspitzmaus bekannt. Der bevorzugte Landschaftsraum mit hauptsächlich felsigem oder steinigem Untergrund ist kaum von Überprägungen durch menschliche Aktivitäten betroffen. Daher, und aufgrund der weiten Verbreitung im südöstlichen Afrika, stuft die IUCN die Art als „nicht gefährdet“ (least concern) ein. Sie ist in mehreren geschützten Gebieten präsent.[41][3]
Literatur
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 (S. 233–234) ISBN 978-84-16728-08-4.
- Mike Perrin und Galen B. Rathbun: Elephantulus myurus Eastern Rock Sengi (Eastern Rock Elephant-shrew). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 270–271.
- Galen B. Rathbun: Elephantulus myurus Thomas & Schwann, 1906 – Eastern Rock elephant-shrew. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 31–33.
- Galen Rathbun und Hanneline Smit-Robinson: Elephantulus myurus – Eastern Rock Sengi. The Red List of Mammals of South Africa, Lesotho and Swaziland, 2016 ().
Einzelnachweise
- K. Medger, C. T. Chimimba und N. C. Bennett: Seasonal reproduction in the eastern rock elephant-shrew: influenced by rainfall and ambient temperature? In: Journal of Zoology 288, 2012, S. 283–293.
- Galen B. Rathbun: Elephantulus myurus Thomas & Schwann, 1906 – Eastern Rock elephant-shrew. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 31–33.
- Mike Perrin und Galen B. Rathbun: Elephantulus myurus Eastern Rock Sengi (Eastern Rock Elephant-shrew). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 270–271.
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 (S. 233–234) ISBN 978-84-16728-08-4.
- Oldfield Thomas und Harold Schwann: The Rudd exploitation of South Africa. V. List of mammals obtained by Mr. Grant in the North East Transvaal. In: Proceedings of the Zoological Society of London 1906, S. 575–591 ().
- G. B. Corbet und J. Hanks: A revision of the elephant-shrews, Family Macroscelididae. In: Bulletin of the British Museum (Natural History) Zoology 16, 1968, S. 47–111.
- C. D. Lynch: The mammals of Lesotho. In: Navorsinge van die Nasionale Museum, Bloemfontein 10 (7), 1994, S. 177–241.
- Galen Rathbun und Hanneline Smit-Robinson: Elephantulus myurus – Eastern Rock Sengi. The Red List of Mammals of South Africa, Lesotho and Swaziland, 2016.
- I. van der Merwe, M. K. Oosthuizen, N. C. Bennett und C. T. Chimimba: Circadian rhythms of locomotor activity in captive eastern rock sengi. In: Journal of Zoology 286, 2012, S. 250–257.
- David O. Ribble und Michael R. Perrin: Social organization of the Eastern Rock Elephant-shrew (Elephantulus myurus): the evidence for mate guarding. In: Belgian Journal of Zoology 135 (suppl.), 2005, S. 167–173.
- Sasha Hoffmann, Nigel C. Bennett, Bettine Jansen van Vuuren und Heike Lutermann: Space use and the evolution of social monogamy in eastern rock sengis. In: Ethology 126 (4), 2020, S. 393–402, doi:10.1111/eth.12983.
- Gea Olbricht, Alexander Sliwa und Nico L. Avenant: Sengi research in the Free State, South Africa. In: Afrotherian Conservation 9, 2012, S. 7–8.
- A. S. Faurie, E. R. Dempster und M. R. Perrin: Footdrumming patterns of southern African elephant-shrews. In: Mammalia 60 (4), 1996, S. 567–576.
- Sara Churchfield: A note on the diet of the rock elephant shrew, Elephantulus myurus, in Zimbabwe. In: Journal of Zoology 213, 1987, S. 743–745.
- Mohammad A. Abu Baker und Joel S. Brown: Patch use behaviour of Elephantulus myurus and Micaelamys namaquensis: the role of diet, foraging substrates and escape substrates. In: African Journal of Ecolology 50, 2011, S. 167–175.
- Nomakwezi Mzilikazi und Barry G. Lovegrove: Daily torpor during the active phase in free-ranging rock elephant shrews (Elephantulus myurus). In: Journal of Zoology 267, 2005, S. 103–111.
- B. G. Lovegrove, J. Raman und M. R. Perrin: Heterothermy in elephant shrews, Elephantulus spp. (Macroscelidea): daily torpor or hibernation. In: Journal of Comparative Physiology 171, 2001, S. 1–10.
- Nomakwezi Mzilikazi, Barry G. Lovegrove und David O. Ribble: Exogenous passive heating during torpor arousal in free-ranging rock elephant shrews, Elephantulus myurus. In: Oecologia 133, 2002, S. 307–314.
- B. G. Lovegrove, J. Raman und M. R. Perrin: Daily torpor in elephant shrews (Macroscelidae: Elephantulus spp.) in response to food deprivation. In: Journal of Comparative Physiology 171, 2001, S. 11–21.
- K. Medger, C. T. Chimimba und N. C. Bennett: Is reproduction of male eastern rock sengis (Elephantulus myurus) from southern Africa affected by photoperiod? In: Canadian Journal of Zoology 94 (11), 2016, S. 747–752.
- Zelda G. Stoch: The Male Genital System and Reproductive Cycle of Elephantulus myurus jamesoni (Chubb). In: Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 238 (653), 1954, S. 99–126.
- P. F. Woodall und J. D. Skinner: Seasonality of reproduction in male rock elephant shrews, Elephantulus myurus. In: Journal of Zoology 217, 1989, S. 203–212.
- C. J. van der Horst: Elephantulus Going into Anoestrus; Menstruation and Abortion. In: Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 238 (653), 1954, S. 27–61.
- B. R. Neal: The ecology and reproduction of the Short-snouted Elephant-Shrew, Elephantulus brachyrhynchus, in Zimbabwe with a review of the reproductive ecology of the genus Elephantulus. In: Mammal Review 25, 1995, S. 51–60.
- H. R. H. Tripp: Captive, laboratory care and breeding of Elephant-shrews (Macroscelididae). In: Laboratory Animals 6, 1972, S. 213–224.
- Gea Olbricht: Longevity and fecundity in sengis (Macroscelidea). Afrotherian Conservation 5, 2007, S. 3–5.
- J. H. van Wyk: The diet of the Rhombic Skaapsteker, Psammophylas rhombeatus rhombeatus (Serpentes: Colubridae). In: Navorsinge Van Die Nasionale Museum Bloemfontein 5 (16), 1988, S. 455–470.
- Heike Lutermann, Katarina Medger und Ivan G. Horak: Effects of life-history traits on parasitism in a monogamous mammal, the eastern rock sengi (Elephantulus myurus). In: Naturwissenschaften 99, 2012, S. 103–110.
- Heike Lutermann, Katarina Medger und Ivan G. Horak: Abiotic and biotic determinants of tick burdens in the eastern rock sengi (Elephantulus myurus). In: Medical and Veterinary Entomology 26, 2012, S. 255–262.
- Alan Harrison, Armanda D. S. Bastos, Katarina Medger und Nigel C. Bennett: Eastern rock sengis as reservoir hosts of Anaplasma bovis in South Africa. In: Ticks and Tick-Borne Diseases 5, 2013, S. 503–505.
- Alan Harrison, Kevin J. Bown und Ivan G. Horak: Detection of Anaplasma bovis in an undescribed Tick species collected from the Eastern Rock Sengi Elephantulus myurus. In: Journal of Parasitology 97 (6), 2011, S. 1012–1016.
- L. J. Fourie, J. S. du Toit, D. J. Kok und I. G. Horak: Arthropod parasites of elephant-shrews, with particular reference of ticks. In: Mammal Review 25, 1995, S. 31–37.
- Heike Lutermann, Katarina Medger und Kerstin Junker: Endoparasites of the eastern rock sengi (Elephantulus myurus) from South Africa. In: Journal of Parasitology 101 (6), 2015, S. 677–681.
- Steven Heritage, Houssein Rayaleh, Djama G. Awaleh und Galen B. Rathbun: New records of a lost species and a geographic range expansion for sengis in the Horn of Africa. In: PeerJ 8, 2020, S. e9652, doi:10.7717/peerj.9652.
- Brigitte Senut und Martin Pickford: Micro-cursorial mammals from the late Eocene tufas at Eocliff, Namibia. In: Communications of the Geological Survey of Namibia 23, 2021, S. 90–160.
- Hanneline Adri Smit, Bettine Jansen van Vuuren, P. C. M. O’Brien, M. Ferguson-Smith, F. Yang und T. J. Robinson: Phylogenetic relationships of elephant-shrews (Afrotheria, Macroscelididae). In: Journal of Zoology 284, 2011, S. 133–143.
- Mike Perrin und Galen B. Rathbun: Order Macroscelidea – Sengis (Elephant-shrews). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 258–260.
- Jarmila Krásová, Ondřej Mikula, Radim Šumbera, Sylvie Horáková, Jan Robovský, Danila S. Kostin, Aleksey A. Martynov, Leonid A. Lavrenchenko und Josef Bryja: The Rufous Sengi is not Elephantulus – Multilocus reconstruction of evolutionary history of sengis from the subfamily Macroscelidinae. In: Journal of Zoological Systematics and Evolutionary Research 59 (4), 2021, S. 918–932, doi:10.1111/jzs.12460.
- Patricia A. Holroyd: Macroscelidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 89–98.
- Austin Roberts: Scientific results of the Vernay-Lang Kalahari Expedition, March to September 1930. Mammals. In: Annals of the Transvaal Museum 16 (1), 1935, S. 187–249 (PDF Teil 1) (PDF Teil 2).
- C. Stuart, C. FitzGibbon, M. Perrin (IUCN SSC Afrotheria Specialist Group) und H. Smit (Stellenbosch University): Elephantulus myurus. The IUCN Red List of Threatened Species. Version 2014.3 (); zuletzt abgerufen am 20. Februar 2015.
Weblinks
- Elephantulus myurus in der Roten Liste gefährdeter Arten der IUCN 2014.3. Eingestellt von: Stuart, FitzGibbon, Perrin & Smit, 2008. Abgerufen am 20. Februar 2015.