Kap-Elefantenspitzmaus
Die Kap-Elefantenspitzmaus (Elephantulus edwardii) ist eine Art der Elefantenspitzmäuse aus der Ordnung der Rüsselspringer (Macroscelidea). Sie ist endemisch im südlichen und westlichen Teil von Südafrika verbreitet, wo sie überwiegend die trockenen Landschaften der Karoo, aber auch des stärker bewachsenen Fynbos bewohnt. Das kleine Säugetier ist wie alle Elefantenspitzmäuse durch seine rüsselartig verlängerte Nase und durch kurze Vorder- und lange Hinterbeine gekennzeichnet. Als spezialisierter und flinker Bodenbewohner ist die Art an steinigen und felsigen Untergrund angepasst. Die Tiere leben einzeln oder in monogamen Paaren, ein Wurf umfasst im Durchschnitt zwei Jungen. Die Hauptnahrung besteht aus Insekten und Pflanzenteilen, womit die Kap-Elefantenspitzmaus einen Allesfresser darstellt. Bei ihrer Suche nach Nahrung fungiert sie aber auch als Bestäuber einiger Pflanzen. Die Erstbeschreibung der Art erfolgte 1839. Teilweise galt sie als synonym mit der Östlichen Klippen-Elefantenspitzmaus. Allgemein ist die Kap-Elefantenspitzmaus nicht sehr häufig, ihr Bestand wird aber nicht als bedroht angesehen.
| Kap-Elefantenspitzmaus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Kap-Elefantenspitzmaus (Elephantulus edwardii) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Elephantulus edwardii | ||||||||||||
| (A. Smith, 1839) |
Beschreibung
Habitus
Die Kap-Elefantenspitzmaus gehört zu den mittelgroßen Vertretern der Elefantenspitzmäuse und besitzt eine Gesamtlänge von 22,0 bis 28,8 cm. Davon entfallen zwischen 11,5 und 14,9 cm auf den Schwanz, der somit gleichlang oder etwas länger als der restliche Körper ist. Das Gewicht variiert von 36 bis 65 g. Männliche Tiere sind mit durchschnittlich 47 g etwas leichter als weibliche, die im Mittel rund 55 g wiegen können. Untersuchungen von wenigstens 90 Individuen auf dem Bokkeveld-Plateau im westlichen Südafrika erbrachten Kopf-Rumpf-Längen von 9,4 bis 12,5 cm und Schwanzlängen von 11,7 bis 16 cm bei einem Gewicht von 37 bis 83 g.[1] Wie alle Elefantenspitzmäuse zeichnet sich auch die Kap-Elefantenspitzmaus durch ihre geringe Körpergröße, den verhältnismäßig großen Kopf mit der rüsselartig verlängerten Nase und den dünnen Beinen aus, wobei die Vorderbeine deutlich kürzer sind als die Hinterbeine. Das Fell ist sehr weich und besteht aus langen Haaren. Es zeigt am Rücken und auf dem Kopf eine braungraue Färbung, die an den Rumpfseiten und an den Wangen in ein Aschgrau übergeht, das zusätzlich gelblich-grau meliert sein kann. Dadurch unterscheidet sich die Art von der sympatrisch vorkommenden Karoo-Klippen-Elefantenspitzmaus (Elephantulus pilicaudus), bei der die Rückenfärbung auf die Flanken herunterzieht. Am Bauch dominieren hellgraue bis weißliche Farbtöne, die Haarbasen sind hier aber dunkler gefärbt. Die Oberseite des Rüssels und die Vibrissen sind schwarz, das Kinn dagegen erscheint gräulich-weiß. Eine ähnliche helle Färbung besitzen auch die markanten Augenringe, die die großen Augen im Gegensatz zu den Augen der Karoo-Klippen-Elefantenspitzmaus und von der Westlichen Klippen-Elefantenspitzmaus (Elephantulus rupestris) vollständig umgeben.[2] Die Ohren erreichen eine Länge von 25 bis 33 mm und sind dadurch verhältnismäßig groß. Sie zeigen gerundete Spitzen, breite Basen und einen gut entwickelten Tragus. Hinter den Ohren treten gelblich-braune Farbflecken auf. Der lange Schwanz ist im vorderen Bereich oberseits dunkel, unterseits heller getönt, der hintere Teil ist vollständig dunkel. Die Haare des dichten Schwanzfells sind kurz, werden aber nach hinten länger und formen an der Spitze einen dichten Busch. Dieser ist aber weniger deutlich ausgebildet als bei der Karoo-Klippen-Elefantenspitzmaus oder bei der Westlichen Klippen-Elefantenspitzmaus. Die vorderen und hinteren Gliedmaßen enden in jeweils fünfstrahligen Händen und Füßen, die mit Krallen bewehrt sind. Der Hinterfuß weist dabei Längen von 33 bis 39 mm auf.[3][4][5]
Schädel- und Gebissmerkmale
Der Schädel wird zwischen 33 und 38 mm lang, an den Jochbögen beträgt die Breite 18,7 bis 20,5 mm. Die Paukenblase ist abweichend zur Westlichen Klippen-Elefantenspitzmaus leicht geschwollen, die Knochennaht zwischen Oberkiefer und Mittelkieferknochen verläuft weitgehend gerade. Die Zahnformel lautet: . Das Gebiss umfasst damit 40 Zähne. Die oberen Schneidezähne sind etwa gleich groß, der jeweils mittlere (I2) kann aber auch geringfügig kleiner werden. Der Eckzahn zeigt eine molarenartige Gestaltung. Der erste Prämolar ist einwurzelig und besitzt nur eine Spitze auf der Kaufläche, dem zweiten Prämolar fehlen die zungenseitigen Höckerchen. Die Gesamtlänge der Zahnreihe vom ersten Schneidezahn bis zum letzten Molaren liegt bei durchschnittlich 18,3 mm.[6][4][5]
Verbreitung
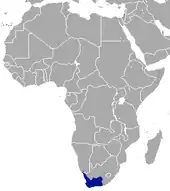
Die Kap-Elefantenspitzmaus kommt endemisch im südwestlichen Afrika vor. Das Verbreitungsgebiet reicht vom Fluss Oranje im Nordwesten, wo er die Grenze zwischen Namibia und Südafrika bildet, in einem halbmondförmigen Bogen entlang der Kapregion Südafrikas bis etwa nach Port Elizabeth im Osten, die Größe liegt bei rund 130.000 km². Es umfasst somit den westlichen Teil der südafrikanischen Provinz Nordkap, die Provinz Westkap und den westlichsten Bereich der Provinz Ostkap. Eine ursprünglich angenommene Verbreitungslücke in der Provinz Westkap[6] konnte nicht bestätigt werden. Die besiedelten Landschaftsräume stellen die halbwüstenartigen Regionen der Karoo und die der stärker bewachsenen Fynbos-Biozone dar. Insgesamt besiedelt die Kap-Elefantenspitzmaus vor allem stark von felsig-steinigem, teilweise auch von sandigem Untergrund geprägte Habitate mit wenig und zumeist niedriger Vegetation. Allerdings scheint sie Gebiete mit Winterregen und einer etwas stärker durchfeuchteten Luft zu bevorzugen, da sie nördlich des Flusses Oranje in Namibia, wo weitaus trockenere Bedingungen und üblicherweise Sommerregen vorherrschen, bisher nicht nachgewiesen ist.[7] Die Größe des Bestandes ist unbekannt, lokal gilt die Art als nicht sehr häufig.[3][4][8] Im Namaqua-Nationalpark im nordwestlichen Verbreitungsgebiet konnte die Populationsdichte in verschiedenen Biotopen untersucht werden. So kommen in der trockenen Sukkulenten-Karoo, die hier von felsigen, domartig gestalteten Granithügeln und einem Bewuchs bestehend aus Pflanzengemeinschaften von Mittagsblumengewächsen geprägt ist, etwa 5,9 Individuen je Hektar vor. Im anschließenden Renosterveld-Landschaftsraum als Teilgebiet des Fynbos mit dichterer Vegetation, die aber auf sandig-lehmigen Böden gedeiht, geht die Dichte auf 0,5 Individuen je Hektar zurück.[9] In den Riviersonderendbergen im Süden von Westkap konnte eine Individuendichte von 2,3 bis 3,0 auf einer vergleichbar großen Fläche ermittelt werden. Teile des Verbreitungsgebietes der Kap-Elefantenspitzmaus überschneiden sich unter anderem mit denen der Karoo-Klippen-Elefantenspitzmaus (Elephantulus pilicaudus) und der Westlichen Klippen-Elefantenspitzmaus (Elephantulus rupestris); ob die Arten tatsächlich dieselben Lebensräume nutzen, ist nicht bekannt.[2][5]
Lebensweise
Territorialverhalten
Die Kap-Elefantenspitzmaus ist überwiegend nachtaktiv, kann aber auch während der Dämmerung oder am Tag auftreten. Bei Aktivitäten am Tag verbringt sie die heißeste Phase in schattigen Felsspalten.[10][1] Vor allem an kühleren Tagen nehmen einzelne Individuen auch Sonnenbäder. Die Art lebt bodenbewohnend und kann sich sehr schnell vierfüßig-springend fortbewegen (cursorial). Die dabei erreichten Geschwindigkeiten liegen bei 19,4 km/h.[11] Die Tiere treten häufig allein oder paarweise auf, wahrscheinlich bilden sie wie andere Rüsselspringer auch monogame Paare. Sie bewegen sich in Aktionsräumen, die möglicherweise sehr groß sind.[12] In den Streifgebieten verteilt befinden sich mehrere Unterschlupfmöglichkeiten in Form von Felsspalten und -ritzen. Spezielle Nester werden in diesen aber nicht gebaut.[13] Bei der innerartlichen Kommunikation kommen neben Duftstoffen aus Drüsen am Fuß und am Hinterteil zur Markierung der Streifgebiete auch verschiedene Klicklaute und ein katzenähnliches „Miau“ zum Einsatz. Hervorzuheben ist zudem ein trommelartiges Geräusch, das mit schnellem Aufschlagen der Hinterbeine erzeugt wird. Dieses Fußtrommeln besteht bei der Kap-Elefantenspitzmaus aus regulären Abfolgen mit einem Abstand von 30 bis 50 ms, in die zusätzlich auch irreguläre Abfolgen mit einem Abstand von 50 bis 130 ms eingestreut sind. Jede Trommelserie besteht aus weniger als zehn Fußschlägen und ist selten länger als zwei Sekunden lang.[14][3][4][5]
Ernährung
Die Kap-Elefantenspitzmaus gilt weitgehend als insekten- bis allesfresserisch, die sich zu einem Großteil von Ameisen und Termiten ernährt, zudem auch von Käfern und Fliegen. Des Weiteren vertilgt sie einen größeren Anteil an Pflanzenmaterial. So lag bei Untersuchungen im Namaqua-Nationalpark der Insektenanteil im Speiseplan bei 44,25 %, Grünpflanzen machten insgesamt 28,50 % aus und die restlichen 27,25 % entfielen auf Samen.[9] Die Insektenjagd erfolgt teilweise durch Warten in schattigen Felsspalten und dann dem schnellen Zuschlagen. Gelegentlich wurde beobachtet, dass die Tiere auch Kothaufen von Schliefern zur Erbeutung von Insekten aufsuchen.[1] Häufiger erfolgt das Aufspüren von Nahrung an Pflanzen. Dabei fungiert die Kap-Elefantenspitzmaus als bedeutender Verbreiter von Pollen, die bei der Insektensuche am Rüssel kleben bleiben und weiter transportiert werden, wie es etwa für die Zuckerbüsche beobachtet wurde.[12][3][4] Auch bei der parasitären Pflanze Hyobanche und dem Spargelgewächs Massonia bifolia konnte der Nachweis der Pollenverbreitung durch die Elefantenspitzmausart erbracht werden. Bei diesen stellt der Nektar der Blüten ein begehrtes Nahrungsmittel dar, den die Tiere mit ihrer langen Zunge abschlecken. Untersuchungen in Kamiesberg zufolge, verweilt die Kap-Elefantenspitzmaus bis zu 7,5 Sekunden an einer einzelnen Blüte und leckt bis zu 28 mal am Nektar.[15] Dabei treten die Tiere als aktive Bestäuber auf, wenn ihre mit Pollen bedeckten Nasen die Narbe der Blüte berühren und diesen so weitergeben. Der Pollen kann aber auch durch Fellpflege in den Verdauungstrakt gelangen und über die Ausscheidungen weiter transportiert werden. Aktiv pollenfressend ist die Kap-Elefantenspitzmaus bisher nicht beobachtet worden, ebenso wie sie keine anderen Blütenteile verzehrt.[16][17][5]
Die täglich aufgenommene Menge ist abhängig von der Qualität und dem Wassergehalt der Nahrung. Sie entspricht aber etwa 22 bis 38 % des Körpergewichts. Wie bei zahlreichen kleinen Säugetieren ist die Verdauungszeit relativ kurz. Bereits nach rund 30 Minuten kann ein Teil der Nahrung wieder ausgeschieden werden. Nach etwa 3 Stunden und 18 Minuten hat etwa die Hälfte der aufgenommenen Nahrung den Verdauungstrakt passiert, nach 6 Stunden gut 90 Prozent.[10] Die Wasseraufnahme erfolgt weitgehend über die Nahrung, die proteinreiche Nahrung führt aber zu einem hohen Verlust an Wasser über den Urin. Um einen stabilen Wasserhaushalt zu ermöglichen, der zudem in den teils deutlich trocken-heißen Klimabedingungen zur Körperkühlung notwendig ist, wird der Urin stark konzentriert. Die Körpertemperatur der Kap-Elefantenspitzmaus ist sehr stabil und liegt bei einer Außentemperatur von 10 bis 35 °C bei durchschnittlich 37,6 °C. Ursprünglich wurde angenommen, dass die Art abweichend von anderen Vertretern der Elefantenspitzmäuse bei niedrigen Umgebungstemperaturen, die im Winter in den Bergen durchaus nahe dem Gefrierpunkt liegen können, nicht in einen Torpor verfällt.[13] Neuere Untersuchungen zeigen aber, dass auch bei der Kap-Elefantenspitzmaus derartige Starrephasen vorkommen können. So tritt der Torpor vereinzelt schon bei Außentemperaturen von unter 25 °C auf, dauert aber meist nur wenige Stunden an. Ab einer Außentemperatur von unter 9 °C können die Tiere über 24 Stunden bis hin zu 44 Stunden im Starrezustand bleiben. Dabei senkt sich die Körpertemperatur bis nahe an die Außentemperatur herab, die tiefste gemessene betrug 9,3 °C. Der Torpor der Kap-Elefantenspitzmaus ist somit vergleichbar mit dem der anderen Elefantenspitzmausarten, allerdings durchschnittlich tiefer und länger. Im Gegensatz aber zu anderen Vertretern der Elefantenspitzmäuse, etwa der Östlichen Klippen-Elefantenspitzmaus (Elephantulus myurus), setzt der Torpor bei der Kap-Elefantenspitzmaus auch dann ein, wenn genügend Nahrung zur Verfügung steht.[18]
Fortpflanzung
Der Nachwuchs wird in der Regel in der wärmeren und feuchteren Jahreszeit geboren. Im westlichen Teil des Verbreitungsgebietes kommen die Jungen dadurch zwischen September und Januar zur Welt, im östlichen Teil kann die Fortpflanzungsperiode noch bis zum Februar anhalten. Ein Wurf umfasst meist zwei, selten nur ein Junges. Die Jungen wiegen zwischen 9 und 11 g, was bei Zwillingsgeburten zusammen etwa 36 bis 43 % des Gewichts des Muttertiers ausmacht. Die Kopf-Rumpf-Länge der Neugeborenen liegt bei 5,2 bis 5,5 cm, die Schwanzlänge bei 5,7 bis 5,9 cm. Sie kommen als Nestflüchter zur Welt und haben geöffnete Augen, ein weiches Fell, durchgebrochene Schneidezähne, freiliegende Ohrmuscheln und getrennte Zehen, zudem können sie schon kurz nach der Geburt laufen. Die Wachstumsrate ist rapide, sodass die Jungen zwischen 0,6 und 0,9 g je Tag zunehmen. Die erste feste Nahrung fressen die Jungtiere nach 12 bis 16 Tagen. Nach rund 30 Tagen haben sie zwei Drittel bis drei Viertel des Gewichts der ausgewachsenen Tiere erreicht.[1][19] Die Lebenserwartung freilebender Individuen ist unbekannt, das Höchstalter in menschlicher Obhut gehaltener Tiere beträgt fünf Jahre und acht Monate.[20][5]
Parasiten
An äußeren Parasiten sind bisher die Laus Polyplax und die Zecken Ixodes, Haemaphysalis und Rhipicephalus beschrieben worden.[21] Das Auftreten von Polyplax ist dabei eher ungewöhnlich, da die Laus üblicherweise mit Nagetieren wie Gerbilliscus in Verbindung gebracht wird.[1]
Systematik
Innere Systematik der Rüsselspringer nach Heritage et al. 2020[22]
|
Die Kap-Elefantenspitzmaus ist eine Art aus der Gattung der Elefantenspitzmäuse (Elephantulus). Dieser recht formenreichen Gattung werden derzeit acht Arten zugerechnet, die in weiten Teilen des südlichen und östlichen Afrikas beheimatet sind. Die Elefantenspitzmäuse gehören zur Ordnung der Rüsselspringer (Macroscelidea). Die Rüsselspringer wiederum bilden eine Gruppe kleinerer Säugetiere, die endemisch in Afrika auftreten. Innerhalb dieser Gruppe können heute zwei Familien unterschieden werden.[23] Den Rhynchocyonidae werden nur die Rüsselhündchen (Rhynchocyon) zugerechnet; sie sind dadurch als monotypisch anzusehen. Bei diesen größten Vertretern der Rüsselspringer handelt es sich um überwiegend an dicht bewaldete Habitate angepasste Tiere. Die Schwestergruppe bilden die Macroscelididae. Ihr gehören sowohl die Elefantenspitzmäuse als auch die Rüsselratte (Petrodromus), die Nordafrikanische Elefantenspitzmaus (Petrosaltator) sowie die Arten der Gattungen Galegeeska und Macroscelides an. Die Vertreter der Macroscelididae bewohnen eher trockenere und offenere Landschaften bis hin zu wüstenartigen Regionen. Molekulargenetische Untersuchungen zeigten, dass sich die beiden Familien im Unteren Oligozän vor etwa 32,8 Millionen Jahren voneinander abtrennten. Innerhalb der Macroscelididae fand eine stärkere Aufsplitterung ab dem Oberen Oligozän vor rund 28,5 Millionen Jahren statt.[24][25][22]
Innere Systematik der Elefantenspitzmäuse nach Krásová et al. 2021[26]
Unberücksichtigt bleibt die Position von Elephantulus fuscipes, da von der Art bisher kaum genetisches Material vorliegt. |

Molekulargenetischen Analysen aus dem Jahr 2011 zeigten, dass die Elefantenspitzmäuse als paraphyletisch angesehen werden müssen, da Petrosaltator, Petrodromus und Macroscelides tief in die Gattung Elephantulus eingebettet sind. Es besteht allerdings eine durch die genetischen Untersuchungen gut unterstützte Gruppe süd- und ostafrikanischer Arten. Als nächste Verwandte der Kap-Elefantenspitzmaus können demnach die erst 2008 neu beschriebene Karoo-Klippen-Elefantenspitzmaus (Elephantulus pilicaudus) und die Östliche Klippen-Elefantenspitzmaus (Elephantulus myurus) angesehen werden; alle drei bilden eine gemeinsame Klade. Etwas außerhalb dieser Verwandtschaftsgruppe stehen weitere Formen aus dem südlichen Afrika, so die Westliche Klippen-Elefantenspitzmaus (Elephantulus rupestris) und die Trockenland-Elefantenspitzmaus (Elephantulus intufi). Es wird angenommen, dass die Vorfahren der Artengruppe wohl ursprünglich im östlichen Afrika beheimatet waren und während einer Phase zunehmender Aridisierung des Kontinentes vor rund 11,5 Millionen Jahren zu Beginn des Oberen Miozäns in Richtung Südwesten und somit zu den heutigen Verbreitungsgebieten abwanderten. Eine weitere Austrocknung der Landschaft des südlichen Afrikas im Oberen Miozän im Übergang zum Pliozän vor rund 6 Millionen Jahren führte dann zur weiteren Diversifizierung.[24]
Unterarten der Kap-Elefantenspitzmaus sind nicht bekannt. Aus genetischer Sicht können aber zwei Untergruppen herausdifferenziert werden, die nach ihrer Verbreitung als Namaqua clade im Norden und als Fynbos clade weiter südlich bezeichnet werden. Die Trennung der beiden Gruppen liegt etwa 1,7 Millionen Jahre zurück; möglicherweise kam es nach der Aufspaltung aber wieder zu einer gewissen Vermischung, da im Kontaktgebiet einzelne Haplotypen gemeinsam auftreten. Gründe für die Aufspaltung der Art könnten in den wechselnden Klimaverhältnissen des Pleistozäns liegen, die fluktuierende Meerwasserstände verursachten, wodurch es zu einem stärkeren Vordringen des Meeres in die westlichen Küstenebenen kam, ebenso wie zu sich verändernden Flussläufen. Teilweise wirkten sich diese schwankenden Klimaverhältnisse besonders stark im südwestlichen Afrika aus, wo es im Verlauf des Pleistozäns zu abwechselnd heftigeren Feucht- und Trockenphasen kam.[27][28]
Fossilfunde der Kap-Elefantenspitzmaus konnten bisher nur an der Saldanha Bay und Elands Bay an der Westküste Südafrikas geborgen werden. Diese gehören dem ausgehenden Jungpleistozän an und sind 15.540 bis 13.300 Jahre alt. Aus der gleichen Region sind auch einige subfossile Reste aus dem Mittleren Holozän überliefert. Der Fundbereich liegt innerhalb des heutigen Verbreitungsgebietes.[29][30]
Die wissenschaftliche Erstbeschreibung der Kap-Elefantenspitzmaus erfolgte im Jahr 1839 durch Andrew Smith unter dem Namen Macroscelides edwardii. Als Typusregion gab Smith ohne weitere Erläuterungen Oliphants River in den zentralen Bereichen der damaligen britischen Kapkolonie an. Gordon Barclay Corbet und John Hanks spezifizierten dies 1968 in ihrer Revision der Rüsselspringer auf den Olifants River in Namaqualand, der in Richtung des Atlantiks fließt, da die Art dort relativ weit verbreitet ist, während sie bei den anderen, namensgleichen Flüssen in Südafrika nicht vorkommt. Der Artname edwardii ehrt Edward Verreaux, den Bruder des französischen Naturforschers Jules Verreaux, der den Holotyp sammelte.[31][6] In den 1950er und 1960er Jahren wurde die Kap-Elefantenspitzmaus teilweise als artgleich mit der Östlichen Klippen-Elefantenspitzmaus aufgefasst (wodurch auch der Olifants River bei Oudtshoorn als Typusgebiet galt). Allerdings konnten zahlreiche diagnostische Zahnmerkmale zur Unterscheidung der beiden Arten herausgearbeitet werden. Als synonyme Bezeichnungen zu Elephantulus edwardii galten lange Zeit E. capensis und E. karoensis, die 1924 beziehungsweise 1938 von Austin Roberts aufgestellt worden waren.[3][4] Genetische Untersuchungen ergaben aber, dass nur E. capensis zur Kap-Elefantenspitzmaus zu stellen ist, während E. karoensis in die Variationsbreite der Westlichen Klippen-Elefantenspitzmaus gehört.[28]
Bedrohung und Schutz
Die Kap-Elefantenspringmaus ist weit verbreitet, aber eher selten. Dennoch sind keine größeren Gefährdungen für den Gesamtbestand bekannt. Lokal kommt es zu Lebensraumveränderungen durch den Ausbau von menschlichen Siedlungen, Acker- und Weideflächen oder zur Mineralgewinnung, wie beispielsweise in den Zederbergen. Diese Überprägungen der Landschaft erfolgen aber vor allem in Flussniederungen und sind als eher kleinräumig zu betrachten. Aufgrund der Spezialisierung der Art auf felsig-steinigen Untergrund, kommt es bisher kaum zu Konflikten. Daher stuft die IUCN die Art als „nicht gefährdet“ (least concern) ein. Sie ist in mehreren Naturschutzgebieten vertreten.[8][3][4]
Literatur
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 (S. 234) ISBN 978-84-16728-08-4
- Mike Perrin und Galen B. Rathbun: Elephantulus edwardii Cape Sengi (Cape Elephant-shrew). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 265–266
- Galen B. Rathbun: Elephantulus edwardii (A. Smith, 1839) - Cape rock elephant-shrew. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 33–34
Einzelnachweise
- C. Stuart, T. Stuart und V. Pereboom: Aspects of the biology of the Cape Sengi, Elephantulus edwardii, from the Western Escarpment, South Africa. Afrotherian Conservation 2, 2003, S. 2–4
- Hanneline Adri Smit, Terence J. Robinson, Johan Watson und Bettine Jansen van Vuuren: A New Species of Elephant-shrew (Afrotheria: Macroscelidea: Elephantulus) from South Africa. Journal of Mammalogy 89 (5), 2008, S. 1257–1268
- Galen B. Rathbun: Elephantulus edwardii (A. Smith, 1839) - Cape rock elephant-shrew. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 33–34
- Mike Perrin und Galen B. Rathbun: Elephantulus edwardii Cape Sengi (Cape Elephant-shrew). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 265–266
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 (S. 234) ISBN 978-84-16728-08-4
- G. B. Corbet und J. Hanks: A revision of the elephant-shrews, Family Macroscelididae. Bulletin of the British Museum (Natural History) Zoology 16, 1968, S. 47–111
- Galen B. Rathbun und Carolyn D. Rathbun: Does the Cape sengi (Elephantulus edwardii) occur in Namibia? Afrotherian Conservation 3, 2005, S. 5–6
- C. Stuart, Mike Perrin, C. FitzGibbon, M. Griffin (IUCN SSC Afrotheria Specialist Group) und H. Smit (Stellenbosch University): Elephantulus edwardii. The IUCN Red List of Threatened Species. Version 2014.3. (); zuletzt abgerufen am 7. Februar 2015
- M. van Deventer und J .A. J. Nel: Habitat, food, and small mammal community structure in Namaqualand. Koedoe 49 (1), 2006, S. 99–109
- P. F. Woodall und G. J. Currie: Food consumption, assimilation and rate of food passage in the Cape rock elephant shrew, Elephantulus edwardii (Macroscelidea: Macroscelidinae). Comparative Biochemistry and Physiology A 92, 1989, S. 75–79
- Barry G. Lovegrove und Metobor O. Mowoe: The evolution of micro-cursoriality in mammals. The Journal of Experimental Biology 217, 2014, S. 1316–1325
- P. A. Fleming und S. W. Nicolson: How important is the relationship between Protea humiflora (Proteaceae) and its non-flying mammal pollinators? Oecologia 132, 2002, S. 361–368
- Belle Leon, Amiram Shkolnik und Tamar Shkolnik: Temperature regulation and water metabolism in the elephant shrew Elephantulus edwardi. Comparative Biochemistry and Physiology A 74, 1983, S. 399–407
- A. S. Faurie, E. R. Dempster und M. R. Perrin: Footdrumming patterns of southern African elephant-shrews. Mammalia 60 (4), 1996, S. 567–576
- Petra Wester: The forgotten pollinators – First evidence for nectar feeding by primarily insectivorous Elephant-shrews: Journal of Pollination Ecology 16 (15), 2015, S. 108–111
- Petra Wester: Nectar feeding by the Cape rock elephant-shrew Elephantulus edwardii (Macroscelidea) — A primarily insectivorous mammal pollinates the parasite Hyobanche atropurpurea (Orobanchaceae). Flora 206, 2011, S. 997–1001
- Petra Wester: Sticky snack for sengis: The Cape rock elephant-shrew, Elephantulus edwardii (Macroscelidea), as a pollinator of the Pagoda lily, Whiteheadia bifolia (Hyacinthaceae). Naturwissenschaften 97, 2010, S. 1107–1112
- Fritz Geiser und Nomakwezi Mzilikazi: Does torpor of elephant shrew differ from that of other hetherothermic mammals? Journal of Mammalogy 92 (2), 2011, S. 452–459
- Edith R. Dempster, M. R. Perrin und R. J. Nuttrall: Postnatal development of three sympatric small mammal species of southern Africa. Zeitschrift für Säugetierkunde 57, 1992, S. 103–111
- Gea Olbricht: Longevity and fecundity in sengis (Macroscelidea). Afrotherian Conservation 5, 2007, S. 3–5
- L. J. Fourie, J. S. du Toit, D. J. Kok und I. G. Horak: Arthropod parasites of elephant-shrews, with particular reference of ticks. Mammal Review 25, 1995, S. 31–37
- Steven Heritage, Houssein Rayaleh, Djama G. Awaleh und Galen B. Rathbun: New records of a lost species and a geographic range expansion for sengis in the Horn of Africa. PeerJ 8, 2020, S. e9652, doi:10.7717/peerj.9652
- Brigitte Senut und Martin Pickford: Micro-cursorial mammals from the late Eocene tufas at Eocliff, Namibia. Communications of the Geological Survey of Namibia 23, 2021, S. 90–160
- Hanneline Adri Smit, Bettine Jansen van Vuuren, P. C. M. O’Brien, M. Ferguson-Smith, F. Yang und T. J. Robinson: Phylogenetic relationships of elephant-shrews (Afrotheria, Macroscelididae). Journal of Zoology 284, 2011, S. 133–143
- Mike Perrin und Galen B. Rathbun: Order Macroscelidea – Sengis (Elephant-shrews). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 258–260
- Jarmila Krásová, Ondřej Mikula, Radim Šumbera, Sylvie Horáková, Jan Robovský, Danila S. Kostin, Aleksey A. Martynov, Leonid A. Lavrenchenko und Josef Bryja: The Rufous Sengi is not Elephantulus – Multilocus reconstruction of evolutionary history of sengis from the subfamily Macroscelidinae. Journal of Zoological Systematics and Evolutionary Research 59 (4), 2021, S. 918–932, doi:10.1111/jzs.12460
- Hanneline Adri Smit, Terence J. Robinson und Bettine Jansen van Vuuren: Vicariance and the endemic Cape rock sengi (Elephantulus edwardii): are these two linked? Afrotherian Conservation 5, 2007, S. 5–7
- Hanneline Adri Smit, Terence J. Robinson und Bettine Jansen van Vuuren: Coalescence methods reveal the impact of vicariance on the spatial genetic structure of Elephantulus edwardii (Afrotheria, macroscelidea). Molecular Ecology 16, 2007, S. 2680–2692
- Thalassa Matthews, Christiane Denysund John E. Parkington: Community evolution of Neogene micromammals from Langebaanweg ‘E’ Quarry and other west coast fossil sites, south-western Cape, South Africa. Palaeogeography, Palaeoclimatology, Palaeoecology 245, 2007, S. 332–352
- Patricia A. Holroyd: Past records of Elephantulus and Macroscelides: geographic and taxonomic issues. Afrotherian Conservation 7, 2009, S. 3–7
- Andrew Smith: Illustrations of the Zoology of South Africa. Mammalia London, 1839 (Tafel 14) ()
Weblinks
- Elephantulus edwardii in der Roten Liste gefährdeter Arten der IUCN 2014.3. Eingestellt von: Stuart, Perrin, FitzGibbon, Griffin & Smit, 2008. Abgerufen am 7. Februar 2015.