Ameisen
Ameisen (Formicidae) sind eine Familie der Insekten innerhalb der Ordnung der Hautflügler. Sie kommen mit mehr als 14.000[1] beschriebenen Arten, und vermutlich 20.000–30.000 Arten insgesamt, in tropischen, subtropischen und gemäßigten Klimazonen aller Kontinente vor. Manche Arten stoßen auch bis in die subarktischen Zonen Sibiriens vor. Der größte Artenreichtum findet sich in den Tropen, in Europa kommen etwa 600 Arten vor, davon etwa 190 in Nord- und Mitteleuropa. Die höchste Biodiversität an Ameisen in Europa findet sich in Spanien und Griechenland, in Irland, Norwegen, Finnland und dem Baltikum findet sich die geringste Artenzahl Europas.[2] Die ältesten fossilen Funde stammen aus der Kreidezeit und werden auf ein Alter von 100 Millionen Jahren datiert. Das Alter der Gruppe wird jedoch auf möglicherweise 130 Millionen Jahre geschätzt.[3] In Mitteleuropa sind die Ameisen mit den Unterfamilien Dolichoderinae, Formicinae, Myrmicinae und Ponerinae vertreten, wobei die Formicinae und vor allem die Myrmicinae den Großteil der Arten stellen.
| Ameisen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Rossameise (Camponotus ligniperda) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Formicidae | ||||||||||||
| Latreille, 1802 |
Wortherkunft
Althochdeutsch āmeiʒa, westgermanisch *ǣmaitjōn (eine rekonstruierte Form, deshalb mit vorangestelltem Sternchen geschrieben) ist eine Zusammensetzung aus althochdeutsch ā bzw. westgermanisch *ǣ ‚ab, weg‘ und einem aus dem Verbalstamm von althochdeutsch meiʒan bzw. westgermanisch *mait-a- ‚schneiden‘ gebildeten Substantiv (vgl. neuhochdeutsch Meißel). Die aus morphologischen Gründen vorzuziehende Erklärung des Wortes ist demnach ‚die aus Abschnitten Bestehende‘, also das Tier, dessen Körper in deutlich sichtbare Abschnitte geteilt ist, was eine Parallele in der Etymologie von Insekt (zu lateinisch īnsecāre ‚einschneiden‘) hat. Weniger wahrscheinlich ist eine Bezeichnung nach dem ‚Abschneiden‘ von Pflanzenteilen, was bei den im germanischen Raum einheimischen Arten ohnehin weniger vorkommt.[4]
Außer im Althochdeutschen[5] ist das Wort auch im Altenglischen als ǣmet(t)e, ǣmytte bezeugt; aus den späteren Sprachstufen ist es mittelhochdeutsch als āmeiʒe, ambeiʒe, emeiʒe usw., mittelniederdeutsch als āmete, ēmete (neuniederdeutsch um das -ken-Suffix erweitert als Imiken, Emken, Inken u. ä.), mittelniederländisch als amete und mittelenglisch amete, emete u. ä. (neuenglisch ant, dialektal emmet) überliefert.[6] Da die Wortbildung schon früh undurchsichtig geworden war, kam es in mittelhochdeutscher Zeit zur Reinterpretation von ameiʒe als ambeiʒe ‚die Anbeißende‘ sowie zu zahlreichen Varianten wie ämbeʒ, onmeiʒ, ommaiʒ, aimsche, eimesse und ähnlich,[7] die schließlich zu den in den heutigen deutschen Mundarten vorkommenden Varianten Ameis, Amois, Amas, Ambeiße, Ämess, Emenz, Emetz(e), Emmer, (H)omeise, O(a)mo(a)s, Omes, Omse, Ometzel, Umbeißi, Wurmbasle – um nur einige Typen zu nennen – führten.[8]
Ein älteres germanisches Wort für die Ameise ist *meuriōn bzw. im Ablautverhältnis hierzu *maura-, das über altwestnordisch maurr, altostnordisch myr(a), mittelniederdeutsch und mittelniederländisch miere, mittelenglisch müre im Neuisländischen und Neunorwegischen als maur, im Neudänischen als myre, im Neuschwedischen als myra und im Neuniederdeutschen sowie Neuniederländisch als mier (bzw. nach dem Geruch der Ameisensäure als Pissmier) weiterlebt. Diese Wurzel ist urverwandt mit lateinisch formīca, das ein älteres *mormīca fortsetzt.[9]
Merkmale
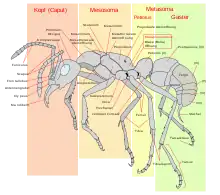
Ameisen haben den typischen in Kopf, Brust (Thorax) und Hinterleib (Abdomen) gegliederten Körperbau der Insekten mit drei Bein- und bei geflügelten Individuen zwei Flügelpaaren. Ameisen leben in arbeitsteiligen Insektenstaaten, die immer in wenigstens drei sogenannte Kasten unterteilt sind, nämlich fruchtbare Weibchen (Königin), fruchtbare Männchen und Arbeiterinnen. Diese Arbeitsteilung spiegelt sich zum Teil in erheblichen Unterschieden im Körperbau (Morphologie) wider. Besonders Königinnen zeigen eine abweichende Gestalt. Ihre Eierstöcke sind im Gegensatz zu denen der übrigen Weibchen voll ausgebildet, weshalb meist der Hinterleib auffallend groß ist. Dagegen ist das Nervensystem, insbesondere das Cerebralganglion („Gehirn“) weniger differenziert, da Königinnen auf Reproduktion spezialisiert sind.[10] Die Größe der Arbeiterinnen der meisten Ameisenarten liegt zwischen 2 und 14 mm, während Männchen und Königinnen doppelt so groß werden können.[11]
Wie bei den übrigen Taillenwespen ist auch bei den Ameisen das erste Abdomensegment mit dem letzten Thoraxsegment verwachsen und bildet eine Wespentaille. Die Ausprägung des Hinterleibsstiels ist bei den Ameisen einzigartig und bildet daher das entscheidende Bestimmungsmerkmal: Das zweite Abdominalsegment, der Petiolus, oder das zweite und dritte Abdomensegment (Postpetiolus) zusammen (wie beispielsweise bei Knotenameisen) bilden einen stielartigen, knotigen oder schuppenartigen Fortsatz, das sogenannte Stielchen. Der anatomische Hinterleib (Abdomen) bildet also einen Teil des mittleren Körperabschnitts (oder Mesosoma), das Stielchen und den hinteren Körperabschnitt. Weil der letzte Körperabschnitt morphologisch nur aus einem Teil des Hinterleibs besteht, wird er zur Unterscheidung als Gaster bezeichnet.[12][13]
Die Mundwerkzeuge bestehen aus Oberlippe (Labrum), paarigem Oberkiefer (Mandibeln), paarigem Unterkiefer (Maxillen) und einer unpaaren Unterlippe (Labium). Sie entsprechen dem ursprünglichen kauend-beißenden Typ. Die Oberkiefer können vielfältig eingesetzt werden. Sie dienen neben der Nahrungsaufnahme auch der Verteidigung, dem Beutegreifen, dem Nahrungstransport, dem Transport von Eiern, Larven, Puppen und sogar Nestgenossinnen beim Umzug einer Kolonie und dem Nestbau.[10]
Die sechs Beine besitzen je zwei Klauen und einen dazwischenliegenden Haftapparat. Die Klauen bieten besten Halt auf rauem Untergrund, während der Haftapparat es dem Tier erlaubt, selbst an senkrechten Glasscheiben hochzuklettern. Die Vorderbeine besitzen am ersten Fußglied eine Fühlerputzscharte.[13][10]
Sinnesorgane

Die geknieten Antennen sind die wichtigsten und vielfältigsten Sinnesorgane der Ameisen. Sie dienen hauptsächlich zum Tasten, Riechen und Schmecken. Ameisen können damit Temperaturänderungen, Luftströmungen und den Kohlendioxidgehalt der Luft wahrnehmen. Wahrscheinlich ist auch der Feuchtesinn auf den Antennen zu finden. Außerdem dienen die Antennen in hohem Maße der taktilen Verständigung zwischen den Individuen.[10][13] Ameisen besitzen meist verhältnismäßig kleine, aber gut ausgebildete Komplexaugen mit typischerweise einigen Hundert Einzelaugen (bei Pogonomyrmex etwa 400, ähnliche Werte bei den meisten anderen Gattungen).[14] Die Zahl der Einzelaugen ist in der Regel bei Geschlechtstieren höher als bei Arbeiterinnen und nimmt allometrisch mit deren Körpergröße zu. Die drei Stirnaugen (Ocelli) sind bei den geflügelten Geschlechtstieren vorhanden, bei den Arbeiterinnen fehlen sie oder sind funktionsuntüchtig (Ausnahme: einige Gattungen mit sehr hochentwickeltem optischen Sinn wie Myrmecia und Harpegnathos). Bei einer Reihe von Arten wurde das Sehen von Farben nachgewiesen. Diese Arten können UV-Licht, aber kein Rotlicht wahrnehmen. Meist sind nur zwei unterschiedlich farbempfindliche Sehpigmente vorhanden (bichromatisches Sehen), viele Gruppen (z. B. Blattschneiderameisen) sind sogar farbenblind. Außerdem wurde die Fähigkeit zur Analyse linear polarisierten Lichts nachgewiesen, wodurch die Tiere auch bei teilbedecktem Himmel den Sonnenstand ermitteln können. Diese Fähigkeit dient vermutlich der Orientierung im Gelände (nachgewiesen bei der Wüstenameise Cataglyphis).[15] Über die Stirnaugen ist nicht viel bekannt. Sie können Hell und Dunkel unterscheiden und ebenfalls ultraviolettes und polarisiertes Licht wahrnehmen. Sie scheinen jedoch keinen wesentlichen Einfluss auf die Orientierungsfähigkeit zu haben. Möglicherweise unterstützen die Stirnaugen nur die Fähigkeiten der Komplexaugen.[10]
Innerer Aufbau
Der Darmtrakt besitzt den für soziale Hautflügler typischen Kropf, eine dehnbare Erweiterung am Ende des Vorderdarms, die durch ein Ventil (Ventiltrichter) mit dem Mitteldarm in Verbindung steht. Die Tiere können so Nahrung nicht nur zum eigenen Nutzen aufnehmen, sondern sie auch kurzzeitig speichern, um anschließend Nestgenossen oder Larven damit zu füttern. Der Kropf wird deshalb auch „sozialer Magen“ der Ameisen genannt.[10]
Ameisen besitzen zahlreiche Drüsen. Die Metapleuraldrüse ist ein einzigartiges Kennzeichen dieser Gruppe. Sie produziert antibiotisch wirksame Substanzen, wodurch den Tieren ein Leben im feuchten Untergrund möglich wird.[13] Königinnen und Arbeiterinnen besitzen immer eine Giftdrüse. Meistens wird das Gift auf das Opfer versprüht. Einige Arten wie die Feuerameisen besitzen einen Giftstachel. Arten der Unterfamilie Formicinae benutzen Ameisensäure zur Verteidigung. Ameisensäuredampf wirkt als Atemgift für viele Kleintiere tödlich. Die meisten anderen Ameisen benutzen Gifte aus zum Teil komplexen Proteingemischen, die neurotoxisch oder histolytisch wirken, teilweise verstärkt durch Histamine (wie beispielsweise Ameisen der Gattung Myrmecia). Feuerameisen nutzen Alkaloide als Gifte. Neben Giften für Angriff oder Verteidigung können auch Alarmsubstanzen und Lockstoffe enthalten sein, durch die Artgenossen benachrichtigt werden können. Sekrete weiterer Drüsen dienen als Futtersäfte zur Ernährung der Königin und der Larven, Botenstoffe, Wegmarkierungen und Hormone, die die Entwicklung der Tiere beeinflussen.[10]
Kasten
Der typische Insektenstaat besteht aus Individuen verschiedener Kasten, fast ausnahmslos Weibchen: Königinnen sowie Arbeiterinnen bzw. Soldatinnen. Gewöhnlich ist nur ein Individuum oder sind wenige Individuen eines Ameisenstaates fruchtbare Weibchen (Monogynie bzw. Oligogynie), manchmal aber auch mehrere tausend (Polygynie).[16]
Neben den Arbeiterinnen und den Königinnen gibt es noch die geflügelten Männchen. Man kann sie beim Hochzeitsflug beobachten. Männchen entstehen nur, um die Jungköniginnen zu begatten.
Die Ameisen mit der typischen Königingestalt, die Vollweibchen (Gynomorphe), werfen in der Regel nach der Begattung ihre Flügel ab und unterscheiden sich dann äußerlich unter anderem in ihrer Größe von den normalen Arbeiterinnen. Ein sicheres Merkmal für die Erkennung einer Königin ist der sogenannte „Königinnenbuckel“. Es gibt allerdings auch bei den sozialparasitären Arten kleine Zwergköniginnen (Mikrogyne), die ihre Flügel behalten. Königinnen mit typischer Arbeiterinnengestalt sind die Ergatomorphen. Bei vielen Ameisenarten gibt es intermorphe Weibchen, die anatomisch eine Zwischenform sind (keine Flügel, aber voll entwickelte Keimdrüsen). Alle drei Formen können theoretisch sowohl als Königin als auch als Arbeiterin fungieren.
Zusätzlich gibt es sehr viele Ameisenarten mit fortpflanzungsfähigen Arbeiterinnen, welche schwach entwickelte Keimdrüsen, leicht unterentwickelte Eierschläuche und meistens gar keinen oder einen stark zurückgebildeten Samensack (Receptaculum seminis) haben. Sie kommen beispielsweise in monogynen Staaten zum Einsatz, wenn die Königin stirbt. Da aber Arbeiterinnen nicht begattet werden, können sie ihre Eier nicht befruchten, und diese kommen daher auf eingeschlechtlichem (parthenogenen) Weg zustande. Deshalb entstehen aus den Eiern der Arbeiterinnen immer nur Männchen.
Innerhalb der Arbeiterinnenkaste kann es zwei bis drei Unterkasten geben, die sich morphologisch unterscheiden, wie die Klein- und Großarbeiterinnen oder Soldaten. Soldaten (zum Beispiel bei den Treiberameisen) haben einen stark vergrößerten Kopf mit sehr großen Mandibeln. Eine extrem ausgeprägte Arbeiterinnenkaste sind die sogenannten Honigtöpfe der nordamerikanischen Honigtopfameisen-Gattung Myrmecocystus, der Schuppenameisen und in abgeschwächter Form der südeuropäischen Art Proformica nasuta, bei denen Tiere als Nahrungsspeicher fungieren: Ihr Kropf füllt die gesamte Gaster aus und wird mit Honig angefüllt.
Systematik

Ameisen zählen zur Insektenordnung der Hautflügler (Hymenoptera). Innerhalb dieser stehen sie als Familie Formicidae in der Überfamilie Vespoidea (Faltenwespenartige), einer Unterordnung der Taillenwespen (Apocrita). Die Ameisen sind also nahe Verwandte der Echten Wespen (Vespinae). Alternativ werden die Ameisen manchmal einer eigenen Überfamilie Formicoidea zugeordnet. Neuere genomische Untersuchungen scheinen diese alternative Einordnung zu unterstützen.[17]
Die Systematik der Ameisen ist noch nicht unumstritten. Bolton unterscheidet 20 rezente Unterfamilien,[18] zu denen 2008 eine 21. Unterfamilie hinzugefügt wurde (Martialinae).[19] Jedoch besteht über diese Aufteilung derzeit keine Einigkeit, da neuere molekularbiologische Studien eine geringere Anzahl von eigenständigen Unterfamilien nahelegen. Diese Untersuchungen legen eine Unterteilung in drei Gruppen nahe: Leptanilloiden (Leptanillinae), Poneroiden (Agroecomyrmecinae, Amblyoponinae, Paraponerinae, Ponerinae und Proceratiinae) und Formicoiden (alle übrigen Unterfamilien).[20][21]
Unterfamilien fossiler und rezenter Ameisen:
(System kombiniert nach Moreau[20] und Ward[21])
| Formicidae |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Evolution, Fossilienlage

Der Ursprung und die frühe Entwicklung der Ameisen ist nach wie vor nicht vollständig geklärt. Aktuelle molekularbiologische Studien stützen aber die Annahme eines monophyletischen Ursprungs, also der Entwicklung der gesamten Gruppe aus einer einzigen Stammform.[20] Die ältesten,# unzweifelhaft den Ameisen zuzuordnenden Fossilien stammen aus der mittleren Kreidezeit (aus dem Albium) und sind etwa hundert Millionen Jahre alt. Schlüsselmerkmal der Zuordnung zu den Ameisen[22] ist die Metapleuraldrüse (oder bei Fossilien: ihrer Öffnung oder ihres Ausführgangs), bedeutsam sind auch das Vorhandensein eines abgesetzten Petiolus und der Bau der Fühler mit langem Schaftglied (Scapus) und im Winkel ("gekniet") daran ansetzender Geißel; außerdem der Hinweis auf eusoziale Lebensweise durch den Fund von Tieren, die als Arbeiterinnen klassifiziert werden können. Dass einzelne Merkmale in die Irre führen können, zeigt die zu den Chrysidoidea gehörende, ausgestorbene Familie Falsiformicidae, die sowohl gekniete Antennen wie auch einen Petiolus besaß.[22]
Die meisten und die ältesten kreidezeitlichen Ameisenfossilien stammen aus Bernstein-Funden in Frankreich und Myanmar (Burma). Diese werden überwiegend der ausgestorbenen Unterfamilie Sphecomyrminae zugeordnet.[22][23] Sphecomyrminae waren entweder Vertreter der Stammgruppe der modernen Ameisen oder deren Schwestergruppe. Von der in Frankreich gefundenen Sphecomyrmine Haidomyrmodes mammuthus wurden Arbeiterinnen und eine Königin im selben Bernsteinstück nebeneinander gefunden, was eine eusoziale Lebensweise nachweist. Wichtigster Unterschied zu den modernen Ameisen (der "Kronengruppe") ist der Bau der Fühler mit kurzem Scapus. Etwa gleich alte Fossilien der ausgestorbenen Armaniinae sind in der Zuordnung weit unsicherer, weil sie nur als Kompressionsfossilien in Kalkstein vorliegen und daher wichtige Merkmale (wie die Metapleuraldrüsen) nicht erkennbar sind.
In gleich alten (oft in den gleichen) Fossillagerstätten, die die Sphecomyrminae lieferten, liegen auch Fossilien von Ameisen vor, die in moderne (rezente) Unterfamilien eingeordnet werden können. Eine der ältesten ist Kyromyrma neffi aus Bernstein aus New Jersey, die zur rezenten Unterfamilie der Formicinae gehört. Kyromyrma ist etwa 92 Millionen Jahre alt. Burmomyrma rossi und Myanmyrma gracilis aus Burma (etwa 99 Millionen Jahre alt) sowie Cananeuretus occidentalis aus Kanada gehören vermutlich zu den Aneuretinae. Von dieser Unterfamilie hat heute nur noch eine einzige Art, Aneuretus simoni, auf der Insel Sri Lanka überlebt. Morphologisch urtümliche rezente Gruppen wie die Bulldoggenameisen (Myrmeciinae), heute nur noch in Australien und Neukaledonien, sind in der fossilen Überlieferung weit verbreitet, aber etwas jünger.
Ameisen sind in der fossilen Überlieferung von der Kreidezeit bis heute fast kontinuierlich häufiger geworden.[21] Während sie in kreidezeitlichen Fossillagerstätten kaum 1 Prozent der Funde ausmachen, sind es im eozänen baltischen Bernstein schon 5 Prozent (aus 118 Arten), im früholigozänen Kalkstein von Florissant 20 Prozent und im miozänen dominikanischen Bernstein 36 Prozent, so dass sie hier die häufigste Tiergruppe überhaupt darstellen. Viele Arten aus dem baltischen und dominikanischen Bernstein können modernen Gattungen zugeordnet werden. Nach den Methoden der molekularen Uhr ermittelte Altersabschätzungen ergaben ein Alter der Ameisen von, je nach Untersuchung, 140–168[20] oder 115–135[24] Millionen Jahren. Es ist jedoch auffallend, dass Ameisen in berühmten und ergiebigen Fossillagerstätten, die älter sind als hundert Millionen Jahre, völlig fehlen, zum Beispiel in der Santana-Formation Brasiliens (die von dort beschriebene Art Cariridris bipetiolata gilt heute nicht mehr als Ameise) oder im libanesischen Bernstein. Hier wird über eine Entwicklung auf dem Urkontinent Laurasia spekuliert, so dass sie in Fundstellen von Gondwana fehlen würden.
Von den heute lebenden Ameisenarten scheint die erst 2008 im brasilianischen Urwald entdeckte Art Martialis heureka (Unterfamilie Martialinae)[19] oder die Unterfamilie Leptanillinae[25] die ursprünglichste Gruppe zu sein.
Ameisen und die Evolutionstheorie altruistischen Verhaltens
Die Arbeiterinnen der Ameisen sind altruistische Lebewesen: Während sie sich selbst nicht fortpflanzen, arbeiten sie „selbstlos“ darauf hin, dass die Königin ihre Gene an Nachkommen weitergeben kann. Darwin war sich des Dilemmas für die Evolutionstheorie bewusst: Wie werden altruistische Gene weitergegeben, wenn sich ihre Träger – die Arbeiterinnen – nie fortpflanzen? Sein Erklärungsversuch: Auch komplette Familienverbände könnten von der Selektion begünstigt werden. 1968 formulierte der britische Biologe William D. Hamilton seine mathematisch gestützte und allgemein anerkannte Theorie der Verwandtenselektion (kin selection). Aufgrund der speziellen Fortpflanzung staatenbildender Insekten sind Ameisenarbeiterinnen zu 75 Prozent miteinander verwandt, also stärker, als es mit einer eigenen Tochter möglich wäre. Deshalb bevorzugt die natürliche Selektion solche Gene, welche die Arbeiterinnen veranlassen, Schwestern und nicht eigene Töchter aufzuziehen – Grundlage des altruistisch sozialen Ameisenstaates.
Lebensweise und Verhalten
Alle bekannten Ameisenarten sind in Staaten organisiert. Sie stellen die bedeutendste Gruppe eusozialer Insekten dar.[19] Ameisenstaaten bestehen aus einigen Dutzend bis mehreren Millionen Individuen. Ameisenstaaten sind arbeitsteilig organisiert und besitzen immer wenigstens drei so genannte Kasten: Arbeiter, Weibchen (Königin) und Männchen. Im Gegensatz zu anderen staatenbildenden Hautflüglern sind bei Ameisen die Arbeiter grundsätzlich flügellos. Nur die geschlechtsreifen Weibchen und Männchen besitzen meist Flügel. Zur Paarung werden bei den meisten Arten beflügelte Weibchen und Männchen aufgezogen, die den elterlichen Bau gleichzeitig in großen Schwärmen verlassen. Bei einigen Verwandtschaftsgruppen und Arten sind allerdings nur die Männchen geflügelt, oder die Vermehrung erfolgt parthenogenetisch, d. h. ohne Männchen. Nach der Paarung sterben die Männchen, während die Weibchen die Flügel abwerfen (oder abbeißen) bzw. verlieren und neue, eigene Kolonien gründen oder in den elterlichen Bau zurückkehren, in dem dann mehrere Königinnen koexistieren.[12]
Ameisen bilden eine große Vielzahl unterschiedlicher Lebensweisen aus, von nomadischen „Jägern“ über „Sammler“ und „Viehzüchter“ bis hin zu Arten, die Pilze als Nahrungsquelle kultivieren: die Blattschneiderameisen (Gattungen Atta und Acromyrmex). Einige Arten betreiben quasi Sklaverei, indem sie Ameisenlarven anderer Arten entführen und später für sich arbeiten lassen (beispielsweise Polyergus rufescens), oder Sozialparasitismus, indem die Weibchen in bestehende Staaten einer anderen Art einwandern und ihre Nachkommen von diesen aufziehen lassen (beispielsweise Anergates atratulus).[12][10]
Ameisenstaaten beeinflussen ihre Umwelt nachhaltig. Sie tragen erheblich zur Umschichtung der oberen Erdschichten bei, unterstützen den Abbau pflanzlichen Materials, verbreiten Pflanzensamen oder regulieren als Räuber die Bestände anderer Arthropoden.[26]
Ameisen sind nicht näher verwandt mit den ebenfalls staatenbildenden Termiten, die einer eigenen Ordnung (Isoptera) angehören und nahe verwandt mit Fangschrecken (Gottesanbeterinnen) und Schaben sind.
Staatenbildung
Die Ameisen zählen zu den eusozialen (staatenbildenden) Insekten. Bei Ameisen gibt es Staaten von kaum mehr als zehn (Dinoponera) bis über 20 Millionen Tieren. Staaten mit nur einer Königin können in der Regel nur so alt werden wie die Königin selbst, da nach deren Tod keine Eier mehr gelegt werden. Königinnen wie die der Roten Waldameise (Formica rufa) können bis zu 25 Jahre alt werden, während die Arbeiterinnen nur selten länger als zwei bis drei Jahre leben. Im Falle der Schwarzen Wegameise (Lasius niger) schätzt man die maximale Lebenserwartung der Königinnen sogar auf 29 Jahre.[27] Bei den meisten Ameisenarten, die geflügelte Königinnen ausbilden, die sich ausschließlich außerhalb des Nests paaren, kann eine Kolonie oder ein Volk niemals älter werden als die begründende Königin. Inzwischen sind aber zahlreiche Arten mit abweichenden Lebenszyklen bekannt, einige Beispiele sind im Kapitel Kasten und Typen weiter unten aufgeführt. Bei zahlreichen Arten sind die Königinnen flügellos und ähneln Arbeiterinnen, bei einigen von ihnen kommt es auch bereits innerhalb des Nests zur Paarung. Werden dann neue Kolonien durch Teilung oder Sprossung, d. h. von jungen Königinnen und einem Teil der Arbeiterinnen der alten Kolonie gemeinsam begründet, ist die Lebensdauer des Staates potenziell unbegrenzt. Der Verwandtschaftsgrad der Arbeiterinnen innerhalb einer Kolonie, im theoretischen Idealfall 0,75, kann auf nahezu jeden Wert bis nahe 0 fallen.[28]
Einige Ameisenarten verbinden zahlreiche Königinnen pro Volk (Polygynie) mit zahlreichen Neststandorten pro Volk, wobei neue Nester durch Sprossung gebildet werden (Polydomie wie z. B. bei Tapinoma melanocephalum). Diese Arten können gewaltige Superkolonien bilden, die sich über Tausende von Kilometern erstrecken und Milliarden von Individuen umfassen, insbesondere dann, wenn die Ameisen als Neozoen in Gebiete eingeschleppt werden, in denen sie vorher nicht heimisch waren.[29] Die Ameisen der verschiedenen Nester sind untereinander nicht aggressiv, sie können frei zwischen den Nestern hin und her wechseln, während Individuen anderer Völker (auch anderer Superkolonien) heftig bekämpft werden. Bei der aus Südamerika stammenden Art Linepithema humile wurden an den Küsten des Mittelmeeres und des Atlantiks zwei solche Superkolonien festgestellt, von denen sich eine von Norditalien bis nach Galicien, auf über 6000 Kilometer Küstenlinie erstreckt.[30] Damit handelt es sich um die größte Kolonie eines mehrzelligen Lebewesens überhaupt.[31]
Nestarten
Die meisten Nester bestehen aus kleinen Holz- oder Pflanzenteilen, Erdkrumen, Harz von Nadelgehölzen oder anderen natürlichen Materialien. Innerhalb einer Ameisenart können verschiedene Nestarten auftreten.
Nester der Ameisen können entweder in natürlichen oder geschaffenen Hohlräume oder frei errichtet werden.[32]
Erdnest



Das Erdnest ist die häufigste Nestart, bei der zumindest der Großteil aller Gänge und Kammern unterhalb der Erdoberfläche liegt. Erdnester sind sehr witterungsanfällig, sodass sie meistens nur an besonders geschützten Stellen wie beispielsweise unter wärmespeichernden Steinen zu finden sind. Manche Arten bilden auch einen Kraterwall um ihr Nest.
Die meisten Erdnester – wie zum Beispiel die der Gelben Wiesenameise (Lasius flavus) – verfügen über eine kleine Kuppel. Solche Erdnester können mehr Sonnenstrahlen auffangen als flache Nester.
Hügelnest mit Streukuppeln

Eine bessere Durchlüftung und zugleich eine bessere Wärmespeicherung bieten die Hügelnester mit Streukuppeln ("Ameisenhaufen"). Diese Nester sind meistens um morsche Baumstümpfe errichtet, die ihnen Halt geben. In solchen Hügeln leben die meisten Arten der Gattung Formica. Die obere Schicht aus Pflanzenteilen schützt das Nest vor Regen und Kälte; die unteren Schichten sind aus Erde. Die Gänge sind so angelegt, dass Wasser an ihnen abperlen kann. In solchen Nestern, die bis zwei Meter hoch werden und einen Durchmesser von fünf Metern erreichen können und nochmal so tief wie hoch sind, gibt es zahlreiche Etagen und Galerien. Solche Nester haben durch ihre pflanzlichen Bestandteile stark mit Pilzen zu kämpfen, weshalb die Ameisen alle ein bis zwei Wochen die Oberfläche des Nestes komplett umgraben. Dies kann man sehr gut beobachten, wenn man etwas Farbe auf dieses sprüht: Nach spätestens zwei Wochen ist diese vollständig verschwunden und taucht nach vier bis sechs Wochen an einer anderen Stelle wieder auf. Im Winter dient der obere Teil der Hügelnester als Frostschutz, während die Ameisen in den tieferen Kammern überwintern.
Holznest
Verschiedene Ameisenarten schneiden mit ihren Mandibeln Nestkammern und Gangsysteme in morsches Totholz, nicht selten auch in das von Pilzen teilabgebaute Kernholz lebender Bäume, denen in ihrem Splintholz noch genügend Wasser- und Nährstoffleitungen zum Überleben bleiben. Die Eingänge befinden sich an Wurzelenden, so dass man dem Stamm das Nest von außen nicht ansehen kann. Vor allem die mitteleuropäische Schwarze Rossameise (Camponotus herculeanus) nagt ausgeprägte Nestkammersysteme, sogenannte Hängende Gärten, in morsche Stämme. Spechte, vor allem der Schwarzspecht, können sie dort aber akustisch orten.
Die kleineren Arten, vor allem die der Gattung Leptothorax, benötigen keine größeren Territorien. Sie nutzen vielmehr kleine Asthöhlungen von diversen Larven oder wohnen in Schneckenhäusern oder Eicheln.
Ameisenpflanzen
Ameisenpflanzen (Myrmecophyten) sind all jene Pflanzen, die von Ameisen als ständiger Wohnraum, zur Ernährung (z. B. Elaiosome) oder zur Fortpflanzung genutzt werden.
Domatien sind Hohlräume in Pflanzen, in denen Ameisen nisten. Meistens bieten die Ameisen den Pflanzen im Gegenzug Schutz vor Fraßfeinden oder Konkurrenten (Myrmekophylaxis). So leben die Arten der tropischen Gattung Tetraponera (Pseudomyrmecinae) und die malaysischen Cataulacus muticus (Myrmicinae) in den hohlen Stängeln zweier Riesenbambusarten. Teilweise züchten Ameisen in den Pflanzen Blattläuse, wie die Arten der Gattung Azteca, die in hohlen, durch Querwände unterteilten Zweigen und Stämmen der Pflanzen der Gattung Cecropia leben.
Weitere Pflanzen, in deren Hohlräumen Ameisen wohnen, sind die der Gattung Myrmecodia, oder die Büffelhornakazie der Spezies Acacia sphaerocephala, in deren hohlen Dornen die Ameisen nisten.
Freinester
Freinester der Ameisen können Biwaknester, Seidennester oder Kartonnester sein.[32]
Biwaknest

Freinester stellen die puristischste "Nestform" dar. Sie sind sehr mobil, meist auch sehr temporär und bestehen nur aus den Ameisen, häufig jeder Entwicklungsstufe, und ihren Ameisengästen.[32] Sie werden von Wander- und Treiberameisen (der Unterfamilien Dorylinae, Aenictinae und Ecitoninae)[33] sowie aus der Ponerinen-Gattung Leptogenys[34] gebildet.
Während Überschwemmungen bilden Feuerameisen (Solenopsis invicta) schwimmende Biwaknester.[35][36] Aus der Nähe betrachtet wirken alle Biwaknester chaotisch.
Kartonnest
Kartonnester sind vor allem bei tropischen Ameisen zu finden, die sie auf dem Boden oder auf Ästen errichten.[32]
Die Glänzendschwarzen Holzameisen (Lasius fuliginosus) bauen als einzige heimische Vertreter Kartonnester in Bäume. Sie zerkleinern dazu kleine Holz- und Erdmaterialien und durchtränken diese geknetete Kartonsubstanz mit aus dem Kropf hervorgewürgtem Honigtau. Diese Baumasse enthält bis zu 50 Prozent Zucker. Darauf züchten sie den Pilz Cladosporium myrmecophilum, der durch seine Hyphen (pilztypisch fadenförmige Zellstruktur) den Nestwänden Stabilität verleiht. Beide Lebewesen leben in Symbiose, denn der Pilz findet so optimale Nahrungsgründe.
Seidennest
_nest_in_Kinnarsani_WS%252C_AP_W_IMG_6012.jpg.webp)
Weberameisen der Gattung Oecophylla bauen ihre Nester mittels des Seidensekrets ihrer Larven, mit dem Blätterbüschel zusammengesponnen werden.[37] Meistens sind diese Nester freihängend.

Polyrhachis dives (fälschlich oft auch als Weberameisen bezeichnet) bauen ihre Nester (mehrere kleinere[38] oder auch sehr große[39]) hauptsächlich aus Seide, die sie oft in Hohlräumen wie Baumhöhlen anbringen oder mit totem organischem Material (Detritus) bedecken oder tarnen.
Orientierung

Außer über ihren Tastsinn und durch Pheromone können sich Ameisen auch anhand der Polarisation des Lichts orientieren. Im Zusammenspiel von der mit der Tageszeit variierenden Ausrichtung der Lichtwellen und einer inneren biologischen Uhr bestimmen die Ameisen ihre Laufrichtung. Die Wüstenameisen Cataglyphis fortis können darüber hinaus aus der von ihnen zurückgelegten Strecke auch die Luftlinie zum Ausgangspunkt (Eingang der unterirdischen Kolonie) ermitteln.
Einige andere Arten orientieren sich auch mittels Ultraschall. Dazu senden sie durch eine Stridulation, nämlich durch Reiben des mit kleinen Häkchen bestückten hinteren Beinpaars am Hinterleib (vgl. das Zirpen bei Grillen), Schallwellen ab acht Kilohertz bis weit in den Ultraschallbereich aus. Diese werden an Gegenständen reflektiert, mit dem Johnstonschen Organ aufgefangen und ausgewertet. Stridulationsklänge können auch durch Auf- und Abbewegungen eines Gastersegments an einer Kante des Postpetiolus entstehen. So können verschüttete Blattschneiderameisen „um Hilfe rufen“ und von Artgenossen gehört und ausgegraben werden.
Kommunikation
Der Informationsaustausch bei Ameisen erfolgt größtenteils chemisch über verschiedene Duftstoffe und taktil durch das Betasten mit den Fühlern.[40] Es gibt für jede Situation Sekrete, zum Beispiel die Alarm-Pheromone, wie das Undecan aus den Dufourschen Drüsen. Diese olfaktorische Kommunikation ist die wichtigste Verständigungsmöglichkeit der Ameisen.
Jede notwendige Information kann auch über Antennenkreuzen weitergegeben werden. So berühren sich die Fühler beispielsweise kurz oder lang und abrupt oder gleitend. Dieses nennt man taktile Kommunikation. Mit dieser Methode kann eine Ameise einer anderen durch Betrillerung signalisieren, dass sie hungrig ist und Kropfnahrung benötigt. Auch wenn eine Ameise eine andere zu einer Nahrungsquelle führt und die Duftspur noch nicht ausreichend intensiv ist, ist diese Art von Kommunikation notwendig. Dabei veranstalten diese beiden Ameisen einen sogenannten Tandemlauf. Durch Betasten der Gaster signalisiert die geführte hintere Ameise ihre Anwesenheit. Ist diese nicht mehr da, wartet die Führerin und versprüht so lange Sekrete, bis sich beide wieder gefunden haben.
Kollektive Intelligenz

Transportieren mehrere Ameisen Beute gemeinsam zum Nest, so beruht das nicht auf einer Absprache, also auf einer kommunikativen Intelligenz. Vielmehr versucht jede Ameise für sich die Beute in Richtung Nest zu schaffen. Sind genug Ameisen herangekommen, um die Beute der Masse nach wegschaffen zu können, und zerren genug Ameisen in etwa dieselbe Richtung, nämlich auf derselben Straße Richtung Nest, so setzt sich der Transportzug automatisch in Bewegung. Je intensiver die Straße durch Pheromone markiert ist, desto besser kommt der Zug voran.
An den Schwarzen Wegameisen wurde nachgewiesen, dass Ameisen sich nicht ausschließlich nach der Pheromonspur (Ameisenstraße) der Gründerameise richten, wenn sie die Beute in Richtung Nest schaffen. Ist eine Passage so eng, dass es zu Kollisionen zwischen den hin- und zurücklaufenden Ameisen kommt, so weichen die heimkehrenden Ameisen auf einen alternativen Weg aus und legen dabei eine praktisch parallele Ameisenstraße an, die sich durch Benutzung verfestigt. Dass die heimkehrenden Ameisen ausweichen, dürfte damit begründet sein, dass ihr Orientierungssinn ausreicht, um auch ohne Pheromonspur die Richtung zum Nest zu bestimmen, was für die an unbekanntem Ort liegende Beute nicht gilt: Diese ist nur durch die Pheromonspur zu finden.
Ein interessantes Beispiel für kollektive Intelligenz liefert die Ameisenart Cataulacus muticus. Diese Ameisen leben im Inneren einer Bambusart. Wenn Regen einsetzt, schützen sie sich vor Hochwasser, indem eine Ameise das Eingangsloch im hohlen Stamm von innen, einem Korken gleich, mit ihrem Kopf verriegelt. Zudem wird eingedrungenes Wasser aufgenommen und nach dem Regen außerhalb ausgeschieden (geprägte Bezeichnung: „Kollektivpinkeln“).[41]
Organisation des Ameisenstaates und Reizsteuerung
Eng im Zusammenhang mit der „kollektiven Intelligenz“ steht die Reizsteuerung. Auch wenn bei den reproduktiven Weibchen im Ameisenvolk von „Königinnen“ gesprochen wird, bedeutet das nicht, dass diese auch über das Volk herrschen. In einem Ameisenstaat gibt es keine zentrale Obrigkeit im Sinne einer Monarchie. Die Lebensweise und das Verhalten von Ameisen wird durch „Reize“ gesteuert, denen gefolgt wird, sofern sie eine bestimmte Reizschwelle überschreiten. Solche Reize können sowohl von der Umwelt als auch von den Individuen eines Ameisenvolkes selbst abgegeben werden. Ein einfaches Beispiel ist hierbei das Finden einer Nahrungsquelle. Wenn eine Ameise eine Nahrungsquelle entdeckt, speichert sie in der Regel einen Teil dieser Nahrung in ihrem sozialen Magen, läuft zum Nest zurück (wobei mit Pheromonen eine Duftspur gelegt wird) und verteilt dieses Futter teilweise an ihre Nestgenossinnen. Wenn diese die Nahrung für geeignet befinden und der „Hunger“ des Volkes entsprechend groß ist (wenn also der spezifische Reiz eine gewisse Reizschwelle übersteigt), werden diese Ameisen der Duftspur in Richtung der Nahrungsquelle zurückverfolgen. Die Duftspur wird immer stärker (es entstehen stark frequentierte Ameisenstraßen), und immer mehr Arbeiterinnen werden ihr folgen. Die Nahrungsquelle wird ausgebeutet. Sollte die Nahrungsquelle für ungeeignet befunden werden oder ausreichend Futter in dem Volk vorhanden sein, werden nur wenige oder keine Arbeiterinnen der Duftspur zur Nahrungsquelle folgen. Diese wird bald nicht mehr wahrgenommen.[42] Die Organisation eines Ameisenvolkes ist somit von interaktiven, reizgesteuerten Mehrheitsentscheidungen, die durch die kollektive Intelligenz getroffen werden, geprägt.
Staatenentwicklung

Man unterscheidet bei Ameisenarten zwei prinzipiell unterschiedliche Arten der Staatengründung: Entweder wird eine neue Kolonie unabhängig durch ein weibliches Geschlechtstier (die zukünftige Königin) begründet, oder bei der Gründung wird die junge Königin bereits von Arbeiterinnen begleitet. In diesem Fall entsteht eine neue Kolonie durch Nestteilung (oder Sprossung) aus einer schon bestehenden. Koloniegründung durch Sprossung erfolgt ausschließlich zu Fuß (da Arbeiterinnen niemals fliegen können), die neue Kolonie kann von einer, oder von vielen, Jungköniginnen begleitet werden. Unabhängige Koloniegründung erfolgt meist (aber nicht immer) einzeln durch geflügelte Königinnen. Auch bei Arten mit Koloniegründung durch Nestteilung sind aber die männlichen Geschlechtstiere meist geflügelt, um Inzucht zu vermeiden. Auch bei Arten mit unabhängiger Koloniegründung können aber, zusätzlich zu den geflügelten Geschlechtstieren, ungeflügelte Königinnen oder Ersatz-Geschlechtstiere vorhanden sein, die hier nur die Lebensdauer einer bestehenden Kolonie über den Tod der Gründerin hinaus verlängern können.[43]
Selbstständige Staatengründung
Die häufigste Variante ist die selbstständige Staatengründung. Sie wird in Mitteleuropa von schätzungsweise 65 Prozent der Arten betrieben. Bei dieser Form sucht sich ein begattetes Weibchen einen geeigneten Nistplatz, legt eine kleine abgeschlossene Höhlung, Claustra (von lateinisch claustra ‚Hochburg‘, bei Livius[44] ‚Tierunterkunft‘) genannt, an und legt dort ihre Eier. Die Brut wird von ihr selbstständig gefüttert und gepflegt. Man unterscheidet bei der unabhängigen Staatengründung zwischen claustraler Gründung, ohne Futteraufnahme, und semiclaustraler Gründung, mit Futteraufnahme zwischendurch außerhalb der Claustra.
Die Koloniegründerinnen der meisten Arten, vor allem der größeren, brauchen während der Brutzeit nicht auf Nahrungssuche zu gehen. Wenn ihre Kropfnahrung aufgebraucht ist, bauen sie ihre Fettreserven und kräftige Flugmuskulatur ab, die sie nach dem Hochzeitsflug nicht mehr benötigen, und sind dadurch in der Lage, Futtersekrete für die Larven herzustellen. So sind zum Beispiel Königinnen von Lasius niger durch eingelagerte Reservestoffe 15,5 Milligramm schwer, während frisch geschlüpfte Königinnen nur 4 Milligramm wiegen.[43] Reicht auch das nicht aus, so frisst die Königin einen Teil ihrer Eier, um diese wieder zu verwerten und sicherzustellen, dass sich zumindest einige Arbeiterinnen entwickeln und somit bei der Versorgung helfen können.
Bei den kleineren Arten und solchen mit geringem Größenunterschied zwischen Königinnen und Arbeiterinnen haben die Jungköniginnen nicht genug körpereigene Reserven. Daher müssen sie sich hin und wieder auf Nahrungssuche begeben. Weil sie sich dabei mehr als die größeren Arten der Gefahr aussetzen müssen, dass ihre unbewachte Brut oder sie selbst gefressen werden, gelingt es nur wenigen der zu Tausenden ausgeschwärmten Jungköniginnen, erfolgreich einen eigenen Staat zu gründen.
Mit den ersten geschlüpften Arbeiterinnen, die oft kleiner sind als die späteren, wird allmählich der neue Staat gegründet. Nun versorgt nicht mehr die Königin den Nachwuchs; sie widmet sich vielmehr ausschließlich dem Eierlegen. Die Arbeiterinnen übernehmen nun alle anderen Aufgaben, sei es die Brutpflege, die Nahrungssuche oder den Nestbau. Eine solche Koloniegründung kann auch gemeinsam durch mehrere Königinnen stattfinden (genannt: Pleometrosis), wobei sie die Brut gemeinsam großziehen. Der daraus resultierende Staat bleibt dann entweder polygyn, oder die Königinnen entscheiden mittels Kämpfen über die Hierarchie, wobei nur die dominante fruchtbar bleibt und die anderen zu Arbeiterinnen werden, wenn nicht gar eine Königin alle anderen tötet, woraus sich nachträglich eine sogenannte funktionelle Monogynie ergibt.
Nestteilung
Bei der Nesterteilung verlässt eine einzelne oder eine Gruppe von Jungköniginnen gemeinsam mit einer Gruppe von Arbeiterinnen die mütterliche Kolonie. Durch den Startvorteil am Anfang ist bei ihnen die Sterblichkeit geringer. Da aber keine Ausbreitungsflüge durch Jungköniginnen mehr stattfinden, sind diese Arten in ihrer Ausbreitungsfähigkeit benachteiligt, so können sie zum Beispiel keine Inseln erreichen. Die Völker können sich entweder in fast gleich große Tochterkolonien aufspalten oder bei anderen Arten kontinuierlich kleinere Gruppen vom Mutternest abspalten. Koloniegründung durch Kolonieteilung kommt zum Beispiel bei allen Treiberameisen, aber auch bei tausenden anderen Arten in fast allen Unterfamilien vor.[43] Arten mit Koloniegründung durch Sprossung bilden oft Nester aus, die später in Kontakt miteinander bleiben und teilweise ausgedehnte, untereinander tolerante Superkolonien bilden. Einige Arten kombinieren auch beide Koloniegründungswege, zusätzlich zu den geflügelten Königinnen produzieren sie auch ungeflügelte Geschlechtstiere, die dann Tochterkolonien durch Sprossung begründen.
Einige Ameisenarten mit Koloniegründung durch Sprossung aus der Unterfamilie Ponerinae haben die Bildung einer eigenen Königinnen-Kaste sogar vollständig aufgeben. Bei ihnen entwickeln sich einige größere Arbeiterinnen sekundär wieder zu Geschlechtstieren (im Unterschied zu Königinnen dann „Gamergaten“ genannt) zurück. Bei den höheren Ameisen ist dies nicht mehr möglich, da bei ihnen Arbeiterinnen nicht mehr erfolgreich befruchtet werden können.
Rückkehr der Königinnen
Königinnen der Kahlrückigen Waldameise und der Großen Wiesenameise kehren oft wieder in ihr Heimatnest zurück, oder sie fliegen in Nester von Artgenossen ein und versuchen, von diesen „adoptiert“ zu werden. Falls erfolgreich, werden sie von Arbeiterinnen in den Bau begleitet und gepflegt. Die neue Königin beginnt dann ebenfalls Eier zu legen. Völker dieser Art haben oft mehrere Königinnen, sind also polygyn und teilen sich, wenn sie zu groß werden, auf. Die neue Königin verlässt dann mit einem Teil der Arbeiterinnen das Nest und gründet ein „Ableger-Nest“ (Zweignestbildung). Neben der Gattung Formica tritt dieses Verhalten beispielsweise auch bei der Feuerameise Solenopsis invicta oder bei Cataglyphis cursor auf. Anstelle der Adoption durch Artgenossen versuchen Jungköniginnen manchmal, in ein Nest von nahe verwandten Arten einzudringen, die dortige Königin zu töten und ihre Nachkommen von den fremden Ameisen großziehen zu lassen (temporärer Sozialparasitismus).
Sozialparasitäre Ameisen
Bei der unselbstständigen Staatengründung sucht sich eine Königin Arbeiterinnen von derselben oder auch fremden Arten. Im besonderen Fall der Blutroten Raubameise (Formica sanguinea) sucht sich die Königin eine Hilfskönigin zumeist bei der Grauschwarzen Sklavenameise (Formica fusca) oder der Roten Waldameise (Formica rufa). Sie schüchtert die Hilfskönigin ein und legt Eier in deren Erdhöhle. Daraufhin pflegt die Hilfskönigin beide Gelege. Wenn die ersten Arbeiterinnen der abhängigen Königin geschlüpft sind, wird die Hilfskönigin getötet und deren Brut versklavt, sodass die Königin sich nun von den anderen Arbeiterinnen pflegen lässt. Diese Art von abhängiger Staatsgründung nennt man temporären Sozialparasitismus. Hin und wieder kommt es vor, dass die parasitäre Königin ihre Wirtin leben lässt und sich so ein permanentes oder zeitweiliges Mischvolk entwickelt (zum Beispiel bei der Säbelameise (Strongylognathus testaceus) und der Gemeinen Rasenameise (Tetramorium caespitum)).
Eine andere Art des Sozialparasitismus, den Brutparasitismus, findet man bei der Arbeiterlosen Parasitenameise (Tetramorium atratulum, ehemals Anergates atratulus). Sie dringt in königinnenlose Nester von Tetramorium-Arten ein und legt dort eine große Zahl an Eiern, die von den Wirtsameisen „adoptiert“ und ausschließlich zu Geschlechtstieren der Parasitenart aufgezogen werden.
Manche Ameisenarten sind nicht in der Lage, selbstständig zu fressen oder Nestbautätigkeiten auszuführen. Sie dringen in artfremde oder -eigene Nester ein und töten entweder alle dort lebenden Ameisen, um deren Bau für das eigene Volk zu nutzen, oder lassen nur die bald schlüpfenden Larven unversehrt, um sie als Sklaven aufzuziehen. Meistens werden bei dieser Form immer wieder Raubzüge unternommen, um sich ständig neue Sklaven zu besorgen. Sklavenhaltung findet man bei der Amazonenameise (Polyergus rufescens) und der Blutroten Raubameise Formica sanguinea (Sklavenarten aus der Untergattung Serviformica), bei Harpagoxenus sublaevis (Sklavenarten aus der Gattung Leptothorax), oder bei der Gattung Temnothorax (ehemalige Gattungen Chalepoxenus und Myrmoxenus; Sklavenarten aus der Gattung Temnothorax), sowie bei der Gattung Strongylognathus (Sklavenarten aus der Gattung Tetramorium).
Ernährung


Die ursprüngliche Ernährungsweise der Ameisen ist diejenige als Räuber, in der Fachsprache auch Prädator genannt. Bedeutsam ist insbesondere die Prädation anderer Gliederfüßer-Arten. Sehr viele Ameisenarten haben sich als ergänzende oder alternative Nahrungsquelle zuckerreiche Pflanzensäfte erschlossen, die sie direkt, zum Beispiel an extrafloralen Nektarien, häufiger aber an zuckerreichen Ausscheidungen von Pflanzensaugern aus der Ordnung der Schnabelkerfe, Honigtau genannt, ernten. Einige Ameisenarten haben sich auf eine Ernährung durch Samen spezialisiert, die sich von anderen pflanzlichen Geweben durch hohen Protein- und Fettgehalt unterscheiden und dadurch tierischem Gewebe ähnlicher sind. Eigentlich pflanzenfressende (phytophage) Arten, die zum Beispiel grüne Blätter nutzen würden, gibt es aber nicht – mit Ausnahme der Blattschneiderameisen, die aber nicht die Pflanzen selbst verwerten, sondern auf ihnen Pilze züchten. Die tatsächliche Ernährung von Ameisenvölkern im Freiland festzustellen ist extrem schwierig, weil viele Arten zahlreiche Nahrungsquellen, viele davon aber nur in sehr geringen Mengen oder opportunistisch, je nach Angebot, ausnutzen. Die wichtigste Technik zur Untersuchung solcher allesfressender, in der Fachsprache omnivorer, Arten ist die Isotopenuntersuchung stabiler Isotope, insbesondere δ13C und δ15N.[45][46]
Allesfresser
Echte Omnivorie ist bei Ameisen eher selten. Bekannte Beispiele sind die Rote Feuerameise Solenopsis invicta[47] oder die Pharaoameise Monomorium pharaonis[48] wie auch einige andere, als Schädlinge klassifizierte Arten.[49] Bei freilebenden, mitteleuropäischen Arten ist insbesondere eine Kombination von jagender Ernährung mit Nutzung von Honigtau (unter opportunistischer Mitnutzung anderer Nahrungsquellen in geringem Umfang) verbreitet. In diesem Sinne ist die wohl bekannteste heimische Ameisenart, die Rote Waldameise, auch ein Allesfresser. Ihre Nahrung besteht vor allem aus Insekten (z. B. Raupen, Schmetterlingen, Fliegen) und anderen wirbellosen Tieren (z. B. Spinnen). Daneben werden auch Ausscheidungen verschiedener Pflanzensäftesauger (Honigtau) genutzt. Bei einer nahe verwandten Art (Formica aquilonia) in Finnland machte die Ernährung durch Honigtau zum Beispiel etwa 80 bis 90 Prozent der gesamten Energiemenge aus, fast der gesamte Rest waren räuberisch erbeutete Insekten und andere Arthropoden.[50] In Mitteleuropa wurde, nach älteren Untersuchungen an Formica rufa, angegeben: Honigtau 62 Prozent (v. a. von wurzelsaugenden Arten), Insekten 33 Prozent, Baumsäfte 4,5 Prozent, Tierleichen und Pilzfruchtkörper 0,3 Prozent, Samen 0,2 Prozent.[51]
Räuber und Aasfresser
Eine Reihe von Ameisenarten – zum Beispiel Treiberameisen – ernähren sich ausschließlich räuberisch. Daneben ernähren sich einige Arten auch von frischem Aas. Einige Ameisenarten haben sich auf bestimmte Beutetiere spezialisiert. So ernährt sich die südamerikanische Knotenameisengattung Daceton ausschließlich von Springschwänzen.
Nomadisch lebende Ameisenarten, wie die Treiber-, Wander- und Amazonenameisen, jagen als gesamtes Volk. Dabei bilden beispielsweise die Wanderameisen Fronten, die nicht selten 14 bis 20 Meter breit werden können. Neben diversen Wirbellosen erbeuten sie gelegentlich auch nestjunge Vögel, kleine Säugetiere und Schlangen.
Nutzung von an Pflanzen saugenden Insekten

Viele Ameisenarten leben mit pflanzensaftsaugenden Insekten in Symbiose (Trophobiose genannt, da Ameisen Schutz gegen Nahrung gewähren) und somit in gegenseitiger Abhängigkeit. Die Trophobionten sind myrmekophil, die Ameisen meist aphidophil, d. h. ihre Symbiosepartner sind überwiegend phloemsaugende Schildläuse (Coccoidea), Blattläuse (Aphidoidea) und Blattflöhe (Psylloidea). Phloem ist reich an Kohlenhydraten, enthält aber nur sehr wenig Protein. Phloemsauger verbrauchen deshalb nur circa zehn Prozent der Kohlenhydrate; der Überschuss wird als zuckerreicher Honigtau – wichtigste Kohlenhydratquelle der Ameisen – ausgeschieden. Die Ameisen „melken“ die Blattsauger und bewachen sie im Gegenzug vor Fressfeinden. Manche Ameisenarten lassen die Blattläuse in ihrem Nest überwintern oder tragen deren Eier in ihr Nest, um sie vor Kälte zu schützen. Vom Regen fortgespülte Larven werden von den Ameisen gesucht und zurückgeholt.
Manche Ameisen suchen gezielt nach Blattsaugern und versetzen sie auf von den Pflanzensaugern bevorzugte Pflanzen. Wird eine Herde zu groß, so treiben oder tragen die Ameisen die Läuse oder deren Eier zu einer neuen Pflanze. Es wurden Kriege zwischen verschiedenen Ameisenstaaten beobachtet, in denen um die Vorherrschaft über Läuseherden gekämpft wurde.
| Siehe auch: | Ameisen kultivieren Blattläuse (Wikimedia Commons) |
Samenfresser
Die in den Halbwüsten und Steppen vorkommenden granivoren Ernteameisenarten der Gattung Pogonomyrmex oder die in wärmeren Gegenden Europas und in Afrika verbreitete Gattung Messor sammeln vor allem Gras- (zum Beispiel Getreide-), aber auch andere Pflanzensamen, die sie massenhaft einlagern und von denen sie sich ausschließlich ernähren. Bei den Ernteameisen gibt es Arbeiterinnen mit vergrößerten Mandibeln (sogenannte Majoren), die ausschließlich die auf den bis zu 200 Meter langen Ameisenstraßen herangeschleppten Samen knacken. Weniger spezialisierte Ernteameisen wie Vertreter von Pheidole oder Tetramorium sind nicht nur auf Pflanzensamen angewiesen und nutzen auch andere Nahrungsangebote.
Samensammler
Zu dieser Gruppe zählen die Elaiosom-fressenden Ameisen, z. B. die meisten Waldameisen und Wegameisen. Das Elaiosom ist ein protein- und fettreiches Fraßkörperchen, das sich als Anhängsel an Samen von vor allem bodennah wachsenden Krautpflanzen (wie verschiedenen Veilchen- und Lerchenspornarten) findet. Die Samenausbreitung findet an diesen Pflanzen durch Ameisen statt (Myrmekochorie). Die meist sehr kleinen Samen werden im Ganzen wegtransportiert und mithin verbreitet, aber nur das Elaiosom verwertet.
Diebe
Diebe oder Gelegenheitsdiebe bauen Gänge in fremde Nester oder gar Brutkammern und verschleppen die fremde Brut, um sie später zu verzehren. Dieser Kleptoparasitismus wurde beispielsweise bei der in Europa eingeschleppten und in mehreren Staaten meldepflichtigen Pharaoameise (Monomorium pharaonis) und der Gelben Diebsameise (Solenopsis fugax) beobachtet.
Pilzzüchter
Einige Ameisenarten der Tribus Attini züchten Pilze. Dazu gehören die südamerikanischen Blattschneiderameisen der Gattungen Atta und Acromyrmex, die in ihren bis zu acht Meter tiefen, auch oberirdisch etwas erhöhten Nestern einen schimmelähnlichen Pilz (Attamyces bromatificus)[52] züchten und mit diesem und einem Bakterium in einer seltenen Dreiersymbiose leben.
Die Ameisen schaffen Blatt- und Pflanzenteile heran, zerkauen diese zu einer breiigen, weitestgehend Fungizid-freien Masse, die dann als spezieller Nährboden für die Pilze dient. Im Gegenzug bilden die Pilze an den Enden der Pilzfäden eiweißreiche Verdickungen (Gongylidien oder Bromatien) aus, die als Proteinquelle für die Ameisen dienen. Auch schließen die Pilze die Cellulose in den pflanzlichen Materialien so auf, dass sie für die Ameisen verwertbar werden, und bauen überdies Insektizide ab. Die dritten in der Dreiersymbiose sind Bakterien der Gattung Streptomyces, die an der Unterseite der Ameisen ihren Lebensraum haben und antibakterielle und fungizide Stoffe produzieren. Damit schützen die Ameisen ihre Pilze vor hochspezialisierten Parasiten wie den zu den Schlauchpilzen gehörenden Escovopsis-Arten, die die Ernte der Ameisen bedrohen. Einige Attini-Arten züchten Pilze auf Raupenkot oder anderen organischen Materialien.
Eiablage
Nach der Winterstarre wärmt sich die Königin zunächst drei bis acht Tage auf und beginnt dann mit der Eiablage (mehrere hundert täglich, bis zu 300 Eier bei der Roten Waldameise). Bei den meisten Arten sind es zuallererst Eier von Geschlechtstieren (Männchen oder Jungköniginnen), da spät geschlüpfte Königinnen nur geringe Chancen haben, einen neuen Staat zu gründen und somit die Art zu erhalten.
Ameisen haben wie alle staatenbildenden Hautflügler (Hymenoptera) keine Geschlechtschromosomen. Die Königin kann entscheiden, ob aus einem Ei ein Weibchen oder ein Männchen werden soll, je nachdem, ob sie das Ei in ihren Eileitern mit der Samenspritze besprüht oder nicht. Es ist noch ungeklärt, wie die Königin diese Entscheidung trifft.
Es gibt zuweilen (am Beispiel der kleinen Waldameise) auch Königinneneier. Sie sind wesentlich größer, da sie an ihrem hinteren Eipol eine spezielle RNA-Proteinnahrung, das Polplasma, enthalten, die die Embryos für die Entwicklung zu Königinnen brauchen.
Einige Ameisenarten (wie die Weberameisen der Gattung Oecophylla) legen trophische Eier. Diese Eier werden nicht gelegt, um Nachkommen zu zeugen, sondern dienen als Nähreier, mit denen später die Larven gefüttert werden.
Eipflege
Ameiseneier sind meistens weichschalige, gestreckte Ellipsoide von bis zu einem Millimeter Länge. Nach der Eiablage tragen die Brutpflegerinnen die Eier mittels ihrer Mandibeln in die Brutkammern, in denen geeignete Temperatur und Luftfeuchtigkeit herrschen. Ändert sich dieses Mikroklima durch äußere Einflüsse (zum Beispiel Zerstörung), so werden die Eier sofort von den Arbeiterinnen in andere Brutkammern transportiert.
Die Brutpflegerinnen belecken und bespeicheln die Eier immer wieder, um sie sauber zu halten und vor dem Austrocknen zu schützen. Auch haften die Eier dadurch aneinander und können somit notfalls als „Pakete“ transportiert werden.
Bei manchen Arten fressen die Arbeiterinnen einen Teil der unbefruchteten Eier, falls sonst zu viele Männchen entstünden.
Die Entwicklung der Eier dauert bei Ameisen je nach Art zwischen ein und vier Wochen, bei der Roten Waldameise ungefähr zwei Wochen.
Larvenstadium

Nach einiger Zeit schlüpfen die weißen oder gelblichen, madenförmigen Larven aus den Eiern. Sie sind mit Ausnahme der Kopfkapsel weichhäutig, meist leicht behaart und je nach Art mehr oder weniger beweglich. Sie sind beinlos, auch Augen werden nicht ausgebildet. Brutpflegerinnen transportieren die Larven mancher Arten in die Sonne, füttern sie über ihren Kropf und reinigen sie, damit sie nicht austrocknen oder Pilze ansetzen. Die Brutpflegerinnen füttern die Larven per „Kropf-zu-Mund“ Fütterung, Trophallaxis genannt. Da imaginale Ameisen aufgrund der Struktur ihres Kropfes nur flüssige oder ganz fein zerkleinerte Nahrung aufnehmen können, spielt auch der umgekehrte Weg eine Rolle: Arbeiterinnen füttern die Larven mit für sie selbst unverdaulichen Nahrungspartikeln und werden später, vor allem in Zeiten von Nahrungsmangel, per Trophallaxis, von ihnen miternährt (als „sozialer Kropf“ oder „sozialer Magen“ bezeichnet).
Bei den meisten Ameisenarten ist die Ernährung der geschlüpften Larven und deren Lage zur Königin für die Ausbildung von Geschlechtstieren wichtig. Nur sehr reichlich ernährte Larven können sich zu Königinnen entwickeln. Alle Eier (auch Königinneneier), die sich sehr nahe bei der Königin befinden, entwickeln sich meist zu Arbeiterinnen. Dies ist durch von der Königin abgegebene Pheromone erklärbar.[53] Die Festlegung von Subkasten der Arbeiterinnen (Klein- und Großarbeiterinnen oder Soldaten) ergibt sich ebenfalls meist über die Nahrung. Auch die Männchen erhalten eine spezielle Nahrung. Während frühere Bearbeiter eine zusätzliche genetische Basis der Kastendetermination als unsicher einstuften, gibt es heute bei zahlreichen Arten ernsthafte Hinweise darauf.[54]
Wie typisch für alle Taillenwespen, sammeln die Larven die unverdaulichen Nahrungsreste im sogenannten Kotsack, der sich am Ende des Mitteldarms befindet. Erst am Ende der Larvenzeit ist die Verbindung zum After vollständig ausgebildet, so dass der Inhalt des Kotsacks bei der Umwandlung zur Puppe als sogenanntes Meconium entsorgt werden kann. Bei solchen Ameisen, deren Puppen in Kokons liegen, wird der Larvenkot durch einen schwarzen Punkt am caudalen Pol der Puppenhülle sichtbar, sobald zwischen Darm und Magen eine Verbindung entstanden ist.
Das gesamte Wachstum der Ameisen ist wie bei allen holometabolen Insekten auf Häutungsvorgänge, und damit auf das Larvenstadium, beschränkt. Die Larven entwickeln sich meist schnell: Die Larven der Roten Waldameise können sich innerhalb von acht Tagen verpuppen.
Typbestimmende Faktoren
Welcher Kaste bzw. welchem Geschlecht ein Individuum angehören wird, entscheidet sich durch Unterschiede in der Individualentwicklung (Ontogenese), wenn auch in seltenen Fällen wie bei Harpagoxenus sublaevis genetische Faktoren eine gewisse Rolle spielen können. Generell entstehen aus Eiern mit einfachem (haploidem) Chromosomensatz Männchen, während aus Eiern mit doppeltem (diploidem) Chromosomensatz Weibchen entstehen.
Ob aus einem Weibchen eine (fruchtbare) Königin wird oder eine (unfruchtbare) Arbeiterin und inwiefern weitere Differenzierungen innerhalb der Arbeiterklasse geschehen, hängt von zahlreichen Faktoren ab, die während der Larvalentwicklung Einfluss nehmen. Hölldobler nennt folgende Faktoren, die sich auf die Entwicklung jedes Individuums (Differenzierung) auswirken:[16]
- Ernährung: Menge und Qualität der Nahrung, eventuell besondere Nahrungssekrete aus den Futtersaftdrüsen
- Temperatur: Frost, optimale Entwicklungstemperatur
- Feuchte
- Tageslänge
- Kastenselbstinhibition: Individuen einer Kaste verhindern die Entstehung weiterer Individuen derselben Kaste (kommt häufig bei Königinnen vor)
- Größe und Dottergehalt der Eier
- Alter der Königin
Oft wird die Entwicklung des Individuums von einer Kombination dieser Faktoren beeinflusst. So können bei Myrmica ruginodis nur Larven, die der Winterkälte ausgesetzt waren, überhaupt zu Königinnen heranwachsen. Jedoch müssen sie so ausreichend ernährt werden, dass sie etwa acht Tage nach der Winterruhe mindestens 3,5 mg Gewicht haben. Leichtere Larven und solche, die nicht der Winterkälte ausgesetzt werden, entwickeln sich zu Arbeiterinnen.[16][10]
Puppenstadium

Im Puppenstadium nimmt die Ameise keine Nahrung mehr auf und verharrt völlig regungslos. Die Larven der meisten Schuppen- und Urameisen spinnen sich vor dem Verpuppen mittels eines aus ihren Labialdrüsen austretenden Spinndrüsensekretes in eine trockene Hülle (Kokon) ein. Die Larven der Knotenameisen verpuppen sich hingegen ohne Kokon.
Die Puppenruhe dauert bei den Roten Waldameisen rund 14 Tage, bei vielen Arten jedoch bedeutend länger. Die Puppenkokons werden von den Brutpflegerinnen an die günstigsten Standorte transportiert und gepflegt. Auch helfen sie beim Schlüpfen und Füttern und reinigen die junge Ameise noch einige Tage lang, bis deren Chitinpanzer gehärtet und nachgedunkelt ist.
Hochzeitsflug

Sind die Jungköniginnen und Männchen geschlüpft (bei den heimischen Arten Anfang Mai), so bereitet sich der gesamte Staat auf den Hochzeitsflug vor. Die geflügelten Geschlechtstiere verspüren immer mehr den Drang, auf hohe Punkte wie etwa Grashalme, Hügel oder Bäume zu klettern. Arbeiterinnen passen auf, dass sich die Geschlechtstiere nicht zu weit vom Nest fortbewegen, und holen sie notfalls in den Bau zurück.
Zu einem artspezifischen Zeitpunkt, der vermutlich von bestimmten Luftströmungen, Lichtverhältnissen und Temperaturen abhängt, schwärmen alle Geschlechtstiere einer Art aus den verschiedenen Kolonien gleichzeitig zum Hochzeitsflug aus. Einheimische Arten schwärmen meistens im Früh- oder Hochsommer. Vor allem tropische und subtropische Arten schwärmen zweimal im Jahr. Durch das gemeinsame, synchronisierte Schwärmen wird der Kontakt von Geschlechtstieren aus verschiedenen Nestern, und damit Fremdbefruchtung, erleichtert.
Bei vielen Ameisenarten sitzen die Jungköniginnen am Boden; sie locken männliche Geschlechtstiere über Lockstoffe Pheromone an. Bei einigen, wie zum Beispiel den Treiberameisen, dringen die Männchen dazu in eine andere Kolonie oder Bau ein, die Königinnen verlassen bei ihnen die Mutterkolonie niemals. Bei anderen Arten bilden die Männchen Hochzeitsschwärme, in die die Jungköniginnen einfliegen, die Kopulation erfolgt bei ihnen noch im Flug oder unter dem Schwarm am Boden.[55] Jede Jungkönigin kann von mehreren, zwei bis 40 Männchen, begattet werden. Sie nimmt bis zu mehrere hundert Millionen Spermien in ihrem Samensack auf, die sie durchschnittlich 25 Jahre unbeschadet verwahren kann und mit denen sie die Eier befruchtet.
Einige Stunden nach dem Hochzeitsflug sterben die Männchen, sie werden von den Arbeiterinnen dann als Nahrung betrachtet und in den Bau gebracht. Nach der Paarung brechen die Königinnen ihre Flügel mit den Mittel- und Hinterbeinen ab.[56]
Interaktion mit anderen Lebewesen
Fressfeinde

In Mitteleuropa ernähren sich einige Vogelarten wie z. B. der Grün-, Bunt- und Schwarzspecht, kleine Schlangen, Amphibien, Spinnen, Insekten, aber auch Wildschweine von Ameisen. Die Larven der Ameisenjungfern, die Ameisenlöwen, sind unter anderem auf das Erbeuten von Ameisen spezialisiert. Der Grünspecht deckt die Hälfte seines täglichen Nahrungsbedarfs mit circa 3000 bis 5000 Ameisen.
Außerhalb Europas sind vor allem Ameisenbären bedeutende Fressfeinde, im Süden der USA sowie in Mittelamerika kommt in dieser Beziehung den Krötenechsen (Phrynosoma) größere Bedeutung zu, die sich fast ausschließlich von Ameisen ernähren.
Viele Wirbellose (wie z. B. Raubwanzen) imitieren die Pheromone der Ameisen und legen damit Ameisenstraßen, auf denen die Ameisen ihren Feinden entgegenlaufen. Einige Spinnentiere, Tausendfüßlerarten und Käfer imitieren speziell die Pheromone der Ameisenlarven. So können sie ungehindert, teilweise auch getragen von den Brutpflegerinnen, in den Bau zu den Brutkammern eindringen und sich der Larven bedienen. Beide Formen können zur chemischen Mimikry gezählt werden.
Ameisengäste
Ameisengäste sind Tiere, die in Ameisenbauten leben. Dazu gehören vor allem Insekten, aber auch Webspinnen. Formen des Zusammenlebens sind Synechthrie bzw. Syllestium, Synökie, Symphylie und Parasitismus.
Bei der räuberischen Form des Zusammenlebens – Synechthrie oder Syllestium – ernährt sich der Ameisengast von Ameisen, Ameisenlarven oder Ameiseneiern. Dabei werden verschiedene Strategien angewandt: Ameisenspinnen ahmen Ameisen in Form und Verhalten nach, während sich beispielsweise einige Bläulingsraupen durch einen dicken Schutzmantel vor Angriffen der Ameisen schützen.
Synökie bedeutet ein Zusammenleben verschiedener Arten ohne sonderliche gegenseitige Beeinflussung. Verschiedene Springschwanzarten, die Larven der Schwebfliegengattung Microdon, die Blattkäfergattung Clytra, flügellose Grillen der Gattung Myrmecophilus (z. B. die Ameisengrille), Ameisenfischchen (Atelura spp.) und die Kurzflügler der Gattung Dinarda leben von den Nahrungsvorräten der Ameisen. Außerhalb der Brutbereiche in Ameisenhügeln finden sich häufig Rosenkäferlarven.
Bei der Symphylie werden die Ameisengäste beschützt und oftmals auch gefüttert. Die Ameisen erhalten dafür zum Beispiel nahrhafte Drüsensekrete. Zu solchen Gästen zählen die Kurzflügler der Gattungen Lomechusa und Atemeles, Keulenkäfer der Gattung Claviger und einige Bläulingsraupen.
Ameisen können Opfer von Parasiten werden, zum Beispiel von Milben, die ihre Hämolymphe saugen. Daneben gibt es Milben der Gattung Antennophorus: Sie leben auf den Ameisen und bringen die Ameisen durch Reizung dazu, Nahrungstropfen abzugeben, von denen sich die Milben ernähren. Milben der Art Laelops oophilus leben bei den Larven und lassen sich von den Brutpflegerinnen füttern.
Zu den Innenparasiten gehören die Larven einiger Schlupfwespenarten und verschiedene Fadenwürmer. Auch dienen Ameisen dem Kleinen Leberegel als zweiter Zwischenwirt.
Weitere Innenparasiten sind die Pilze Ameisen-Kernkeule (Ophiocordyceps myrmecophila), siehe Kernkeulen, und O. unilateralis.[57]
75 Prozent der weltweit vorkommenden Schmetterlinge aus der Familie der Bläulinge (Lycaenidae) leben in ihrem Raupenstadium myrmekophil, also von oder mit Ameisen. Dabei kommen Symbiose und Parasitismus mit allen Zwischenstufen vor. Einige Raupen, wie beispielsweise die des Silbergrünen Bläulings (Polyommatus coridon) oder des Storchschnabel-Bläulings (Plebejus eumedon), dienen den Ameisen ähnlich den Pflanzenläusen als Honigtauquellen. Dafür werden sie vor Fressfeinden beschützt. Andere Bläulingsraupen leben parasitär oder symbiotisch als Ameisengäste im Ameisenbau. So wird die Raupe des Lungenenzian-Ameisenbläulings (Phengaris alcon) von Waldknotenameisen (Myrmica ruginodis) adoptiert und ohne Gegenleistung wie eine Ameisenlarve gefüttert. Die Raupe des Dunklen Wiesenknopf-Ameisenbläulings (Phengaris nausithous) wird von der Roten Gartenameise (Myrmica rubra) ebenfalls wie die eigene Brut gepflegt, gibt aber Zuckerwasser an die Ameisen ab. Zusätzlich frisst die Raupe die Ameisenbrut.
Einige Bläulinge sind vollkommen von einer speziellen Ameisenart abhängig. So braucht der Quendel-Ameisenbläuling (Phengaris arion) Knotenameisen der Art Myrmica sabuleti zur Entwicklung. Gegen Absonderung eines zuckerhaltigen Sekrets darf sich die Raupe von Ameisenlarven ernähren. Ein Rückgang der Ameisen aufgrund einer veränderten Viehwirtschaft auf den Britischen Inseln (die Ameisen bevorzugen kurzes, also beweidetes Gras) führte dort zum Aussterben des Bläulings.
Wirtschaftliche Bedeutung

Gelegentlich werden Ameisen als Lebensmittel genutzt. Das mexikanische Gericht Escamoles z. B. besteht aus den Larven und Puppen zweier Ameisenarten.
Die Ernteameisen der Spezies Pogonomyrmex barbatus, die man als Holzschädlinge betrachtet, können die Forstwirtschaft fördern, indem sie den Abbau und die Umsetzung von Holz beschleunigen, das bereits von anderen Insekten befallen ist. Weitere bedeutende Beiträge zur Forstwirtschaft in tropischen und subtropischen Gebieten leisten wohl die räuberischen Treiber- oder Wanderameisen. Sie beseitigen effektiv andere, noch schädlichere Insekten und sind daher in menschlichen Wohn- und Wirtschaftsgebieten nicht immer unwillkommen.
Zwar wirken sich die vielen samensammelnden Ameisen schädigend auf die Landwirtschaft aus, wenn sie in der Umgebung von Kornfeldern und Getreidespeichern zu zahlreich werden, doch im Normalfall kann ihre Anwesenheit die Produktion begünstigen, weil sie der Zunahme schädlicher parasitischer Käfer entgegenwirkt.
Die Puppen gewisser Arten der Waldameisen waren in Teilen Österreichs, Bayerns und Böhmens jahrhundertelang begehrte Handelsware. Ameisler, die vor allem in Niederösterreich bis etwa Mitte des 19. Jahrhunderts ein eigenes Gewerbe bildeten, sammelten und trockneten die Puppen und verkauften sie auf dem Markt als Vogelfutter.[58][59] Darüber hinaus wurde den Tieren in der Volksmedizin eine heilende Wirkung gegen Rheuma zugeschrieben.[58]
Beeinträchtigungen für den Menschen

Die Roten Feuerameisen wurden Anfang der 1950er Jahre nach Australien eingeschleppt. Unter den für sie sehr günstigen Umweltbedingungen des australischen Outbacks haben sie sich stark vermehrt, u. a. auch in der Nähe von Städten. Tatsächlich betrachten sie die Menschen als Eindringlinge in ihr Revier und versuchen sich zu verteidigen. Ihre Bisse und das Gift ihres Stachels wirken bei manchen Menschen allergieauslösend wie Bienen- oder Wespenstiche.
Blattlaushaltende Ameisen sind häufig Schädlinge in Gärten. Zudem werden Ameisenhügel im Zierrasen sowie Ameisenstraßen in und nahe bei Wohn- und Wirtschaftsgebäuden oft als lästig empfunden.
Haltung
Einheimische oder exotische Ameisenarten können in speziellen, vorgefertigten Behältnissen, den sogenannten Formicarien, gehalten werden. Ameisenhaltung ist inzwischen zu einem beliebten Hobby geworden; sie zählt zum Wissensbereich der Terraristik. Die nötigen Anschaffungen hängen vom Anspruch der jeweiligen Art ab. Beispielsweise ist der Aufwand für die Blattschneiderameisen Atta cephalotes ungewöhnlich hoch, da sie ständig Nachschub an frischen Blättern brauchen, um ihre Nahrung (einen Pilz) züchten zu können. Heimische Arten, wie etwa die Schwarze Wegameise (Lasius niger), können dagegen auch in einem einfachen Gipsnest mit angeschlossener Arena (sandiger Boden) gehalten werden.
Zu beachten ist bei europäischen Arten die Einhaltung der Winterruhe von Mitte Oktober bis April, die entweder in geeigneten Behältnissen im Kühlschrank oder frostgeschützt auf dem Balkon oder im Garten verbracht werden sollte. Ohne diese Winterruhe kommt es zu einer Schwächung des Ameisenstaates, die zum Absterben der Kolonie führen kann.
Die in den letzten Jahren steigende Popularität der Ameisenhaltung kann auch zur Gefährdung von natürlichen Ameisenpopulationen führen. Das Suchen und Ausgraben von freilebenden Königinnen für die Haltung oder Zucht bedeutet meist das Absterben der Kolonie. Dies ist nicht nur der Fall, wenn die Königin entnommen wird, sondern auch, wenn durch das Suchen das Nest weitgehend zerstört und somit anfällig für äußere Einflüsse und Feinde wird. Da es meist sehr schwierig ist, die Königin auszumachen, werden oft viele Nester geschädigt. Als weitere Bedrohung kommt das Freilassen von Kolonien an nichtheimischen Orten dazu. Während exotische Arten im Winter meist sterben, können sich Arten aus ähnlichen klimatischen Regionen hin und wieder etablieren und dann eine direkte Gefahr, etwa durch Konkurrenz, oder indirekte Gefahr, zum Beispiel durch das Einschleppen von Parasiten, für andere Ameisen oder weitere Arten bilden. Selbst das Freilassen einheimischer Arten ist nicht problemlos. Geschieht dies in zu hohem Maß, führt es zu einer Angleichung der genetischen Informationen über ein größeres Gebiet und verringert somit die Biodiversität.[60]
Populäre Behauptungen, Legenden und Rekorde zu Ameisen
Vermeintlich außergewöhnliche Körperkraft

In populärer Literatur wird immer wieder behauptet, es sei eine besondere Fähigkeit von Ameisen, dass sie das Hundertfache ihres eigenen Körpergewichts tragen könnten. Auch anderen Insekten werden in ähnlichen „Berechnungen“ – gemessen an den Dimensionen des Menschen – unglaubliche Fähigkeiten und Körperkräfte zugeschrieben. Die Hochrechnung, dass ein Mensch mit einer Körpermasse von 50 kg ein Paket mit einer Masse von fünf Tonnen tragen können müsste, ist ein Taschenspielertrick. Hier wird nicht beachtet, dass das Gewicht und die Masse mit der dritten Potenz einer Länge steigen, während der für die Kraft ausschließlich maßgebende Querschnitt eines Muskels nur im Quadrat der Länge wächst.[61] Vergrößerte man eine Ameise von 10 mm Länge linear auf die 200-fache Länge, dann käme man mit 2 m Länge in die Größenordnung eines Menschen. Die Masse und damit das Gewicht würden sich um das Achtmillionenfache (200³=8.000.000) von vielleicht 10 mg auf 80 kg erhöhen. Dann erhöhte sich aber die Muskelkraft (bei gleichen Körperproportionen) nur um das Vierzigtausendfache (200 · 200 = 40.000). Wenn eine Ameise ihr hundertfaches Körpergewicht (Masse 100 · 10 mg = 1 g) tragen kann, dann würde sie also in Menschengröße bei gleichen Verhältnissen 40 kg tragen können. Es ist also eine in der Biologie ganz normale Leistung.
Rekorde und Außergewöhnliches
Die größte gefundene Ameisenkolonie befindet sich in Südeuropa und wird von der Argentinischen Ameise Linepithema humile gebildet.[62] Sie erstreckt sich entlang der Italienischen Riviera bis in den Nordwesten Spaniens über eine Länge von 5760 Kilometer. Die Kolonie besteht aus mehreren Millionen Nestern mit mehreren Milliarden Individuen.[63] Forschungen ergaben, dass sich Ameisen dieser Kolonie und solche aus anderen großen Kolonien derselben Art an der Küste Kaliforniens und der Westküste Japans nicht gegenseitig bekämpfen, woraus man schlussfolgert, dass sich das Ausbreitungsgebiet besagter Kolonie inzwischen womöglich über mehrere Kontinente erstreckt, verbreitet durch den Menschen. Damit wäre es die größte bekannte Ausbreitung einer Insektenkolonie.[62]
Die Vermessung eines Nestes von Blattschneiderameisen ergab eine Tiefe von acht Metern unterhalb des Erdbodens und eine Gesamtfläche von 50 m².[64]
Eine Ameisenkolonie kann innerhalb von sechs Jahren 1900 Kammern anlegen. Dafür müssen rund 40 Tonnen Erde aus den Kammern und 6 Tonnen Blattstücke in die Kammern gebracht werden.[63]
Eine sibirische Ameisenart überwintert in einer Art Kältestarre bei Temperaturen unter −40 °C.[63]
Weberameisen (Oecophylla) können sich auf glatten Oberflächen so stark festhalten, dass fast das 200-fache ihres Körpergewichtes nötig ist, um sie zu lösen.[63]
Wüstenameisen (Cataglyphis bombycina) zählen unter den Ameisen mit circa einem Meter pro Sekunde Laufgeschwindigkeit zu den schnellsten Insekten.[65]
Zu den bemerkenswerten anatomischen Fähigkeiten, die manche Ameisenarten entwickelt haben, gehört der Kieferschluß der Schnappkieferameise, der so schnell erfolgen kann, dass sie sich vor Fressfeinden wegkatapultieren kann.[63]
Literatur
- Wilhelm Goetsch: Die Staaten der Ameisen. 2. Aufl. Berlin/Göttingen/Heidelberg 1953 (= Verständliche Wissenschaft, 33).
- Bert Hölldobler, Edward O. Wilson: Ameisen. Die Entdeckung einer faszinierenden Welt. Birkhäuser, Basel/Boston/Berlin 1995, ISBN 3-7643-5152-7.
- Bert Hölldobler, Edward O. Wilson: Der Superorganismus. Der Erfolg von Ameisen, Bienen, Wespen und Termiten. Springer Verlag, Berlin 2010, ISBN 978-3-540-93766-1.
- Bert Hölldobler, Edward O. Wilson: Auf den Spuren der Ameisen. Springer Spektrum, 2013, ISBN 978-3-642-32565-6.
- Wolfgang Schwenke: Ameisen: der duftgelenkte Staat (LB-Naturbücherei). 2. Auflage. Landbuch Verlag, Hannover 1996, ISBN 3-7842-0309-4.
- Bernhard Seifert: Die Ameisen Mittel- und Nordeuropas. Lutra, Görlitz/Tauer 2007, ISBN 978-3-936412-03-1.
- Die Ameisen als Skeletirer. In: Die Gartenlaube. Heft 26, 1853, S. 283 (Volltext [Wikisource]).
Weblinks
- www.ameisenwiki.de – Wissenswertes über Ameisen und deren Haltung
- www.ameisenschutzwarte.de – Internetpräsenz der Deutschen Ameisenschutzwarte e. V.
- antbase.net – Ameisen-Datenbank-Projekt der Deutschen Forschungsgemeinschaft
- antbase.org – verzeichnet ca. 12.500 Ameisen-Arten (englisch)
- antweb.org – Datenbank von Ameisengattungen und -arten der ganzen Welt (englisch)
- Umfangreiche Sammlung von 2600 Ameisen-Büchern und Fachartikeln zum freien Download bei archive.org (einschließlich ca. 160 deutschsprachiger Titel).
- Ameisen (PDF; 1023 kB) – UmweltWissen, Bayerisches Landesamt für Umwelt
- Ants Down Under – Übersicht über die Ameisen Australiens
- Patrick Krapf: Ameisen. Gespräch mit Melanie Bartos im Podcast „Zeit für Wissenschaft“, Universität Innsbruck, 2016.
Einzelnachweise
- AntCat
- D. Agosti, D. Grimaldi, J. M. Carpenter: Oldest known ant fossiles discovered. In: Nature, Band 391, 29. Januar 1998, S. 447 ff., doi:10.1038/35051 (englisch).
- Kluge. Etymologisches Wörterbuch der deutschen Sprache. Bearbeitet von Elmar Seebold. 25., durchgesehene und erweiterte Auflage. De Gruyter, Berlin/Boston 2011, ISBN 978-3-11-022364-4, S. 38; Wolfgang Pfeifer u. a.: Etymologisches Wörterbuch des Deutschen. 2., durchgesehene und erweiterte Auflage. Akademie, Berlin 1993, ISBN 3-05-000626-9, S. 33. Allein die Bedeutung ‚Abschneiderin (von Pflanzenteilen)‘ nennt das Deutsche Wörterbuch von Jacob Grimm und Wilhelm Grimm. Neubearbeitung. Hrsg. von der Berlin-Brandenburgischen Akademie der Wissenschaften und der Akademie der Wissenschaften zu Göttingen. 2. Band: Affront – Ansüszen. Hirzel, Stuttgart/Leipzig 1998, S. 637.
- Althochdeutsches Wörterbuch, Band I: A und B. Akademie, Berlin 1968, Sp. 325.
- Albert L. Lloyd, Otto Springer: Etymologisches Wörterbuch des Althochdeutschen. Band I: -a – bezzisto. Vandenhoeck & Ruprecht, Göttingen/Zürich 1988, ISBN 3-525-20767-0, Sp. 203–205.
- Matthias Lexer: Mittelhochdeutsches Handwörterbuch. Band I: A–M. Hirzel, Leipzig 1872, Sp. 49 f.
- Walther Mitzka, Ludwig Erich Schmidt: Deutscher Wortatlas. Band V. Schmitz, Gießen 1957, S. 1–4, wozu Albin Schubart: Deutscher Wortatlas: Die Ameise. Diss. (masch.) Marburg 1945; Sprachatlas der deutschen Schweiz. Band VI: Wortgeographie III: Umwelt. Unter der Leitung von Rudolf Trüb bearbeitet von Walter Haas u. a. Francke, Bern 1988, S. 229 f., wozu Andreas Lötscher: Ameise. In: Helen Christen, Elvira Glaser, Matthias Friedli (Hrsg.): Kleiner Sprachatlas der deutschen Schweiz. Frauenfeld 2010, ISBN 978-3-7193-1524-6, S. 164 f., 167.
- Niels Åge Nielsen: Dansk etymologisk ordbog. Ordenes historie. 3., überarbeitete Auflage, 4. Nachdruck. Gyldendal, Kopenhagen 1985, S. 259; Svenska Akademiens ordbok, Band 18, Sp. 1737. Die linguistische Zuordnung von „krimgotisch“ miera ist unsicher.
- W. Kirchner: Die Ameisen, Biologie und Verhalten. 2. Auflage. C. H. Beck, München 2007, ISBN 978-3-406-44752-5.
- Gesine Heilberg-Rode: Steckbrief:Ameisen. Universität Münster, abgerufen am 9. Mai 2018.
- M. Chinery: Insekten Mitteleuropas. 3. Auflage. Paul Parey, 1984, ISBN 3-490-14018-4, S. 242 ff.
- W. Jacobs, M. Renner: Biologie und Ökologie der Insekten. Gustav Fisher, Stuttgart/New York 1988, ISBN 3-437-20352-5.
- zum optischen Sinn vgl. Wulfila Gronenberg: Structure and function of ant (Hymenoptera: Formicidae) brains: Strength in numbers. In: Myrmecological News. 11 (2008), S. 25–36.
- Rüdiger Wehner: The polarization-vision project: championing organismic biology. In: Fortschritte der Zoologie. 59 (1994), S. 103–143.
- B. Hölldobler, E. O. Wilson: The Ants. Springer 1990, ISBN 3-540-52092-9.
- Erik M. Pilgrim, Carol D. von Dohlen, James P. Pitts: Molecular phylogenetics of Vespoidea indicate paraphyly of the superfamily and novel relationships of its component families and subfamilies. In: Zoologica Scripta. 37, no. 5 (2008), S. 539–560.
- B. Bolton: A new general catalogue of the ants of the world. Harvard University Press, Cambridge 1995, ISBN 0-674-61514-X.
- C. Rabeling, J. M. Brown, M. Verhaagh: Newly discovered sister lineage sheds light on early ant evolution. In: National Academy of Sciences (Hrsg.): Proceedings of the National Academy of Sciences. Band 105, Nr. 39, 30. September 2008, S. 14913–14917.
- C.S. Moreau, C.D. Bell, R. Vila, S.B. Archibald, N.E. Pierce (2006): Phylogeny of the ants: diversification in the age of angiosperms. In: Science, 312, S. 101–104. doi:10.1126/science.1124891.
- Philip S. Ward: Phylogeny, classification, and species-level taxonomy of ants (Hymenoptera: Formicidae). In: Zootaxa. 1668, 2007, S. 549–563. PDF (englisch).
- John S. LaPolla, Gennady M. Dlussky, Vincent Perrichot (2013): Ants and the Fossil Record. In: Annual Revue of Entomology, 58, S. 609–630. doi:10.1146/annurev-ento-120710-100600.
- Philip Barden & David Grimaldi (2013): A New Genus of Highly Specialized Ants in Cretaceous Burmese Amber (Hymenoptera: Formicidae). In: Zootaxa, 3681 (4), S. 405–412.
- Seán G. Brady, Ted R. Schultz, Brian L. Fisher, Philip S. Ward (2006): Evaluating alternative hypotheses for the early evolution and diversification of ants. In: Proceedings of the National Academy of Sciences USA, Band 103, Nr. 48, S. 18172–18177. doi:10.1073/pnas.0605858103.
- Patrick Kück, Francisco Hita Garcia, Bernhard Misof, Karen Meusemann (2011): Improved Phylogenetic Analyses Corroborate a Plausible Position of Martialis heureka in the Ant Tree of Life. In: PLoS ONE, 6(6), S. e21031. doi:10.1371/journal.pone.0021031 (open access).
- Information zur Ökologie der Ameisen im Online Bestimmungsschlüssel. Forstliche Versuchs- und Forschungsanstalt Baden-Württemberg (FVA), abgerufen am 10. Februar 2009.
- H. Kutter, R. Stumper (1969): Hermann Appel, ein leidgeadelter Entomologe (1892–1966). Proceedings of the Sixth International Congress of the International Union for the Study of Social Insects IUSSI (Bern): 275-279., zit. nach Bert Hölldobler, Edward O. Wilson: The Ants. Harvard University Press, 1990. S. 169.
- Jürgen Heinze (2008): The demise of the standard ant (Hymenoptera: Formicidae). Myrmecological News 11: 9-20.
- Heikki Helanterä, Joan E. Strassmann, Juli Carrillo, David C. Queller (2009): Unicolonial ants: where do they come from, what are they and where are they going? TREE Trends in Ecology and Evolution, Bd. 24, Nr. 6: S. 341–349. doi:10.1016/j.tree.2009.01.013
- Tatiana Giraud, Jes S. Pedersen, Laurent Keller (2002): Evolution of supercolonies: The Argentine ants of southern Europe. PNAS Proceedings of the National Academy of Sciences USA vol.99, no.9: 6075–6079. doi:10.1073/pnas.092694199
- M. W. Moffett: Supercolonies of billions in an invasive ant: What is a society?. In: Behavioral Ecology. 23, 2012, S. 925, doi:10.1093/beheco/ars043.
- Andreas Weißflog: Freinestbau von Ameisen (Hymenoptera: Formicidae) in der Kronenregion feuchttropischer Wälder Südostasiens. Dissertation am Fachbereich Biologie und Informatik, J. W. Goethe-Universität in Frankfurt am Main, 2001, DNB 964251981/34.
- W. H. Gotwald, Jr.: Army ants: the biology of social predation. In: Cornell University Press. Ithaka 1995.
- U. Maschwitz, S. Steghaus-Kovac, R. Gaube, H. Hänel: A South East Asian ponerine ant of the genus Leptogenys (Hym., Form.) with army ant life habits. In: Behav. Ecol. Sociobiol. Band 24, 1989, S. 305–316.
- B. J. Adams, L. M. Hooper-Bùi, R. M. Strecker, D. M. O’Brien: Raft formation by the red imported fire ant, Solenopsis invicta. In: Journal of insect science (Online). Band 11, 2011, S. 171, doi:10.1673/031.011.17101. PMID 22950473. PMC 3462402 (freier Volltext).
- Nathan J. Mlot, Craig A. Tovery, David L. Hu: Fire ants self-assembly into waterproof rafts to survive floods. In: PNAS. Band 108, Nr. 19, 2011, S. 7669–7673, doi:10.1073/pnas.1016658108 zitiert in:
Feuerameisen verknuddeln sich zu Rettungsboot. In: Spiegel Online. 26. April 2011. - Rossiter H. Crozier u. a.: A masterpiece of evolution – Oecophylla weaver ants (Hymenoptera: Formicidae). (PDF) In: Myrmecological News. Band 13, 2010, S. 57–71.
- Yamauchi u. a.: Polycalic colonies of the weaver ant Polyrhachis dives. In: Kontyu. Band 55, Nr. 3, 1987, S. 410–420.
- Liefke u. a.: Nesting and food resources of syntopic species of the ant genus Polyrhachis (Hymenoptera, Formicidae) in West-Malaysia. In: Insect Soc. Band 45, 1998, S. 411–425.
- Kenji Hara: Social association brings out the altruism in an ant. In: G. Witzany (Hrsg.): Biocommunication of Animals. Springer, 2014, ISBN 978-94-007-7413-1, S. 149–160.
- Ulrich Maschwitz und Joachim Moog (2000): Communal peeing: a new mode of flood control in ants. Naturwissenschaften 87: 563–565.
- Organisation des Ameisenstaates (Staatsform) im: www.ameisenportal.eu
- Christiaan Peeters & Fuminori Ito (2001): Colony Dispersal and the Evolution of Queen Morphology in Social Hymenoptera. Annual Revue of Entomology 46: 601–630.
- Entwicklung der Zootiermedizin (PDF; 24 MB)
- Heike Feldhaar, Gerhard Gebauer, Nico Blüthgen (2010): Stable isotopes: past and future in exposing secrets of ant nutrition (Hymenoptera: Formicidae). Myrmecological News 13: 3-13.
- K. Fiedler, F. Kuhlmann, B. C. Schlick-Steiner, F. M. Steiner, G. Gebauer (2007): Stable N-isotope signatures of central European ants – assessing positions in a trophic gradient. Insectes Sociaux 54: S. 393–402. doi:10.1007/s00040-007-0959-0
- C. S. Lofgren, W. A. Banks, B. M. Glancey (1975): Biology and Control of Imported Fire Ants. Annual Review of Entomology 20: S. 1–30 doi:10.1146/annurev.en.20.010175.000245
- A. D. Peacock, D. W. Hall, I. C. Smith, A. Goodfellow (1950): The biology and control of the ant pest Monomorium pharaonis (L.). Department of Agriculture of Scotland Miscellaneous Publications 17. 51 S.
- J. Silverman (2005): Why do certain ants thrive in the urban environment? In: C. Y. Lee, W. H. Robinson (Hrsg.): Proceedings of the fifth International Conference on Urban Pest. 10.-12. Juliy 2005, Suntec, Singapore: 29-31
- T. Domisch, L. Finer, S. Neuvonen, P. Niemelä, A. C. Risch, J. Kilpeläinen, M. Ohashi, M. F. Jurgensen (2009): Foraging activity and dietary spectrum of wood ants (Formica rufa group) and their role in nutrient fluxes in boreal forests. Ecological Entomology 34: S. 369–377. doi:10.1111/j.1365-2311.2009.01086.x
- Gustav Wellenstein (1952): Zur Ernährungsbiologie der Roten Waldameise. (Formica rufa L.). Zeitschrift für Pflanzenkrankheiten (Pflanzenpathologie) und Pflanzenschutz 59 (11/12): 430-451. online über JSTOR
- H. Kreisel: Pilze aus Pilzgärten von Atta insularis in Kuba. In: Zeitschrift für allgemeine Mikrobiologie. Band 12, Nr. 8, 1972, ISSN 1521-4028, S. 643–654, doi:10.1002/jobm.19720120805.
- Diana E. Wheeler (1986): Developmental and Physiological Determinants of Caste in Social Hymenoptera: Evolutionary Implications. American Naturalist 128 (1): S. 13-34.
- K. E. Anderson, T. A. Linksvayer, C. R. Smith (2008): The causes and consequences of genetic caste determination in ants (Hymenoptera: Formicidae). Myrmecological News 11: S. 119-132.
- B. Hölldobler, S. H. Bartz (1985): Sociobiology of reproduction in ants. In: B. Hölldobler, M. Lindauer (Hrsg.): Experimental Behavioral Ecology and Sociobiology. Gustav Fischer Verlag, Stuttgart, Seite 237–257.
- C. Dietrich, E. Steiner: Das Leben unserer Ameisen – ein Überblick. In: Kataloge der oberösterreichischen Landesmuseen, Neue Serie. Bd. 85, 2009, S. 26-27 zobodat.at [PDF].
- Daniela Albat: Fremdgesteuert: Nützliche Transportmittel, Dossierartikel auf scinexx vom 26. April 2019
- Franz Groiß: Ameise und Volkskultur. In: Ameisen in Biologie und Volkskultur: Geschätzt, verflucht, allgegenwärtig. Ausstellung Ameisen – unbekannte Faszination vor der Haustüre. Niederösterreichisches Landesmuseum, St. Pölten/Biologiezentrum Linz 2009, S. 165–175, zobodat.at [PDF].
- Johannes Mayerhofer: Die Amastrager. In: Illustriertes Wiener Extrablatt, 23. Oktober 1898, Nr. 292, S. 7. Zitiert in: Volksleben im Land um Wien. Bräuche und Trachten. Schilderungen in Wort und Bild von Johannes Mayerhofer, gesammelt, ergänzt und mit einem Lebensbild versehen von Karl M. Klier. Manutiuspresse, Wien 1969, S. 81–85.
- Bernhard Seifert: Die Ameisen Mittel- und Nordeuropas. Lutra, Görlitz/Tauer 2007, ISBN 978-3-936412-03-1.
- Gunther Tschuch: David und Goliath: Probleme kleiner und großer Tiere. In: Wissenschaftsjournal der Martin-Luther-Universität. Halle-Wittenberg 2000. Ausgabe 4/00, S. 22–24.
- Ant mega-colony takes over world. BBC Earth News
- 15 erstaunliche Fakten über Ameisen. In: ngz-online.de.
- Nest Architecture of Atta laevigata. In: Studies on Neotropical Fauna and Environment. Band 39, Number 2, August 2004, S. 109–116.
- R. Wehner: Taxonomie, Funktionsmorphologie und Zoogeographie der Saharischen Wuestenameise Cataglyphis fortis (Forel 1902) stat. nov. (Insecta: Hymenoptera: Formicidae). In: Senckenbergiana biol. Band 64. antbase.org, 1983, S. 89–132 (Online [PDF; 5,1 MB; abgerufen am 14. Januar 2020]).
