Macroscelides
Macroscelides ist eine Gattung aus der Ordnung der Rüsselspringer (Macroscelidea). Sie umfasst die kleinsten Vertreter der gesamten Ordnungsgruppe. Die Verbreitung beschränkt sich auf das südwestliche Afrika, wo die drei Arten der Gattung überwiegend trockene bis sehr trockene Landschaftsräumen besiedeln, vor allem die Karoo in Südafrika und die Namib in Namibia. Die Populationsdichte wird als sehr gering angesehen. Die Tiere sind nacht- und dämmerungsaktiv sowie bodenbewohnend und leben in monogamen Paarbeziehungen, wobei sich die gemeinsamen Aktivitäten auf die Fortpflanzungsphase beschränken. Die einzelnen Individuen nutzen Streifgebiete, deren Größe je nach Region variiert. Weibchen bringen bis zu dreimal im Jahr je eins bis zwei Jungtiere zur Welt, die als Nestflüchter weit entwickelt sind. Als Hauptnahrung dienen Pflanzen und Insekten, sodass die Vertreter der Gattung Macroscelides als Allesfresser anzusehen sind. In der zweiten Hälfte des 20. Jahrhunderts war mit dem Kurzohrrüsselspringer (Macroscelides proboscideus) nur eine Art bekannt, die Gattung galt damit als monotypisch. Erst Anfang des 21. Jahrhunderts konnten mit dem Namib-Kurzohrrüsselspringer (Macroscelides flavicaudatus) und dem Etendeka-Kurzohrrüsselspringer (Macroscelides micus) zwei weitere Arten beschrieben werden. Der Gesamtbestand von Macroscelides gilt derzeit als ungefährdet.
| Macroscelides | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Kurzohrrüsselspringer (Macroscelides proboscideus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Macroscelides | ||||||||||||
| A. Smith, 1829 |
Merkmale
Habitus

Macroscelides umfasst die kleinsten Vertreter der Rüsselspringer. Die Gesamtlänge variiert von 17,0 bis 23,5 cm, teilweise auch bis zu 24,8 cm, die Schwanzlänge beläuft sich auf 8,4 bis 13 cm und übertrifft somit geringfügig die Kopf-Rumpf-Länge (etwa 105 % der Länge des restlichen Körpers). Das Gewicht schwankt zwischen 19 und 47 g.[1][2] Auffällig sind vor allem der rundliche Körper und der ebenso geformte Kopf, der zusätzlich noch die rüsselartig verlängerte, hochmobile Nase aller Rüsselspringer besitzt, die bei Macroscelides bis zu 12 mm über die Schneidezähne hervorragt. Das Maul ist wie bei allen Rüsselspringern klein und unterständig.[3] Die Ohren zeigen ein markant breites und rundes Profil und sind mit 17 bis 29 mm Länge nur geringfügig kleiner als bei den Elefantenspitzmäusen (Elephantulus). Der Tragus ist groß und dünn und abweichend von den Elefantenspitzmäusen nahezu unbehaart. Die Augen erreichen eine moderate Größe, ihnen fehlt der für die Elefantenspitzmäuse charakteristische helle Augenring. Das Fell ist sehr weich, die einzelnen Haare können bis zu 17 mm lang werden. Die Fellfärbung des Rückens variiert artabhängig von bräunlich über rostfarben bis zu hellgrau. Die Haarbasis ist häufig dunkler gefärbt. Auf dem Bauch überwiegen dagegen meist hellere Farbtöne. Der Schwanz ist im vorderen Bereich nur wenig behaart, nach hinten wird die Behaarung dichter und das Ende wirkt teilweise buschig. An der Unterseite des Schwanzes treten Duftdrüsen auf, die je nach Art unterschiedlich groß und abweichend deutlich sichtbar ausgebildet sein können. Weibliche Tiere besitzen zudem drei Zitzenpaare. Ein auffälliges Merkmal stellen auch die schlanken und langgestreckten Gliedmaßen dar, wobei die vorderen deutlich kürzer als die hinteren erscheinen. Arme und Beine enden in jeweils fünf Zehen, die lange Krallen tragen. Der innere Zeh des Hinterfußes (Hallux, Strahl I) ist dabei sehr kurz und endet mit seiner Krallenspitze etwa auf der halben Länge der folgenden äußeren Zehen.[4] Die Länge des Hinterfußes beträgt 28,5 bis 38 mm.[1][5][2][6][7]
Schädel- und Gebissmerkmale
Der Schädel von Macroscelides erreicht eine Länge von 32 bis 35 mm und an den Jochbögen eine Breite von 20 bis 22 mm.[6] In der Aufsicht zeigt er wie bei allen Rüsselspringern eine etwa dreieckige Form. Er ist bei Macroscelides aber deutlich breiter gebaut und besitzt ein verhältnismäßig kürzeres und schlankeres Rostrum als die anderen Vertreter der Rüsselspringer.[8] Zudem ist der Schädel in Seitenansicht stark aufgerundet und verfügt über relativ große Augenhöhlen. Auffälligstes Kennzeichen des Schädels stellt die extrem große Paukenblase am Schläfenbein dar. Sie ist durch Pneumatisierung deutlich aufgewölbt und außerdem weiter nach außen verlagert als bei den Elefantenspitzmäusen. Dadurch überragt sie bei Betrachtung von oben den hinteren und seitlichen Rand des Schädels, lediglich die Jochbögen kragen weiter hinaus. Durch ihre Größe nimmt sie Bereiche des Warzenteils, des Schuppenteils, des Scheitelbeins und des Hinterhauptsbeins mit ein, zudem ist das Hinterhauptsbein markant verengt und das Scheitel- und das Stirnbein nach vorn gedrängt. Auf der Schädeloberseite entsteht durch die Aufwölbung eine etwa 4 mm breite sagittale Spalte. Das gesamte Volumen des Mittelohrs beträgt 748 mm³, die rechte und die linke Gehörkammer zusammengenommen entsprechen 130 % des Gehirnvolumens. Neben den Kängurumäusen besitzen somit die Arten von Macroscelides die geräumigsten Mittelohre im Bezug auf Körper- und Kopfgröße.[9] Im Mittelkieferknochen und im Gaumenbein treten drei charakteristische Paare von Öffnungen auf, die in Anzahl und Größe ähnlich den Elefantenspitzmäusen und der Rüsselratte sind, aber so nicht bei den Rüsselhündchen auftreten. Der Unterkiefer ist kurz und schlank und besitzt weit aufragende Gelenkenden. Das Gebiss weist folgende Zahnformel auf: . Insgesamt verfügen die Vertreter von Macroscelides also über 40 Zähne.[10] Die Zähne stehen aufgrund des kurzen Rostrums in einer geschlossenen Reihe. Die Schneidezähne sind eher klein, der erste obere verfügt nur über ein Höckerchen, der zweite obere dagegen über zwei, ebenso wie der erste obere Prämolar. Der Eckzahn ähnelt in seiner Form den Schneidezähnen (incisiform). An den beiden mittleren Prämolaren des Unterkiefers, die insgesamt sehr schmal gebaut sind, treten scharfe Spitzen auf (sectorial). Die Backenzähne sind allgemein deutlich hochkroniger als bei den Elefantenspitzmäusen.[11] Die gesamte Zahnreihe im Oberkiefer ist zwischen 15,0 und 16,3 mm lang.[4][12][6][7]
Verbreitung
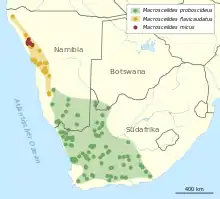
Macroscelides ist im südwestlichen Afrika verbreitet. Die Arten bewohnen vor allem die trockenen wüsten- und halbwüstenartigen Regionen. Hauptsächlich sind sie daher in der Karoo in Südafrika und in der Namib in Namibia zu finden. Beide Habitate sind durch einen sandig-steinigen Untergrund charakterisiert, wobei die Karoo gegenüber der Namib feuchter und vegetationsreicher erscheint. Die Höhenverbreitung reicht vom Niveau des Meeresspiegels bis auf etwa 1400 m. Die Vertreter der Gattung Macroscelides bewohnen insgesamt ein Gebiet von rund 500.000 km², allerdings ist das Verbreitungsgebiet nicht geschlossen. Im Bereich des NamibRand-Naturreservats werden die südlichen Populationen der Karoo durch einen rund 50 km breiten Streifen von den nördlichen der Namib getrennt. Allgemein sind die Macroscelides-Arten nicht sehr häufig. Die Populationsdichte ist hierbei abhängig von den ökologischen Gegebenheiten der jeweiligen Region. In den vegetationsreicheren Gebieten der Karoo können bis zu 1,5 Individuen auf einem Hektar (= 150 Ind. je km²) vorkommen, in der extrem trockenen Namib geht die Populationsdichte auf ein Individuum je km² zurück.[13][5][14][7]
Lebensweise
Territorialverhalten

Die Vertreter der Gattung sind zumeist nacht- und dämmerungsaktiv, können aber auch am Tage auftreten. Sie leben terrestrisch, wo sie sich aufgrund der langen Hinterbeine laufend und teils springend (saltatorisch) fortbewegen, wobei kein rein zweifüßiger Gang ausgebildet ist. Die erreichten Geschwindigkeiten liegen bei bis zu 20 km/h, womit die Tiere für ihre Größe als sehr schnellläufig angesehen werden können (cursorial).[3] Die einzelnen Tiere nutzen Aktionsräume, die über einen längeren Zeitraum unterhalten werden, deren Größe aber stark variiert. In der trockenen und nur wenig bewachsenen Namib können die Aktionsräume eine Größe von bis zu 100 ha erreichen,[15] in der dichter bewachsenen Sukkulenten Karoo, wo auch die Populationsdichte höher ist, liegt die Aktionsraumgröße zwischen 0,8 und 1,7 ha, wobei die der männlichen Tiere durchschnittlich größer ist als die der weiblichen. Die einzelnen Territorien überschneiden sich kaum, weder innerhalb noch zwischen den Geschlechtern. Dadurch herrscht eine gewisse Territorialität vor.[13] Bei allen Rüsselspringern leben Männchen und Weibchen in mehr oder weniger monogamen Paarbeziehungen, welche bis zum Tod eines Partners anhalten können. Diese unter Säugetieren eher ungewöhnliche Form des Sozialsystems ist von ökologischen Faktoren abhängig, etwa der Verfügbarkeit von Nahrungsressourcen, was wiederum die Größe der Territorien beeinflusst und Rückwirkungen auf die sozialen Bindungen und damit einhergehend auf die Reproduktion hat. So zeigen Untersuchungen in der extrem trockenen Namib, dass die Tiere dort mit ihren sehr großen individuellen Streifgebieten zu weniger Territorialität und größerer Variabilität in der Partnerwahl tendieren. In der weniger trockenen Karoo Südafrikas, wo die Aktionsräume deutlich kleiner sind, konnte hingegen eine vermehrte monogame Lebensweise nachgewiesen werden. Tatsächlich scheint die monogame Paarbildung bei Kurzohrrüsselspringern insgesamt eher locker zu sein. Einerseits besuchen Männchen in der Karoo zum Teil mehrere – meist partnerlose – Weibchen, andererseits erfolgen außerhalb der Paarungszeit kaum gemeinsame Aktivitäten der Paare, vielmehr gehen sich die Tiere aus dem Weg.[15][13][16][7]

Innerhalb der Aktionsräume befinden sich mehrere Unterschlüpfe, die nicht nur als Verstecke dienen, sondern auch notwendig sind, um die extremen Temperaturunterschiede zwischen Tag und Nacht auszugleichen. Diese umfassen meist Felsspalten oder Felsüberhänge, Erdlöcher und Gebüsche. In Regionen mit weichem Untergrund wie in der Namib graben die Tiere auch eigene Erdbaue, ansonsten nutzen sie auch die von anderen Bodengräbern angelegten Verstecke, etwa von Rennmäusen oder Erdmännchen. Die Baue können mitunter einige Meter tief in den Untergrund reichen und besitzen mehrere Ein- und Ausgänge, die oft mit Vegetation verdeckt sind. In den Verstecken werden aber keine besonderen Nester eingerichtet. Die Tiere nutzen die einzelnen Unterschlüpfe abwechselnd, manchmal inspizieren sie diese auch nur. Zwischen den einzelnen Wohnquartieren und Fressplätzen legen die Vertreter von Macroscelides Pfade an, indem sie Steinchen und Zweige mit den Vorderfüßen wegräumen. Die Pfade können in trockenen Gebieten teils mehrere hundert Meter lang sein und zeichnen sich als gerade Linien ab. Sie dienen hauptsächlich der schnellen Fortbewegung zwischen den einzelnen Aufenthaltspunkten und der Flucht vor Beutegreifern.[15] Diese Pfade wurden hauptsächlich für die östlichen Populationen der Namib beschrieben und allgemein dem Kurzohrrüsselspringer (M. proboscideus) zugewiesen.[3] Untersuchungen im Jahr 2007 ergaben, dass M. flavicaudatus in der vegetationsarmen Namib ebenfalls derartige Pfade anlegt und nutzt, für M. proboscideus konnte dies aber in der dichter bewachsenen Karoo bisher nicht bestätigt werden.[5][7]
Neben Duftdrüsen unter der Haut und dem damit verbundenen Geruchssinn werden zur Kommunikation untereinander vor allem das Gehör und die Augen eingesetzt. Neben einzelnen Quieklauten erzeugen die Tiere häufig trommelartige Geräusche, die durch kurz hintereinander erfolgende Schläge mit den Hinterfüßen auf dem Boden entstehen. Diese als Podophonie bezeichnete Kommunikationsform ist unter Rüsselspringern sehr häufig und tritt meist unter Stress auf; aufgrund ihrer starken Variation hat sie taxonomischen Wert zur Unterscheidung der Arten. Beim Kurzohrrüsselspringer ist die Trommelserie sehr kurz und umfasst weniger als zehn Schläge in Folge (zumeist drei), die in einem regelmäßigen Abstand mit einer Trittfrequenz von rund 50 bis 80 ms erfolgen.[17][2][7]
Ernährung und Thermoregulation

Die Vertreter von Macroscelides ernähren sich allesfresserisch, die Hauptnahrung stellen Insekten – zumeist Ameisen und Termiten – sowie Pflanzen dar. Allerdings kann die genaue Zusammensetzung in Abhängigkeit von den Jahreszeiten variieren. Im Sommer überwiegen insgesamt Insekten, im Winter dagegen Pflanzen. Im Durchschnitt fressen weibliche Tiere mehr Insekten, was eventuell mit dem erhöhten Energieverbrauch bei der Aufzucht des Nachwuchses und der damit verbundenen Milchproduktion zusammenhängt.[18][19] Die Nahrung wird am Boden mit der langen Nase über den Geruchssinn aufgespürt, während die Aufnahme mit der langen Zunge erfolgt, welche mehrere Millimeter vor die Nasenspitze ausgestreckt werden kann.[3][7]
Die Thermoregulation ist atypisch für kleine Säugetiere in ariden Regionen. Die Körpertemperatur bleibt trotz der zwischen 5 und 38 °C variierenden Außentemperatur relativ konstant und liegt bei 35 bis 39 °C. Im Bereich von 10 bis 25 °C Außentemperatur beträgt sie im Mittel etwa 36 °C, erst bei höheren oder niedrigeren Temperaturen in der Umgebung verändert sich auch die Körpertemperatur. Erreicht wird die Stabilität durch verschiedene Verhaltensweisen von Macroscelides, etwa durch Sonnenbaden in den frühen Morgenstunden oder verbleiben im Unterschlupf bei kühlen Bedingungen und somit Anpassung des Tagesablaufs an die entsprechenden Wetterverhältnisse. Außerdem können die Vertreter von Macroscelides bei geringem Nahrungsangebot verbunden mit niedrigen Umgebungstemperaturen von circa 10 bis 15 °C in eine Kältestarre (Torpor) verfallen. Die Dauer des Torpors reicht von weniger als einer Stunde bis zu etwa 18 Stunden. In der Regel überwiegen kurze Starrephasen bis maximal 8 Stunden, bei einer Umgebungstemperatur von nur 10 °C werden sie aber deutlich länger und überschreiten 12 Stunden und mehr. Der Torpor tritt aber nicht ein, wenn trotz niedriger Umgebungstemperatur genug Nahrung zur Verfügung steht. Während der Erstarrung sinkt die Körpertemperatur bis nahe an die Außentemperatur herab und kann bis auf unter 17 °C fallen, die niedrigste gemessene Temperatur erreichte 9,4 °C, was niedriger ist als bei den meisten Säugetierarten, die ähnliche Torporphasen durchlaufen. Der Wert liegt dabei nahe an dem, der für Winterschläfer bekannt ist. Darüber hinaus verfügt Macroscelides über eine effiziente Wasserspeicherung im Enddarm verbunden mit nur geringem Verlust an Wasser an der Hautoberfläche (Transpiration). Die Flüssigkeit wird weitgehend über die Nahrung aufgenommen, zum Ausgleich des Wasserhaushaltes dienen unter anderem auch die feuchteren Bedingungen in den Unterschlüpfen. Zudem sind die Nieren als Anpassung an die Lebensbedingungen in wüstenartigen Landschaften zu einer längeren Speicherung von Wasser befähigt, ihre Eignung zur Produktion von hochkonzentriertem Urin ist aber nicht ganz so stark ausgeprägt wie bei den Elefantenspitzmäusen.[20][21][22][7]
Fortpflanzung
Die Fortpflanzung ist ganzjährig möglich, erfolgt aber weitgehend in den Frühjahr- und Sommermonaten. Kurz vor dem Einsetzen und während des Östrus beim weiblichen Tier beginnt das Männchen diesem zu folgen, womit die Zeit der gemeinsamen Aktivitäten der einzelnen Paare startet. Die Tragzeit liegt bei etwa 56 Tagen, danach kommen ein bis zwei Jungtiere zur Welt. Diese sind Nestflüchter und haben geöffnete Augen und ein weiches Fell. Sie verbringen die erste Zeit in einem Unterschlupf, der abgetrennt ist vom Versteck des Vater- und des Muttertiers. Eine väterliche Betreuung des Nachwuchses findet nicht statt, die Mutter besucht die Jungtiere nur unregelmäßig zum Säugen, in der Regel einmal täglich. Diese Art der Aufzucht der Nachkommen wird als „System des Absentismus der Mutter“ bezeichnet und dient möglicherweise dazu, die Jungen weitgehend geruchsneutral zu halten, womit sie besser vor dem Aufspüren von Fressfeinden geschützt sind.[15] Die Säugezeit umfasst nur zwei bis drei Wochen, doch bereits nach wenigen Tagen nehmen die Jungtiere erstmals feste Nahrung zu sich. Nach rund sechs Wochen ist der Nachwuchs geschlechtsreif. Die Lebenserwartung in freier Wildbahn ist unbekannt, wird aber auf zwei Jahre geschätzt.[2][6][7]
Systematik
Innere Systematik der Rüsselspringer nach Heritage et al. 2020[23]
|
Macroscelides ist eine Gattung aus der Ordnung der Rüsselspringer (Macroscelidea). Die Rüsselspringer sind eine nur in Afrika vorkommende Gruppe der Säugetiere. Ihr werden insgesamt sechs Gattungen zugewiesen, die sich auf zwei Familien verteilen.[24] Die Rhynchocyonidae umfassen dabei die Rüsselhündchen (Rhynchocyon) als einziges Mitglied, sie sind somit monotypisch. Die Rüsselhündchen stellen nicht nur die größten Vertreter der Rüsselspringer dar, sondern kommen auch als einzige Gruppe in überwiegend bewaldeten Habitaten vor. Ihnen gegenüber stehen die Macroscelididae. Zu diesen zählen neben Macroscelides auch die Elefantenspitzmäuse (Elephantulus), die Arten der Gattung Galegeeska, die Rüsselratte (Petrodromus) und die Nordafrikanische Elefantenspitzmaus (Petrosaltator). Alle Vertreter der Macroscelididae sind an eher trockene Offenlandschaften bis hin zu wüstenartigen Regionen angepasst.[10] Laut molekulargenetischen Untersuchungen bildet Macroscelides die Schwestergruppe einer Klade, die sich aus Petrodromus und Petrosaltator zusammensetzt.[25][26] Darauf weisen neben den molekulargenetischen Untersuchungen zusätzlich Analysen der Schädelgestaltung und speziell des Ohrs hin.[8][27] Aus diesem Grund werden Macroscelides, Petrodromus und Petrosaltator sowie zuzüglich Galegeeska in der Unterfamilie der Macroscelidinae vereint, die den Elephantulinae mit den Elefantenspitzmäusen gegenüberstehen.[26] Die Trennung der beiden Familien, Rhynchocyonidae und Macroscelididae, fand bereits im Unteren Oligozän vor etwa 32,8 Millionen Jahren statt, eine stärkere Diversifizierung der Macroscelididae vollzog sich ab dem Oberen Oligozän vor rund 28,5 Millionen Jahren.[25][23]
Innere Systematik von Macroscelides nach Dumbacher et al. 2014[1]
|
Die Gattung Macroscelides umfasst drei rezente Arten:
- Namib-Kurzohrrüsselspringer (Macroscelides flavicaudatus Lundholm, 1955); in der Namib von Namibia
- Etendeka-Kurzohrrüsselspringer (Macroscelides micus Dumbacher, Rathbun, Osborne, Griffin & Eiseb, 2014); in der Etendeka-Region von Namibia
- Kurzohrrüsselspringer (Macroscelides proboscideus (Shaw, 1800)); in der Karoo von Südafrika bis Namibia
Die wissenschaftliche Erstbeschreibung von Macroscelides erfolgte 1829 durch Andrew Smith. Er legte dabei eine umfängliche Beschreibung des Gebisses vor und hob des Weiteren die lange, rüsselartige Schnauze, die mittelgroßen Augen und vor allem die gegenüber den Vorderbeinen deutlich langen Hinterbeine hervor. Auf letztere bezieht sich auch der Gattungsname Macroscelides, der sich aus den griechischen Wörtern μακρὁς (makros „groß“) und σκέλος (skélos „Bein“) zusammensetzt.[28]
Forschungsgeschichte

Die taxonomische Geschichte von Macroscelides ist komplex. Bereits im Jahr 1800 wurde von George Shaw der Kurzohrrüsselspringer (Macroscelides proboscideus) eingeführt, die Erstbeschreibung tätigte er aber unter dem Namen Sorex proboscideus. Damit verwies Shaw den Kurzohrrüsselspringer zu den Rotzahnspitzmäusen.[29] Fast drei Dekaden später, im Jahr 1829, etablierte Andrew Smith neben dem Gattungsnamen Macroscelides auch die Art M. typus (die er selbst 1838 in M. typicus korrigierte[30]).[28] Im Laufe des 19. Jahrhunderts wurden zahlreiche neue Arten der Rüsselspringer beschrieben, die häufig eine Zuweisung zu Macroscelides erhielten. Nicht wenige dieser neuen Formen zeigten aber in einigen anatomischen Merkmalen Abweichungen zu Macroscelides. Aus diesem Grund spalteten im Jahr 1906 Oldfield Thomas und Harold Schwann die neu benannten Gattungen Elephantulus und Nasilio ab, die sich beide durch weniger stark aufgeblähte Paukenblasen von Macroscelides unterschieden (untereinander aber eine abweichende Anzahl von hinteren Backenzähnen besaßen), und ordneten diesen einen größeren Teil der bekannten Vertreter zu.[31] Dadurch reduzierte sich die Anzahl der Arten von Macroscelides in der ersten Hälfte des 20. Jahrhunderts auf vier. In einer im Jahr 1951 durch Austin Roberts erfolgten Revision der Gattung erkannte dieser mit M. melanotis und M. proboscideus nur zwei Arten an, letzterer wies er aber insgesamt neun Unterarten zu. Eine zehnte Unterart wurde mit M. proboscideus flavicaudatus vier Jahre später von Bengt Lundholm eingeführt.[32] Eine erneute Revision der Rüsselspringer durch Gordon Barclay Corbet und John Hanks im Jahr 1968 erbrachte dagegen nur eine valide Art, M. proboscideus. Die bis zu zehn verschiedenen Unterarten, deren Unterscheidung meist nur auf variierende Fellfarben und abweichende, durchschnittliche Körpermaße beruhten, wurden auf zwei reduziert. So umfasste die Nominatform M. p. proboscideus dunkler gefärbte Formen aus dem größten Bereich des südlichen Afrikas und M. p. flavicaudatus hellere Exemplare, die eher im nördlichen Namibia beheimatet waren. Die Gattung Macroscelides erhielt dadurch den Status eines monotypischen Taxons.[4]
Dieser Einstufung blieb über vier Dekaden gültig. Die unterschiedlichen Fellzeichnungen der beiden Unterarten galten dabei als Anpassung an lokale Habitatbedingungen. So wurde die bräunliche Fellfärbung von M. p. proboscideus auf die dunkleren Farbtöne der Karoo zurückgeführt, die zudem stärker von Schatten beeinflusst ist. Das deutlich hellere Fell von M. p. flavicaudatus stellte dagegen eine Anpassung an die helleren und sonnigeren Regionen der Namib dar. Anfang des 21. Jahrhunderts durchgeführte molekulargenetische Untersuchungen in Kombination mit Feldforschungen vor Ort verwiesen auf eine stärker zu differenzierende Unterteilung der Gattung Macroscelides. Anhand der genetischen Analysen konnte eine nördliche und eine südliche Population unterschieden werden, die beide seit längerer Zeit isoliert voneinander bestanden. Dies konnte auch durch die Vorort-Untersuchungen bestätigt werden, die aufzeigten, dass die Verbreitungsgebiete der beiden Populationen im NamibRand-Naturreservat durch einen mindestens 50 km breiten Korridor getrennt sind, der Kontakte zueinander verhindert. Die Forscher sahen es damit als erwiesen an, dass die nördliche Gruppe mit M. p. flavicaudatus und die südliche Gruppe mit M. p. proboscideus nicht nur jeweils als Unterart einer Art zu betrachten ist, sondern jeweils eine eigenständige Art repräsentiert. Aufgrund dieser Ergebnisse wurde im Jahr 2012 die nördliche Unterart in den Artstatus erhoben, womit der Namib-Kurzohrrüsselspringer (Macroscelides flavicaudatus) neben dem Kurzohrrüsselspringer die zweite anerkannte Art der Gattung Macroscelides bildete. Nur zwei Jahre später konnte mit dem Etendeka-Kurzohrrüsselspringer (Macroscelides micus) eine dritte Art etabliert werden. Diese kommt regional sympatrisch mit dem Namib-Kurzohrrüsselspringer vor, zeichnet sich aber im Gegensatz zu dieser Art durch ein dunkles, rostfarbenes Fell aus.[5][1]
Stammesgeschichte
Die Stammesgeschichte der Macroscelidea reicht bis in das Paläozän vor mehr als 60 Millionen Jahren zurück.[33] Die Gattung Macroscelides trat demgegenüber vergleichsweise spät in Erscheinung, im Vergleich mit den nahe verwandten Elefantenspitzmäusen (Elephantulus) ist sie aber deutlich seltener im Fossilbericht vertreten. Die ältesten Funde sind aus dem späten Pliozän vor etwa 3,5 Millionen Jahren bekannt. Große Bedeutung haben hier Fossilreste aus der südafrikanischen Fundstelle Makapansgat. Diese herausragende Fundstelle enthält die vielfältigste Kollektion von Rüsselspringern aus dem südlichen Afrika mit mehr als 250 identifizierten Individuen, wobei Elefantenspitzmäuse bei weitem am häufigsten sind. Die aufgefundenen Reste werden als Akkumulationen von Greifvögeln angesehen, die sich über hunderte oder tausende von Jahren ansammelten. Aus Kromdraai liegen Reste vor, die mit knapp 2 Millionen Jahren etwas jünger sind. Die sowohl in Makapansgat als auch in Kromdraai entdeckten Knochen und Zahnreste lassen auf Tiere schließen, die durchschnittlich kleiner als der heutige Kurzohrrüsselspringer waren sowie eine kürzere Schnauze und niedrigere Zähne besaßen. Häufig werden sie daher der Form Macroscelides proboscideus vagans und somit als Unterart dem Kurzohrrüsselspringer zugewiesen. Da die Zähne sich auch in Einzelmerkmalen von den heutigen Vertretern unterscheiden, sehen andere Forscher diesen Vertreter als eigenständige, heute ausgestorbene Art Macroscelides vagans an.[34] Aus Sterkfontein wiederum wurden Funde mit einem Alter von 1,7 Millionen Jahren berichtet, die um 25 % größer als die früheren Formen sind und sich kaum vom heutigen Kurzohrrüsselspringer unterscheiden. Dieser Vertreter ist an der Fundstelle noch bis in die oberen Bereiche der Fossillagen nachweisbar, deren Alter bei etwa 100.000 Jahren liegt.[35] Bemerkenswert ist, dass alle bisher aufgefundenen fossilen Reste von Macroscelides aus einer Region wenigstens 500 km östlich des heutigen Verbreitungsgebietes stammen, weswegen die Beurteilung einer Beziehung zu den heutigen Arten schwierig ist. Aufgrund der abweichenden biogeographischen Verbreitung in der erdgeschichtlichen Vergangenheit sind daher weitere Untersuchungen notwendig, um eine exaktere systematische Zuweisung der Fossilfunde zu ermöglichen.[36][11]
Neben diesen eindeutigen Funden von Macroscelides liegen auch noch einzelne Reste vor, die nur unsicher zugewiesen werden und eventuell auch die nahe verwandte Gattung Elephantulus repräsentieren könnten. Hierzu gehören etwa die Fossilien der Wonderwerk-Höhle in Südafrika, die ein pleistozänes Alter besitzen.[37][36]
Bedrohung und Schutz
Die Vertreter der Gattung Macroscelides sind aus einem räumlich stark begrenzten Gebiet im südwestlichen Afrika bekannt, das von trockenem Klima beeinflusst ist. Trotz der angenommenen geringen Populationsdichte wird der Gesamtbestand der Gattung sowie die einzelnen Arten von der IUCN als nicht gefährdet eingestuft. Größeres Gefährdungspotenzial ist momentan nicht bekannt. Lokal könnte es vor allem im Bereich von Flussniederungen zur Überprägung der Landschaften durch Siedlungsbau oder Kultivierung der Flächen kommen.[14]
Literatur
- John P. Dumbacher, Galen B. Rathbun, Timothy O. Osborne, Michael Griffin und Seth J. Eiseb: A new species of round-eared sengi (genus Macroscelides) from Namibia. Journal of Mammalogy 95 (3), 2014, S. 443–454
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 ISBN 978-84-16728-08-4
- Mike Perrin und Galen B. Rathbun: Macroscelides proboscideus Round-eared Sengi (Round-eared Elephant-shrew). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 277–278
- Galen B. Rathbun: Macroscelides proboscideus (Shaw, 1800) - Round-eared elephant-shrew. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 25–27
Einzelnachweise
- John P. Dumbacher, Galen B. Rathbun, Timothy O. Osborne, Michael Griffin und Seth J. Eiseb: A new species of round-eared sengi (genus Macroscelides) from Namibia. Journal of Mammalogy 95 (3), 2014, S. 443–454
- Galen B. Rathbun: Macroscelides proboscideus (Shaw, 1800) - Round-eared elephant-shrew. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 25–27
- Galen B. Rathbun: Why is there discordant diversity in sengi (Mammalia: Afrotheria: Macroscelidea) taxonomy and ecology? African Journal of Ecology 47, 2009, S. 1–13
- G. B. Corbet und J. Hanks: A revision of the elephant-shrews, Family Macroscelididae. Bulletin of the British Museum (Natural History) Zoology 16, 1968, S. 47–111
- John P. Dumbacher, Galen B. Rathbun, Hanneline A. Smit und Seth J. Eiseb: Phylogeny and Taxonomy of the Round-Eared Sengis or Elephant-Shrews, Genus Macroscelides (Mammalia, Afrotheria, Macroscelidea). Plos ONE 7 (3), 2012, S. e32410
- Mike Perrin und Galen B. Rathbun: Macroscelides proboscideus Round-eared Sengi (Round-eared Elephant-shrew). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 277–278
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 ISBN 978-84-16728-08-4
- Massimiliano Scalici und Fabiana Panchetti: Morphological cranial diversity contributes to phylogeny in soft-furred sengis (Afrotheria, Macroscelidea). Zoology 114, 2011, S. 85–94
- Matthew J. Mason: Structure and function of the mammalian middle ear. I: Large middle ears in small desert mammals. Journal of Anatomy 2015 doi:10.1111/joa.12313
- Mike Perrin und Galen B. Rathbun: Order Macroscelidea – Sengis (Elephant-shrews). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 258–260
- Patricia A. Holroyd: Macroscelidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 89–98
- Jan Ihlau, Friederike Kachel und Ulrich Zeller: Graphical description of the ventral side of a sengi's (Macroscelides proboscideus) skull. Afrotherian Conservation 4, 2006, S. 11–12
- Melanie Schubert, Neville Pillay, David O. Ribble und Carsten Schradin: The Round-Eared Sengi and the Evolution of Social Monogamy: Factors that Constrain Males to Live with a Single Female. Ethology 115, 2009, S. 972–985
- Macroscelides in der Roten Liste gefährdeter Arten der IUCN 2015.2. Abgerufen am 26. August 2015.
- E. G. Sauer: Zum Sozialverhalten der Kurzohrigen Elefantenspitzmaus Macroscelides proboscideus. Zeitschrift für Säugetierkunde 38, 1973, S. 65–97
- Melanie Schubert, Carsten Schradin, Heiko G. Rödel, Neville Pillay und David O. Ribble: Male mate guarding in a socially monogamous mammal, the round-eared sengi: on costs and trade-offs. Behavioral Ecology and Sociobiology 64, 2009, S. 257–264
- A. S. Faurie, E. R. Dempster und M. R. Perrin: Footdrumming patterns of southern African elephant-shrews. Mammalia 60 (4), 1996, S. 567–576
- Graham I. H. Kerley: Trophic status of small mammals in the semi-arid Karoo, South Africa. Journal of Zoology 226, 1992, S. 563–572
- M. J. Lawes und M. R. Perrin: Risk-sensitive foraging behaviour of the round-eared elephant shrew (Macroscelides proboscideus). Behavioral Ecology and Sociobiology 37, 1995, S. 31–37
- C. T. Downs: Renal structure, and the effect of an insectivorous diet on urine composition of Southern African Elephant-Shrew species (Macroscelidea). Mammalia 60 (4), 1996, S. 577–589
- B. G. Lovegrove, M. J. lawes und L. Roxburgh: Confirmation of plesiomorphic daily torpor in mammals: the round-eared elephant shrew Macroscelides proboscideus (Macroscelidea). Journal of Comparative Physiology 169, 1999, S. 453–460
- Lizanne Roxburgh und M. R. Perrin: Temperature regulation and activity pattern of the Round-eared Elephant shrew (Macroscelides proboscideus. Journal of thermal Biology 19 (1), 1994, S. 13–20
- Steven Heritage, Houssein Rayaleh, Djama G. Awaleh und Galen B. Rathbun: New records of a lost species and a geographic range expansion for sengis in the Horn of Africa. PeerJ 8, 2020, S. e9652, doi:10.7717/peerj.9652
- Brigitte Senut und Martin Pickford: Micro-cursorial mammals from the late Eocene tufas at Eocliff, Namibia. Communications of the Geological Survey of Namibia 23, 2021, S. 90–160
- Hanneline Adri Smit, Bettine Jansen van Vuuren, P. C. M. O’Brien, M. Ferguson-Smith, F. Yang und T. J. Robinson: Phylogenetic relationships of elephant-shrews (Afrotheria, Macroscelididae). Journal of Zoology 284, 2011, S. 133–143
- John P. Dumbacher, Elizabeth J. Carlen und Galen B. Rathbun: Petrosaltator gen. nov., a new genus replacement for the North African sengi Elephantulus rozeti (Macroscelidea; Macroscelididae). Zootaxa 4136 (3), 2016, S. 567–579
- Julien Benoit, Nick Crumpton, Samuel Merigeaud und Rodolphe Tabuce: Petrosal and Bony Labyrinth Morphology Supports Paraphyly ofElephantulusWithin Macroscelididae (Mammalia, Afrotheria). Journal of Mammal Evolution 21, 2014, S. 173–193
- Andrew Smith: Contributions to the natural history of South Africa. Zoological Journal of London 4, 1829, S. 433–444 (S. 435–436) ()
- George Shaw: General Zoology or Systematic Natural History. Volume I Part II. Mammalia. London, 1800, S. 249–552 (S. 536) ()
- Andrew Smith: Illustrations of the Zoology of South Africa. Mammalia London, 1839 (Tafel 10) ()
- Oldfield Thomas und Harold Schwann: The Rudd exploration of South Africa. V. List of mammals obtained by Mr. Grant in the North East Transvaal. Proceedings of the Zoological Society of London 1906, S. 575–591 ()
- Bengt G. Lundholm: Descriptions of new mammals. Annals of the Transvaal Museum 22, 1955, S. 279–303
- Jerry J. Hooker und Donald E. Russell: Early Palaeogene Louisinidae (Macroscelidea, Mammalia), their relationships and north European diversity. Zoological Journal of the Linnean Society 164, 2012, S. 856–936
- T. N. Pocock: Plio-Pleistocene fossil mammalian microfauna of Southern Africa - a preliminary report including description of two new fossil muroid genera (Mammalia: Rodentia). Palaeontologia Africana 26, 1987, S. 69–91
- D. M. Avery: The Plio-Pleistocene vegetation and climate of Sterkfontein and Swartkrans, South Africa, based on micromammals. Journal of Human Evolution 41, 2001, S. 113–132
- Patricia A. Holroyd: Past records of Elephantulus and Macroscelides: geographic and taxonomic issues. Afrotherian Conservation 7, 2009, S. 3–7
- D. M. Avery: Pleistocene micromammals from Wonderwerk Cave, South Africa: practical issues. Journal of Archaeological Science 34, 2007, S. 613–625
Weblinks
- Macroscelides flavicaudatus in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Rathbun & Eiseb, 2013. Abgerufen am 16. August 2015.
- Macroscelides micus in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Rathbun & Dumbacher, 2013. Abgerufen am 16. August 2015.
- Macroscelides proboscideus in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Rathbun & Smit-Robinson, 2013. Abgerufen am 16. August 2015.