Oktettregel
Die Oktettregel oder Acht-Elektronen-Regel ist eine klassische Regel der Chemie. Sie besagt, dass die Elektronenkonfiguration von Atomen der Hauptgruppenelemente ab der zweiten Periode des Periodensystems in Molekülen maximal acht äußere Elektronen (Valenzelektronen) bzw. vier Paare beträgt. Die Atome sind also bestrebt, die Edelgaskonfiguration anzunehmen. Die Oktettregel ist damit ein Spezialfall der umfassenderen Edelgasregel.[1]
Atome, die sich zumeist entsprechend der Oktettregel verhalten
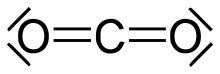
Die Oktettregel gilt häufig nur für die Hauptgruppenelemente der 2. Periode. Dazu gehören die Elemente Kohlenstoff, Stickstoff, Sauerstoff und Fluor. Diese Elemente erreichen in den meisten ihrer Verbindungen die Elektronenkonfiguration des Edelgases Neon. Die Kohlenstoff-, Stickstoff- und Fluoratome besitzen auch in ihrem elementaren Zustand – als Diamant oder Fulleren, als Distickstoff (N2), Trisauerstoff- (O3, Ozon) und Difluormolekül (F2) – die Neon-Elektronenkonfiguration mit acht Valenzelektronen. Für alle genannten Atome gilt, dass sie zwar von weniger als 8 Elektronen umgeben sein können (z. B. als R3C+, Carbokation), aber niemals von mehr als 8.
Ausnahmen
Die Oktettregel gilt für die meisten stabilen Verbindungen der oben genannten Elemente. Es gibt aber auch Ausnahmen. Deutlich mehr Ausnahmen gibt es für Elemente der höheren Perioden. Elemente wie Zinn und Blei bilden beispielsweise auch Kationen in der zweiwertigen Oxidationsstufe mit einem einsamen Elektronenpaar (Relativistischer Effekt).
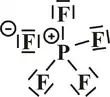
Allerdings gibt es viele Moleküle, bei denen nur formal das Elektronen-Oktett überschritten wird (Oktetterweiterung). Typische Beispiele hierfür sind Phosphorpentafluorid (PF5), Schwefelhexafluorid (SF6) oder Iodheptafluorid (IF7). Früher wurden für die über das Oktett hinausgehenden Bindungselektronen häufig energetisch höherliegende unbesetzte d-Orbitale bemüht. Detailliertere quantenmechanische Betrachtungen zeigen jedoch, dass die d-Orbitale wegen der enormen Energiedifferenz zu den s- und p-Valenzorbitalen keine wesentliche Rolle spielen sollten. Alternative Beschreibungen dieser Moleküle nutzen Mehrzentrenbindungen oder partiell ionische Formulierungen (z. B. PF4+F−, SF42+(F−)2, IF43+(F−)3).
Moleküle, für die sich Oktettregel-konforme Lewis-Formeln aufstellen lassen, bei denen aber trotzdem häufig Formeln mit mehr als 4 Bindungsstrichen benutzt werden, sollten nicht als Ausnahmen gewertet werden. Als typische Beispiele seien hier Schwefelsäure oder Schwefeldioxid genannt.
Wasserstoff und die leichten Kationen Li+, Be2+ und B3+ erfüllen die Oktettregel nicht, da sie zu wenige Elektronen besitzen und die zugehörige Edelgaskonfiguration (Helium), die in Verbindungen erreicht wird, nur zwei Elektronen besitzt. Dies ist aber eher eine formale Einordnung, die Edelgasregel erfüllen sie aber.
Stickstoff und Sauerstoff
Ausnahmen sind beispielsweise die Stickoxide Stickstoffmonoxid NO, auch Stickoxid genannt, und das Stickstoffdioxid NO2. Die Moleküle dieser Verbindungen sind beständige Radikale, haben also eine ungerade Elektronenzahl, was mit der Oktettregel prinzipiell unverträglich ist.
Eine weitere Ausnahme von der Oktettregel ist das Disauerstoffmolekül O2: Messungen zeigen, dass es zwei ungepaarte Elektronen enthält. Die Edelgaskonfiguration erfordert aber gepaarte Elektronen. Das Disauerstoffmolekül kann bei der Reaktion von Kalium, Rubidium und Caesium mit Luft in das Hyperoxid-Ion O2− übergehen; es entstehen die Hyperoxide KO2, RbO2 und CsO2. Das Hyperoxid-Ion hat eine ungerade Elektronenzahl und damit ebenfalls kein Oktett.
Keine Gültigkeit für instabile Zwischenstufen
Die Regel gilt vor allem für isolierbare Verbindungen. Bei vielen Reaktionen treten instabile, aber nachweisbare Zwischenprodukte auf, die der Oktettregel nicht gehorchen, z. B. Radikale wie das Chlorradikal oder Carbokationen, bei denen der Kohlenstoff nur sechs Elektronen hat, beispielsweise bei der Umsetzung von Butylchlorid. Nitrene und Carbene seien ebenfalls genannt.
Bei Übergangsmetallverbindungen findet man eine analoge Regel: die 18-Elektronen-Regel. Diese ist aber – wenn überhaupt – nur hinlänglich gut erfüllt für Komplexe mit vorwiegend kovalent gebundenen Liganden, aber selbst hier gibt es unzählige Ausnahmen.
Einzelnachweise
- Eintrag zu Lewis octet rule. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.LT07065 – Version: 2.1.5.