Hückel-Regel
Mit der Hückel-Regel, benannt nach Erich Hückel (1896–1980), lässt sich vorhersagen, ob es sich bei einer chemischen Verbindung um ein aromatisches Molekül handelt. Sie kann aus der umfassenderen Hückel-Näherung abgeleitet werden.
Ein planares, cyclisch durchkonjugiertes Molekül ist mit [4n+2] π-Elektronen (einer ungeraden Zahl von Elektronenpaaren; Beispiel: n=1, [4·1+2=6], also drei Elektronenpaare) besonders stabil und wird als Aromat bezeichnet.[1]
Bei [4n] π-Elektronen (einer geraden Zahl von Elektronenpaaren; Beispiel: n=2, [4·2=8], also vier Elektronenpaare) ist es instabil und wird als Antiaromat bezeichnet. Für n sind dabei positive, ganze Zahlen und 0 einsetzbar (n = 0, 1, 2, 3 …).
Beispiele
Kohlenwasserstoffe
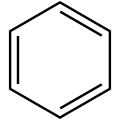
Das wichtigste Beispiel ist Benzol, das mit 6 π-Elektronen (n = 1) die Regel erfüllt und als Sechseck außerdem den idealen Bindungswinkel für sp2-hybridisierte Kohlenwasserstoffe bildet. Polycyclische (kondensierte) Aromaten entstehen, wenn man ein oder mehrere Male weitere 4 Kohlenstoffatome an einer Kante hinzufügt, für sie gilt allerdings die Hückelregel nicht mehr (siehe Einschränkungen).
Heteroaromaten
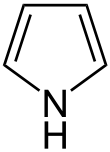
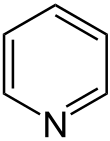
Aromatische Verbindungen, die nicht nur aus Kohlenstoff und Wasserstoff bestehen, werden als Heteroaromaten bezeichnet. Sie können 5-er oder 6-er Ringe sein. Bei 5-er Ringen (z. B. Pyrrol, Furan, Thiophen, Selenophen) stellt das Heteroatom ein ganzes freies Elektronenpaar zur Verfügung. Bei 6-er Ringen (z. B. Pyridin) zeigt das freie Elektronenpaar des Heteroatoms nach außen.
Zu beachten ist, dass aufgrund der beschriebenen Bindungsverhältnisse der Stickstoff in Pyrrol an einen Wasserstoff gebunden ist, in Pyridin jedoch nicht. Ungeladene, cyclisch konjugierte 6-er Ringe mit Sauerstoff oder Schwefel sind gar nicht möglich.
Aromatische Ionen
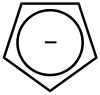
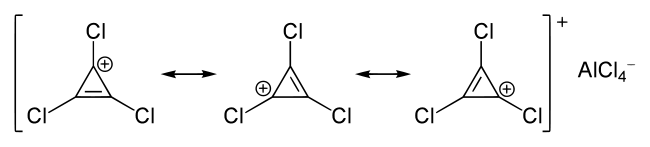
Das Cyclopropenium-Kation und das Cyclopentadienyl-Anion erfüllen mit 2 (n = 0) bzw. 6 (n = 1) π-Elektronen die Hückel-Regel. Sie sind daher für Ionen besonders stabil. Cyclopentadienyl ist ein wichtiger einfach negativ geladener Ligand in der Organometallchemie.
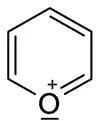
Ein Beispiel für heteroaromatische Ionen ist das Pyrylium-Kation (n=1), das zur Gruppe der Oxoniumionen gehört. Verbindungen mit substituierter Pyryliumstruktur kommen auch in der Natur vor, zum Beispiel in den Anthocyanen.
Einschränkungen
Die Hückel-Regel gilt nur für monocyclische Moleküle. Nur dort kann die Hückel-Näherung eine allgemeine Aussage machen, da sich die Energieschemata dieser Verbindungen (Frost-Musulin-Kreis) besonders leicht berechnen lassen. Sie trifft keine Aussage über Systeme mit mehreren Ringen, z. B. polycyclische aromatische Kohlenwasserstoffe (PAK).
Folgende PAK verhalten sich gemäß der Hückelregel: Naphthalin (10 π-Elektronen), Anthracen (14 π-Elektronen), Phenanthren (14 π-Elektronen).
Folgende PAK verhalten sich entgegen der Hückelregel: Pyren (16 e−), Benzpyren (20 e−), Fluoranthen (16 e−).
Des Weiteren gilt die Regel nur bei Molekülen, die zwei Seiten haben. Hat das Molekül nur eine Seite, wie beispielsweise ein Möbiusband, verschwindet die Aromatizität. Es gibt sogar Moleküle, die beide Eigenschaften (Ein- oder Zweiseitigkeit) haben können, je nachdem in welchem Stoff sie gelöst sind.[2]
Siehe auch
Einzelnachweise
- Eintrag zu Hückel (4n + 2) rule. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02867 – Version: 2.1.5.
- Stepień M, Latos-Grazyński L, Sprutta N, Chwalisz P, Szterenberg L: Expanded porphyrin with a split personality: a Hückel-Möbius aromaticity switch. In: Angew. Chem. Int. Ed. Engl.. 46, Nr. 41, 2007, S. 7869–73. doi:10.1002/anie.200700555. PMID 17607678.