Valenzstrichformel
Die Valenzstrichformel (engl. valence structural formula) ist ein Konzept aus der Chemie, bei dem chemische Bindungen zweidimensional veranschaulicht werden. Striche zwischen den Atomen stellen Einfach- oder Mehrfachbindungen in einem Molekül dar.[1] Sie dient dem grundlegenden Verständnis der Struktur von einfachen Molekülen. Noch heute werden Moleküle mit Atombindung mit dieser Art der Strukturformel dargestellt und Reaktionsmechanismen damit veranschaulicht. Teilweise werden bei der Darstellung von Molekülen in der Valenzstrichformel die Bindungswinkel vernachlässigt, häufig jedoch auch eingezeichnet. Zudem existieren Mischformen beider Darstellungsweisen.
| Strukturformeln | Andere Darstellungsweisen | ||||||
|---|---|---|---|---|---|---|---|
| Elektronenformel | Valenzstrichformel | Keilstrichformel | Skelettformel | Konstitutionsformel | Summenformel | Verhältnisformel | |
| Methan | 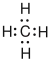 |
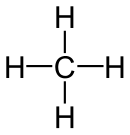 |
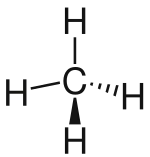 |
existiert nicht | CH4 | CH4 | CH4 |
| Propan | 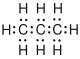 |
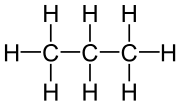 |
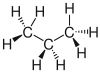 |
CH3–CH2–CH3 | C3H8 | C3H8 | |
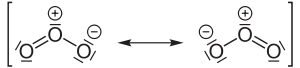
| Essigsäure | 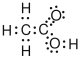 |
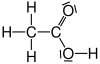 |
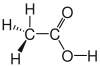 |
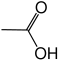 |
CH3–COOH | C2H4O2 | CH2O |
| Wasser | existiert nicht | existiert nicht | H2O | H2O | |||
Geschichte
Das im Jahr 1923 von Gilbert Newton Lewis in seinem Werk „Valence and the Structure of Atoms and Molecules“ vorgeschlagene Verfahren erwies sich als sehr erfolgreich bei der Beschreibung und Darstellung der Bindungen zwischen zwei Atomen. Das Konzept der Strukturformel war zwar nicht neu, Lewis erarbeitete allerdings zuerst einen systematischen Zugang zur Anordnung der Atome in Molekülen. Während sie bei zweiatomigen Molekülen sehr häufig erfolgreich ist, insbesondere was die ersten zwei Perioden im PSE betrifft, konnte mit der von Lewis ursprünglich vorgestellten Theorie weder die Geometrie der Bindungen noch die Struktur komplizierterer Moleküle erklärt werden.
Trotzdem hat sich die Valenzstrichformel an sich erhalten, indem die später entwickelten Methoden durch spezielle Konventionen zur Symbolik aufgenommen wurden (z. B. Mesomerie, Long-Bond-Strukturen, Mehrzentrenbindungen). Heute wird die Valenzstrichformel in ihrer ursprünglichen Form in Schulen gelehrt, um einen einfachen Einstieg in die genauere Struktur der Moleküle zu ermöglichen, da sich vom Standpunkt der von Lewis entwickelten Theorie heraus viele der später entwickelten Methoden aufbauen lassen.
Anwendung
Auf Grundlage des Bohrschen Atommodells oder des Schalenmodells werden bei der Verwendung der Valenzstrichformel nur die äußersten Elektronen (Außenelektronen) des Atoms, also die Valenzelektronen, beachtet. Alle inneren Elektronen haben keinen Einfluss, genauso wie der Aufbau des Atomkerns. Die Anwendung der Valenzstrichformel beschränkt sich im Wesentlichen auf die Elemente ab der vierten Hauptgruppe (Gruppe 14 nach IUPAC-Nomenklatur), die zur Ausbildung kovalenter Bindungen neigen, sowie auf Wasserstoff und Verbindungen, die aus Molekülen aufgebaut sind.
Die Valenzelektronen eines Atoms werden als Punkte symbolisiert in den vier Himmelsrichtungen um das Elementsymbol des Atoms gruppiert. Nun wird mindestens ein Elektron des einen Atoms mit einem des Bindungspartners durch einen Strich verbunden. Jetzt zählen Elektronen, die nicht durch einen Strich verbunden sind, nur zu dem Atom, um dessen Elementsymbol sie gruppiert sind (freies Elektronenpaar). Die Elektronen im Bindungsstrich werden gleichermaßen zu beiden Atomen gezählt, sie werden beiden Atomen gemeinsam zugeordnet und sozusagen von beiden Atomen gemeinsam genutzt (bindendes Elektronenpaar). Es werden solange Elektronen des Atoms mit denen des Bindungspartners durch einen Strich verbunden, bis jedes der beiden Atome durch die gemeinsame Nutzung dieser Elektronen mit dem anderen Atom, die Valenzelektronenanzahl der Edelgase, erreicht hat. (Edelgasregel) Das betreffende Atom hat nun die Elektronenkonfiguration des Edelgases, das ihm am nächsten ist.
Erfolge
Mit der Valenzstrichformel können die meisten aus zwei Atomen aufgebauten, nichtradikalischen Moleküle beschrieben werden. Beispiele sind Wasserstoff, Stickstoff und die Halogene. Auch Moleküle aus mehr als zwei Atomen können häufig in Valenzstrichformel notiert werden. Beispiele sind Wasser, Kohlenstoffdioxid und die meisten organischen Verbindungen.
Versagen
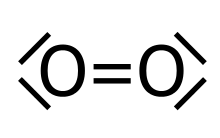
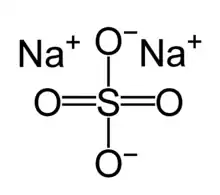
Das magnetische Verhalten wird bei der Valenzstrichformel häufig nicht berücksichtigt (siehe Sauerstoff). Die Valenzstrichformel stößt bei hypervalenten Molekülen, also bei solchen Molekülen, die die Oktettregel offensichtlich nicht erfüllen, an ihre Grenzen. So wird das Sulfation klassischerweise mit zwei Doppelbindungen und zwei Einfachbindungen beschrieben, was 12 Elektronen in der Außenhülle des Schwefelatoms ergeben würde (Oktetterweiterung). Grundsätzlich eignet sich die Valenzstrichformel nicht zur Vorhersage des räumlichen Baus von Molekülen, allerdings kann der räumliche Bau ähnlich wie in der Keilstrichformel angedeutet werden, wenn er bekannt ist. Als Methode zum Erfassen der Molekülgeometrie eignet sich oft das VSEPR-Modell.
Alternative Schreibweisen
Neben der Valenzstrichformel gibt es weitere Möglichkeiten, ein Molekül zweidimensional darzustellen:
- Elektronenformel, Elektronen werden nur gepunktet, keine Paare als Striche verbunden
- Skelettformel, verkürzte Schreibweise in der Organischen Chemie
- Fischer-Projektion, um chirale Verbindungen wie Zucker zu zeichnen
- Haworth-Projektion, für 5- bis 6-ringige Moleküle wie Zucker
- Keilstrichformel, um die Stereochemie darzustellen
- Newman-Projektion, zur Darstellung der Konformation
Einzelnachweise
- Eintrag zu line formula. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.L03561 – Version: 2.1.5.
Literatur
- Gilbert Newton Lewis: Valence and the structure of atoms and molecules. 1923, ISBN 0486615553
- Gilbert Newton Lewis: The Atom and the Molecule. J. Am. Chem. Soc. 1916, 38, 762–785. doi:10.1021/ja02261a002