Koordinative Bindung
Eine koordinative Bindung (auch Donator-Akzeptor-Bindung oder veraltet dative Bindung)[1] ist eine besondere Art der Bindung in der Komplexchemie. Eine solche Bindung besteht, wenn in einer Elektronenpaarbindung die Bindungselektronen von nur einem der beiden Bindungspartner stammen. Dabei bezeichnet man das Molekül oder Ion mit Elektronenmangel als Akzeptor (= Lewis-Säure), dasjenige mit den freien Elektronen als Donator (= Lewis-Base). In alten Lehrbüchern wird diese Bindung teilweise noch durch einen Pfeil in Richtung des Akzeptors gekennzeichnet. Diese Darstellungen sind veraltet. Eine koordinative Bindung wird wie jede andere kovalente Bindung als Linie gezeichnet (siehe z. B. nebenstehende Skizze).
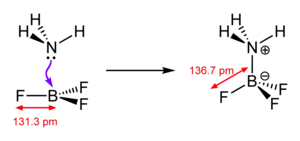
Ein typisches Beispiel ist Ammoniak (NH3), das sein freies Elektronenpaar für eine koordinative Bindung zur Verfügung stellt, siehe H3N-BF3 in nebenstehender Skizze. Formal gibt dadurch der Stickstoff ein Elektron dem Bor, wodurch ersterer (allgemein: der Donator) eine formale positive, letzteres (allgemein: der Akzeptor) eine formal negative Ladung erhält. Man beachte, dass diese formalen Ladungen nichts mit der tatsächlichen Ladungsverteilung zu tun haben[2]: Da Stickstoff eine wesentlich höhere Elektronegativität als Bor besitzt (3,07 gegenüber 2,01), halten sich die Elektronen eher beim Stickstoff auf.
Einzelnachweise
- Eintrag zu coordination. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01329 – Version: 2.3.3.
- Erwin Riedel: Allgemeine und Anorganische Chemie, Walter de Gruyter Verlag (2018), Abschnitt 2.2.3, ISBN 3-11-016415-9.