Eisen(II)-chlorid
Eisen(II)-chlorid (FeCl2) ist eine chemische Verbindung von Eisen(II)- und Chlorid-Ionen. Eisen(II)-chlorid gehört zur Gruppe der Eisenhalogenide. Daneben existiert auch ein kristallwasserhaltiges Eisen(II)-chlorid-Tetrahydrat. Eisen(II)-chlorid-Tetrahydrat ist nicht durch Erhitzen in wasserfreies Eisen(II)-chlorid umzuwandeln, da es sich beim Erhitzen zersetzt und Eisen(II)-oxid bildet.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
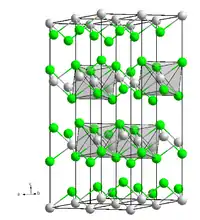 | ||||||||||||||||||||||
| _ Fe2+ _ Cl− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Eisen(II)-chlorid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Verhältnisformel | FeCl2 FeCl2 · 4 H2O | |||||||||||||||||||||
| Kurzbeschreibung |
weiße Kristalle[1], als Tetrahydrat blaugrüne, monokline, zerfließliche Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
B03AA05 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
1023 °C[1] | |||||||||||||||||||||
| Löslichkeit |
gut in Wasser (644 g·l−1 bei 10 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Unter die Bezeichnung Eisenchlorid fällt auch das Eisen(III)-chlorid (FeCl3).
Vorkommen
In der Natur kommt Eisen(II)-chlorid in Form des Minerals Rokühnit (Hydrat) vor.
Gewinnung und Darstellung
Eisen(II)-chlorid kann durch Reduktion von Eisen(III)-chlorid mit Wasserstoff bei 300 bis 350 °C (oberhalb dieser Temperatur tritt leicht die Reduktion zu Eisen ein) dargestellt werden.[4]
Eisen(II)-chlorid kann auch durch Reaktion von Eisen mit trockenem Chlorwasserstoffgas hergestellt werden, wobei sich wegen der erforderlichen hohen Temperaturen diese Reaktion weniger empfiehlt.[4]
Dagegen kann man wasserfreies Eisen(II)-chlorid nicht durch Auflösen von Eisen in Salzsäure und anschließende Fällung erzeugen. Dabei entsteht das wasserhaltige Eisen(II)-chlorid-Tetrahydrat FeCl2·4 H2O und molekularer Wasserstoff:
Wird die Synthese jedoch unter einer Stickstoffatmosphäre in Methanol durchgeführt, so lässt sich mit konzentrierter wässriger Salzsäure das Hexamethanol-Solvat herstellen und isolieren, welches dann thermisch zum wasserfreien Chlorid zersetzt wird[5]:
Eine verhältnismäßig einfache Darstellung von wasserfreiem Eisen(II)-chlorid im Labor ist die Umsetzung von Chlorbenzol mit wasserfreiem Eisen(III)-chlorid bei 130 °C[6]:
Außerdem entsteht es als Nebenprodukt bei der Herstellung von Titandioxid nach dem Chloridverfahren. Beim Beizen von Eisenblechen und -teilen, als vorbereitendem Schritt der Verzinkung, fallen große Mengen an.
Eigenschaften
-chlorid-Tetrahydrat.jpg.webp)
Eisen(II)-chlorid ist ein weißes, hygroskopisches Pulver, das im HCl-Strom bei etwa 700 °C sublimiert werden kann. Das Tetrahydrat besitzt in reinem Zustand eine lichtblaue Farbe. Bereits durch eine geringe Oxidation, wird diese grün. Mit fortschreitender Oxidation durch Luftsauerstoff wechselt diese schnell in eine rostig-bräunliche Färbung. In Wasser und in Alkohol sind beide leicht löslich. Eisen(II)-chlorid besitzt eine Kristallstruktur vom Cadmium(II)-chlorid-Typ mit der Raumgruppe R3m (Raumgruppen-Nr. 166) (a = 360,3 pm, c = 1753,6 pm).[7] Das Tetrahydrat kristallisiert monoklin, Raumgruppe P21/c (Nr. 14), Gitterparameter a = 588,5 pm, b = 718 pm, c = 851,4 pm, β = 111,1°.[8] Das Dihydrat kristallisiert ebenfalls monoklin, Raumgruppe C2/m (Nr. 12), Gitterparameter a = 735,5 pm, b = 854,8 pm, c = 363,7 pm, β = 98,18°.[9]
Verwendung
Im Labor und in der Synthesechemie ist Eisen(II)-chlorid ein wichtiger Ausgangsstoff zur Herstellung von weiteren Eisenverbindungen wie Eisen(III)-chlorid.
Bei der Abwasserreinigung dient es als Fäll- und Flockungsmittel. So verwenden beispielsweise Kläranlagen häufig Eisen(II)-chlorid zur Phosphatelimination, das heißt zur Ausfällung von Phosphaten (Waschmittel- bzw. Spülmittelbestandteile). Beste Ergebnisse werden bei der Simultanfällung erreicht.
Bei langen Abwasserkanalstrecken und Abwasserdruckleitungen kommt es in den wärmeren Jahreszeiten immer wieder zu Geruchsproblemen. Ursache ist die Bildung von Schwefelwasserstoff. Diese Bildung kann mit Eisen(II)-chlorid verhindert werden.
Biogasanlagen haben ebenfalls mit der Bildung von Schwefelwasserstoff zu kämpfen. Hier wird Eisen(II)-chlorid zur Biogasentschwefelung eingesetzt.
Neben der festen Form wird Eisen(II)-chlorid als wässrige Lösung in gummierten Tankwagen oder in Kannen vom Chemiehandel ausgeliefert.
Einzelnachweise
- Eintrag zu Eisen(II)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Eisenchloride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- Datenblatt Eisen(II)-chlorid (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band III. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1641.
- G. Winter: Iron(II) halides. In: Aaron Wold and John K. Ruff (Hrsg.): Inorganic Syntheses. Band 14. McGraw-Hill Book Company, Inc., 1973, ISBN 07-071320-0 (defekt), S. 101–104 (englisch).
- Peter Kovacic and Neal O. Brace: Iron(II) chloride. In: Eugene G. Rochow (Hrsg.): Inorganic Syntheses. Band 6. McGraw-Hill Book Company, Inc., 1960, S. 172–173 (englisch).
- M. Wilkinson, J.W. Cable, W.C. Koehler: Neutron diffraction investigations of the magnetic ordering in FeBr2, CoBr2, FeCl2 and CoCl2. In: Physical Review, 1959, 20, S. 421–423. doi:10.1103/PhysRev.113.497
- J.J. Verbist, W.C. Hamilton, M.S. Lehmann, T.F. Koetzle: Neutron Diffraction Study of Iron(II) Chloride Tetrahydrate, FeCl2·4 H2 In: Journal of Chemical Physics, 56, 1972, S. 3257–3264, doi:10.1063/1.1677688.
- B. Morosin, E.J. Graeber: Crystal structures of manganese(II) and iron(II) chloride dihydrate. In: Journal of Chemical Physics, 42, 1965, 898–901, doi:10.1063/1.1696078.

