Dibortetrachlorid
Dibortetrachlorid ist eine chemische Verbindung des Bors aus der Gruppe der Chloride.
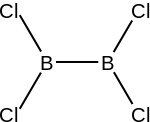
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Dibortetrachlorid | |||||||||
| Andere Namen |
Tetrachlordiboran | |||||||||
| Summenformel | B2Cl4 | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 163,43 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Dichte |
1,5 g·cm−3 (0 °C)[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
65,5 °C[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Dibortetrachlorid kann durch Reaktion von Bortrichlorid mit Quecksilber oder Kupfer[4] in einer elektrischen Entladung gewonnen werden.[1]
Eigenschaften
Dibortetrachlorid ist eine farblose Flüssigkeit, die sich in Wasser unter Bildung von Borsäure und Salzsäure löst.[2]
Wie auch die anderen Bortetrahalogenide zersetzt sie sich bereits bei Raumtemperatur[5], wobei die Zersetzungsgeschwindigkeit unter dem katalytischen Einfluss der Zersetzungsprodukte steigt.
An Luft entzündet sich die Verbindung unmittelbar.[1]
Im festen Zustand hat sie eine orthorhombische Kristallstruktur mit der Raumgruppe Pbca (Raumgruppen-Nr. 61).[2] Dibortetrachlorid bildet mit Donatoren D (z. B. Schwefelwasserstoff) Addukte des Typs B2Cl4·2D. Mit Wasserstoff reagiert es unter Bildung von Dichlorboran.[4]
Verwendung
Dibortetrachlorid kann zur Herstellung von Organoborverbindungen verwendet werden.[6] Durch Reaktion mit Antimontrifluorid kann Dibortetrafluorid gewonnen werden.[7]
Einzelnachweise
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 799.
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 314 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1033.
- Wiley-VCH: Ullmann's Fine Chemicals. John Wiley & Sons, 2013, ISBN 978-3-527-68357-4, S. 351 (eingeschränkte Vorschau in der Google-Buchsuche).
- Grant Urry, James Kerrigan, Theran D. Parsons, H. I. Schlesinger: Diboron Tetrachloride, B2Cl4, as a Reagent for the Synthesis of Organo-boron Compounds. I. The Reaction of Diboron Tetrachloride with Ethylene. In: Journal of the American Chemical Society. 76, 1954, S. 5299–5301, doi:10.1021/ja01650a011.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1033.