Wasserelektrolyse
Unter Wasserelektrolyse versteht man die Zerlegung von Wasser in Wasserstoff und Sauerstoff mit Hilfe eines elektrischen Stromes. Die wichtigste Anwendung dieser Elektrolyse ist die Gewinnung von Wasserstoff. Bisher ist die Wasserstoffgewinnung aus fossilen Energieträgern wirtschaftlicher als die Herstellung von Wasserstoff mittels Wasserelektrolyse. Die Wasserelektrolyse wird daher noch selten angewandt.
Durch den starken Ausbau der Nutzung von erneuerbaren Energien wird davon ausgegangen, dass die Wasserelektrolyse als Bestandteil von Power-to-Gas-Anlagen mittel- bis langfristig eine große Bedeutung zur Herstellung von Synthesegas erreichen wird.[1] Mit Wasserstoff als Energiespeicher wird die Verstetigung der Stromerzeugung aus erneuerbaren Energien, insbesondere bei Windkraft und Photovoltaik, gefördert, indem Überschüsse von Wind- und Solarstrom chemisch zwischengespeichert werden können. Der erzeugte Wasserstoff kann für chemische Prozesse genutzt oder direkt oder nach anschließender Methanisierung als Methan dem Erdgasnetz zugeführt werden. Anschließend steht er für verschiedene Anwendungszwecke wie z. B. als Rohstoff für die chemische Industrie (Power-to-Chemicals), als Antriebsenergie von Fahrzeugen, Schiffen und Flugzeugen (Power-to-Fuel) oder für die Rückverstromung in Gaskraftwerken oder Brennstoffzellen zur Verfügung.
Die Wasserelektrolyse ist auch als Demonstrationsversuch bedeutsam; dabei wird oft der Hofmannsche Wasserzersetzungsapparat genutzt. Eine weitere Anwendung der Wasserelektrolyse ist die Anreicherung von Deuterium. Ferner ist die Wasserelektrolyse die wichtigste Nebenreaktion vieler technischer Elektrolysen, z. B. der Chloralkali-Elektrolyse.
Reaktionen und ihre Gleichungen
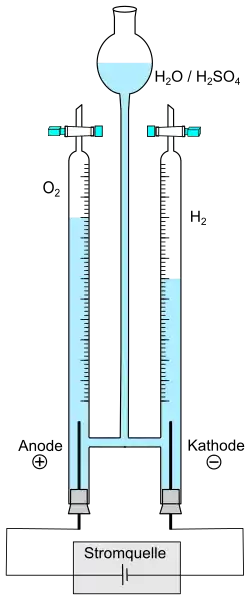
Die Elektrolyse von Wasser besteht aus zwei Teilreaktionen, die jeweils an den Elektroden Kathode und Anode ablaufen. Das Gesamt-Reaktionsschema dieser Redoxreaktion lautet:
- (bei T = 298,15 K, p = 1,013 × 105 Pa)
- Wasser wird durch elektrischen Strom in Wasserstoff und Sauerstoff gespalten.
*(S° Werte: H2(g) = 131,0; O2(g) = 205,0; H2O(l) = 69,9; H2O(g) = 188,7 J/K mol)
Die Elektroden tauchen in einen Elektrolyten ein. Der Elektrolyt wird meist durch Zusatz einer Säure, wie Schwefelsäure, oder einer Lauge, wie Kalilauge, hergestellt. Die Elektrolyse gelingt auch, wenn neutrale Salze wie Natriumsulfat als Elektrolyt verwendet werden. Ungeeignet sind beispielsweise Salzsäure oder Natriumchlorid, da Chlor an der Anode gebildet wird.
In saurer Lösung:[2]
In alkalischer Lösung:[2]
In neutraler Natriumsulfat-Lösung:[3]
Zwischen den Halbzellen bilden sich Konzentrationsgradienten im Elektrolyten, da je nach den Bedingungen Oxonium-Ionen (H3O+) oder Hydroxid-Ionen (OH–) gebildet oder verbraucht werden. Dabei wandern die Oxonium-Ionen zu der negativ geladenen Kathode, die Hydroxid-Ionen zur positiven Anode. Die Ionenbeweglichkeit von H3O+ und OH– sind vergleichsweise hoch, da die Ionen nicht als Ganzes wandern, sondern nur Protonen (H+) verschoben werden, siehe Grotthuß-Mechanismus.

- Scheinbare Diffusion eines Oxonium-Ions durch Verschiebung von Protonen.

- Scheinbare Diffusion eines Hydroxid-Ion durch Verschiebung von Protonen.
Technische Wasserelektrolyse
Der energetische Wirkungsgrad der Elektrolyse von Wasser beträgt je nach angewandtem Detailverfahren zwischen etwas über 60 % und 85 %.[4]
Unklarheiten bzw. Bandbreiten solcher Angaben ergeben sich u. a. aus der Differenz zwischen Brennwert und Heizwert des Wasserstoffs, der etwa 18 % beträgt. Da die Elektrolytkonzentration und die Temperatur einer Elektrolytlösung großen Einfluss auf den Zellwiderstand und somit auf die Energiekosten haben, wird dafür zum Beispiel eine 25- bis 30-prozentige Kaliumhydroxid-Lösung verwendet, die Temperatur liegt bei ca. 70–90 °C. Die Stromdichte liegt bei ca. 0,15–0,5 A/cm², die Spannung bei ca. 1,90 V. Zur Herstellung von 1 m³ Wasserstoff (bei Normaldruck) wird in der Praxis zum Beispiel eine elektrische Energie von 4,3–4,9 kWh benötigt. Durch Elektrokatalysatoren (bei Kathoden z. B. Ni-Co-Zn, Ni-Mo, bei Anoden: Nickel-Lanthan-Perowskit, Nickel-Kobalt-Spinell) kann die Überspannung um ca. 80 mV gesenkt werden.
Es besteht auch die Möglichkeit, destilliertes Wasser durch Elektrolyse zu zerlegen. Bei der SPE-Wasserstoffelektrolyse wird eine protonengeladene Nafionmembran benutzt. Die dünnen durchbrochenen Elektroden befinden sich auf der Oberflächenschicht (englisch zero gap „abstandsfreie Zellengeometrie“) der Membran. Als Elektrodenmaterial können z. B. Rutheniumoxidhydrate (Anode) oder Platin (Kathode) verwendet werden. Die SPE-Elektrolyse scheint sich im Markt bei Kleinelektrolyseuren durchzusetzen.[5]
Es wird auch an der Hochtemperatur-Wasserdampf-Elektrolyse (bei 800 bis 1000 °C) an Festelektrolyten geforscht (Festoxid-Elektrolyseurzelle). Als Festelektrolyt wird üblicherweise Yttrium-stabilisiertes Zirkoniumdioxid (YSZ) verwendet. Alternativ können auch Sc oder Ca-dotiertes ZrO2, Gd oder Sm-dotiertes CeO2 oder auch Elektrolyte mit Perowskit-Struktur (z. B. auf Basis von LaGaO3; dotiert mit Sr und/oder Mg) verwendet werden.[6] Durch die erhöhte Betriebstemperatur lässt sich die benötigte Spannung im thermoneutralen Betriebspunkt auf 1,30 V senken, die Stromdichte lag bei 0,4 A/cm².[7]
Der elektrische Wirkungsgrad ist insbesondere bei der Nutzung von Wasserstoff als saisonaler Energiespeicher wichtig, dem sogenannten Power-to-Gas-Verfahren. Dabei wird Elektrolysewasserstoff (bzw. nach einer ggf. nachgeschalteten Methanisierung Methan) genutzt, um als Speicher die schwankende Erzeugung mancher regenerativer Energiequellen auszugleichen und damit eine stabile Stromversorgung zu erreichen. Die Rückverstromung kann auf unterschiedliche Art und Weise stattfinden; u. a. können Gaskraftwerke, Blockheizkraftwerke oder Brennstoffzellen genutzt werden. Da Power-to-Gas durch den recht geringen Wirkungsgrad der Energiekette Strom => Wasserstoff/Methan => Strom hohe Energieverluste mit sich bringt, sollte ein zukünftiges Energiesystem jedoch so ausgelegt sein, dass ein möglichst geringer Langfristspeicherbedarf besteht, für den diese Technik benötigt wird.[8]
Nebenreaktionen[9]
- Bildung von Ozon
- An glatten Platinanoden kommt es in gekühlten (die Ozonzersetzung ist dann geringer), stark sauren Lösungen bei hohen Stromdichten zur Ozonbildung. Im basischen Milieu ist die Ozonbildung geringer, an Nickelanoden bleibt sie sogar völlig aus.
- Ist dem Gleichstrom Wechselstrom überlagert, so erfolgt die Ozonbildung bereits bei geringeren Stromdichten.
Siehe auch
Literatur
- Michael Sterner, Ingo Stadler (Hrsg.): Energiespeicher. Bedarf, Technologien, Integration. 2. Auflage, Berlin Heidelberg 2017, ISBN 978-3-662-48893-5.
Weblinks
Einzelnachweise
- Vgl. Volker Quaschning, Regenerative Energiesysteme. Technologie – Berechnung – Simulation. 9. aktualisierte Auflage. München 2015, S. 54f.
- Peter Kurzweil, Paul Scheipers: Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente, 8. Aufl., Vieweg+Teubner, Wiesbaden, 2010, S. 198. Eingeschränkte Vorschau in der Google-Buchsuche
- Karl-Heinz Lautenschläger, Wolfgang Weber: Taschenbuch der Chemie, 22. Auflage, Verlag Europa-Lehrmittel, Haan-Gruiten, 2018, S. 366.
- S. Milanzi, C. Spiller, B. Grosse, L. Hermann, J. Kochems, J. Müller-Kirchenbauer: Technischer Stand und Flexibilität des Power-to-Gas-Verfahrens. (PDF; 1,16 MB) Technische Universität Berlin, 29. August 2018, abgerufen am 6. November 2019 (Abb. 4-2 auf Seite 7/18).
- Carl Jochen Winter, Joachim Nitsch: Wasserstoff als Energieträger: Technik und Systeme. Springer Verlag, 1986.
- Singhal, Subhash C.; Kendall, Kevin (Hrsg.): High Temperature Solid Oxide Fuel Cells: Fundamentals, Design and Applications. 2003.
- Gerd Sandstede: Möglichkeiten zur Wasserstoff-Erzeugung mit verminderter Kohlendioxid-Emission für zukünftige Energiesysteme. In: Chem.-Ing.-Tech. Band 63, Nr. 6, 1993, S. 586–589, doi:10.1002/cite.330630608.
- Günther Brauner: Energiesysteme: regenerativ und dezentral. Strategien für die Energiewende. Wiesbaden 2016, S. 89.
- Fritz Foerster: Elektrochemie wässriger Lösungen. Verlag von Johann Ambosius Barth, 1915, S. 206ff.