Elektrolyseur
Als Elektrolyseur wird eine Vorrichtung bezeichnet, in der mit Hilfe elektrischen Stromes eine chemische Reaktion, also eine Stoffumwandlung, herbeigeführt wird: Es findet eine Elektrolyse statt.
Im Zuge der Energiewende könnten Elektrolyseure zur Erzeugung von Wasserstoff in naher Zukunft eine bedeutende Rolle einnehmen. Entsprechend der Vielfalt an unterschiedlichen Elektrolysen gibt es auch eine Vielzahl von Elektrolyseuren: Bei der Chloralkali-Elektrolyse beispielsweise solche mit Membranen, Diaphragmen oder Quecksilberzellen.
Elektrolyseure für die Wasserelektrolyse
Die Wasserelektrolyse, die Zerlegung von Wasser in Wasserstoff und Sauerstoff, geschieht nach folgender Reaktionsgleichung:
Der elektrische Energiebedarf zur Herstellung von 1 Kubikmeter Wasserstoff im Normzustand definiert den Wirkungsgrad eines Elektrolyseurs: In einem modernen Hochdruck-Elektrolyseur liegt dieser Energiebedarf unter einem Druck von 12 bar bei etwa 4,8 kWh pro m3 im Normzustand; damit liegt der Wirkungsgrad bei 62,5 % (bezogen auf den unteren Heizwert von Wasserstoff).
Mehrere Anlagenhersteller (z. B. H-Tec, Electrolyser Corp., Brown Boveri, Lurgi, De Nora, Epoch Energy Technology Corp.) bieten große Elektrolysegeräte mit einem Wirkungsgrad von über 80 % an.
Man unterscheidet folgende Arten von Elektrolyseuren für die Wasserelektrolyse:
Alkalischer Elektrolyseur
Beim alkalischen Elektrolyseur wird bei einer Gleichspannung von mindestens 1,5 Volt an der Kathode Wasserstoff und an der Anode Sauerstoff gebildet. Die alkalische Reaktionsgleichung lautet:
Als Elektrolyt dient Kalilauge (Kaliumhydroxid-Lösung, KOH) mit einer Konzentration von 20–40 %. Eine gasdichte Membran, das sogenannte Diaphragma, lässt zwar den Transport von OH−-Ionen zu, verhindert aber gleichzeitig die Vermischung der entstehenden Produktgase.
Als Elektroden werden sogenannte „DSA-Elektroden“ (Dimensionsstabile Anoden, meist Titanelektroden mit einer Rutheniumoxid-Beschichtung[1]) eingesetzt. Dies sind Streckmetalle, die mit einem Edelmetall-Katalysatoroxid – z. B. Ruthenium- oder Iridiumoxid – beschichtet werden. Es gibt aber auch Systeme mit Raney-Nickel-Katalysatoren in einer Gasdiffusionselektrode. Alkalische Elektrolyseure sind in großem Maßstab weltweit im Einsatz.
Saurer oder PEM-Elektrolyseur
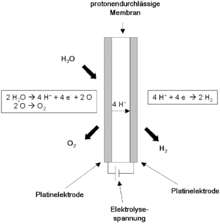
Im Protonen-Austausch-Membran-Elektrolyseur wird destilliertes Wasser durch elektrischen Strom in Wasserstoff und Sauerstoff gespalten. Er besteht aus einer protonendurchlässigen Polymermembran (en. „proton exchange membrane“ oder „polymer electrolyte membrane“, kurz „PEM“). Diese ist kathodenseitig mit einer porösen Elektrode aus auf Kohlenstoff geträgertem Platin und anodenseitig mit metallischen oder als Oxid vorliegenden Edelmetallen (meist Iridium und Ruthenium) beschichtet. An diese Elektroden wird eine äußere Spannung angelegt. Auf der Anodenseite des Elektrolyseurs wird Wasser zugeführt (Es können auch beide Halbzellen mit Wasser geflutet werden, oder auch nur die Kathodenseite, dies ist abhängig vom Verwendungszweck).
Die katalytische Wirkung der Edelmetall-Elektrode führt zur Zersetzung des Wassers an der Anodenseite: Es entstehen Sauerstoff, freie Elektronen und positiv geladene H+-Ionen. Die Wasserstoff-Ionen diffundieren durch die protonenleitende Membran auf die Kathodenseite, wo sie mit den Elektronen zu Wasserstoff kombinieren.
Reversible Brennstoffzellen auf PEM-Basis können sowohl als Brennstoffzelle als auch als Elektrolyseur arbeiten und können damit in Kombination mit einem Gasspeicher als Energiespeicher dienen.[2]
Hochtemperatur-Elektrolyseur
Hochtemperaturelektrolyseure arbeiten bei Arbeitstemperaturen von etwa 900 °C. Dabei wird ein Teil der notwendigen Reaktionsenthalpie als Wärme eingekoppelt. Dies führt dazu, dass der Strombedarf für die Elektrolyse sinkt und damit der Wirkungsgrad gegenüber der wässrigen, alkalischen Elektrolyse steigt. Mit Hochtemperatur-Elektrolyseuren können Wirkungsgrade bis ca. 90 % bezogen auf den Brennwert erreicht werden.[3]
Hochtemperatur-Co-Elektrolyse
Bei der Hochtemperatur-Co-Elektrolyse werden Wasser und Kohlendioxid gemeinsam zu Synthesegas reduziert.[4][5] Zum Verfahren erschienen ab 2010 vermehrt wissenschaftliche Publikationen und Studien.[6][7] Die Solid Oxide Electrolyser Cell (SOEC) wurde 1980 zum Patent angemeldet, ab 2008 wurden diverse Patente zur Beschaffenheit vom Elektroden dafür eingereicht und später erteilt.[8]
Molybdänsulfid als Katalysator
Forscher der ETH Lausanne entdeckten 2011 durch Zufall bei einem Experiment, dass Molybdänsulfid als effizienter Katalysator anstelle von Platin eingesetzt werden kann. Molybdänsulfid ist wesentlich kostengünstiger als Platin, sodass sich die Investitionen für einen Elektrolyseur verringern.[9]
Nickel-Eisen-Elektrolyseur
2017 wurde ein Elektrolyseur auf Basis eines Nickel-Eisen-Akkumulators vorgestellt, der die Eigenschaften eines herkömmlichen Akkumulators und eines Elektrolyseurs verbindet. Die von den Forschern Battolyseur getaufte Anlage kann zunächst wie ein herkömmlicher Akkumulator geladen und entladen werden kann. Erreicht der Akkumulator seine Kapazitätsgrenze und wird weiter Strom zugeführt, wird stattdessen Wasserstoff produziert. Aufgrund seiner technischen Eigenschaften gilt diese Bauform als sehr gut geeignet für die Speicherung von Energie im Rahmen der Energiewende.[10]
Traditionelle Elektrolyseure
Der Hofmannsche Wasserzersetzungsapparat wurde im 19. Jahrhundert entwickelt. Neben der traditionellen Wasserelektrolyse haben sich weitere Verfahren wie die Schmelzflusselektrolyse entwickelt.
Anwendungsgebiete
Elektrolyseure werden typischerweise bei fast allen Power-to-X-Technologien für die Erzeugung von Wasserstoff verwendet, idealerweise entsteht so rein grüner Wasserstoff. Daraus kann in weiteren möglichen Stufen, entweder mit Power-to-Gas oder Power-to-Liquid gasförmige oder flüssige Energieträger erzeugt werden. Diese Technologien sollen zukünftig zum Ersatz für fossile Energieträger dienen. Damit könnte zumindest teilweise ein Ersatz von Erdöl und Kohle erreicht werden, um Treibhausgase zu vermeiden. Vorzugsweise kann das bei Vorhandensein von überschüssiger Energie, in Zeiten hoher Solarstrom- oder Windkrafterzeugung geschehen. So können Elektrolyseure als regelbare Last zur Netzstabilisierung eingesetzt werden.[11]
Siehe auch
Weblinks
- Breaking Lab: Elektrolyse: Sauberer Wasserstoff für die Zukunft auf YouTube, 22. Juli 2021, abgerufen am 23. Juli 2021.
Einzelnachweise
- R. Holze: Leitfaden der Elektrochemie. S. 206, Vieweg+Teubner Verlag, 1998, ISBN 978-3-519-03547-3
- Fraunhofer ISE: Reversible Brennstoffzellen - Langzeitspeicher für elektrische Energie. (Memento vom 8. März 2012 im Internet Archive)
- Büchi et al., Towards re-electrification of hydrogen obtained from the power-to-gas process by highly efficient H2/O2 polymer electrolyte fuel cells. In: RSC Advances 4, (2014), 56139–56146, doi:10.1039/c4ra11868e.
- https://elib.uni-stuttgart.de/bitstream/11682/9060/1/2016-Dissertation-DHKoenig.pdf
- http://www.iam.kit.edu/wet/plainhtml/studien-%20und%20diplomarbeiten/Bachelor_3_Coelektrolyse_Krompic.pdf
- https://backend.orbit.dtu.dk/ws/files/103646063/Thesis_Youkun_Tao.pdf
- https://www.osti.gov/etdeweb/biblio/22090505
- https://patents.google.com/patent/US4395468A/en
- Durch Zufall vereinfachte Wasserstoff Herstellung entwickelt (Quelle: Der Standard Stand: 14. April 2011)
- F. M. Mulder et al.: Efficient electricity storage with the battolyser, an integrated Ni-Fe-battery and electrolyser. In: Energy and Environmental Science. Band 10, Nr. 3, 2017, S. 756–764, doi:10.1039/C6EE02923J.
- U. Eberle, Rittmar von Helmholt: Sustainable transportation based on electric vehicle concepts: a brief overview. In: Energy and Environmental Science. Band 3, Nr. 6, 2010, S. 689–699, doi:10.1039/C001674H.