Photokatalytische Wasserspaltung
Die Photokatalytische Wasserspaltung beschreibt den Prozess, in dem Photonen direkt genutzt werden, um Wasser elektrochemisch in seine Bestandteile Wasserstoff und Sauerstoff aufzutrennen. Die Reaktion zählt zur künstlichen Photosynthese und lässt sich vereinfacht wie folgt beschreiben:
Methoden zur Gewinnung von Wasserstoff werden bei einem Übergang zu einer auf erneuerbaren Energien basierenden Wasserstoffwirtschaft an Bedeutung gewinnen. Der Vorteil der Photokatalyse gegenüber anderen Techniken wie der Elektrolyse besteht darin, dass Ladungstrennung und Spaltung des Wassers von einem Material an der gleichen Grenzfläche durchgeführt werden kann, wodurch Übertragungsverluste minimiert werden können und Material gespart werden kann.
Seit der Entdeckung der photokatalytischen Wasserspaltung am Halbleiter TiO2 im Jahre 1972 durch Akira Fujishima und Kenichi Honda, versucht sich eine Vielzahl an Wissenschaftlern an der Weiterentwicklung geeigneter Materialien.[1] Neben der Synthese von Wasserstoff werden auch speicherfreundlichere Energieträger mit höherer Volumensenergiedichte, wie z. B. Wasserstoffperoxid untersucht.[2]
Aktuelle Forschungen zielen darauf ab, die nötige Energie der Photonen, die bei A. Fujishima und K. Honda im UV-Bereich lagen, in den Bereich des sichtbaren Lichts zu verschieben. Dazu müssen vor allem Verluste reduziert werden, die an den Grenzflächen zwischen Katalysator und Wasser entstehen. Ein weiteres großes Problem stellt die Zersetzung des Katalysators unter Beleuchtung dar.[3]
Typen von Photokatalysezellen
Die Wasserspaltung mittels Sonnenlicht kann über verschiedene Zellaufbauten realisiert werden. Dabei muss eine Spannung von mindestens 1,23 V zwischen Anode und Kathode aufgebaut werden. Das entspricht der Energie, die aufgewendet werden muss, um ein Wasserstoffatom von einem Sauerstoffatom zu trennen. In der Praxis ist die benötigte Spannung jedoch höher, typischerweise im Bereich von 1,6 bis 2,4 V, was sich auf eine starke Bindung während der Reaktion an den Katalysator, sowie auf Leitungsverluste zurückführen lässt.[4]
n-Typ Photoanode
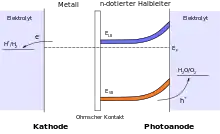
Bei dieser Photokatalysezelle wird die nötige Spannung durch die Anregung eines Elektron-Loch-Paares durch Photonen an der Bandlücke eines n-Halbleiters erzeugt. Durch das Angleichen des Fermi-Niveaus des n-Halbleiters mit dem Quasi-Fermi-Niveau des Elektrolyten findet eine Bandverbiegung statt, die eine aktive Ladungstrennung von Elektron und Loch bewirkt. Das Loch wird für die Reaktion des H2O zu O2 verwendet. Um die Fermikante des Metalls über das Potential zu heben, ab dem H+ zu H2 reagiert, muss bei dieser Zellanordnung unter Umständen eine externe Spannung angelegt werden.[5]
p/n-Typ Photoanode/Photokathode

In dieser Zellkonfiguration wird ein p-Halbleiter mit einem n-Halbleiter über einen ohmschen Kontakt verbunden. Im Unterschied zur n-Typ Photoanode findet die Ladungstrennung von Elektron und Loch sowohl an der Photoanode als auch an der Photokathode statt. Die Bandverbiegung des p-Halbleiters führt dabei dazu, dass die Elektronen an die Grenzfläche wandern und dort die Reaktion H+ zu H2 treibt. Die Löcher werden an die Grenzfläche zum n-Halbleiter getrieben, wo sie mit den Elektronen rekombinieren. Für die Erzeugung eines Elektrons und eines Lochs für die Reaktion werden also zwei Photonen benötigt. Diese können jedoch jeweils eine niedrigere Energie aufweisen, als bei einem Ein-Photonen-Prozesses, wodurch das Spektrum der Sonne besser ausgenutzt werden kann.[6]
Photokatalyse mit suspendierten Partikeln
Hier wird die Wasserspaltung mit Hilfe von Partikeln vollzogen, die im Wasser suspendiert sind. Die Funktion der Partikel besteht in der Lichtabsorption, der Ladungstrennung, und der Wasserelektrolyse.
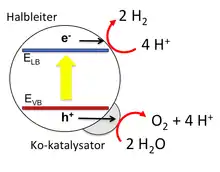
Wegen der extrem korrosiven Bedingungen während der Wasseroxidation sind die meisten funktionsfähigen Partikel aus Metalloxiden aufgebaut, die mit Metall oder Metalloxid Elektrokatalysatoren verbunden sind. Beispiele hierfür sind unter anderem La/KTaO3 mit NiO-Elektrokatalysator[7] und GaN:ZnO mit Cr/RhOx-Elektrokatalysator.[8] Potentiell sind auf Partikeln basierende Systeme kostengünstiger als herkömmliche photoelektrochemische Systeme. Allerdings ist wegen der schnellen Elektronen-Loch-Rekombination die Energieeffizienz der Partikelsysteme noch zu niedrig für kommerzielle Anwendungen. Auch bestehen Bedenken zur Sicherheit, da Wasserstoff und Sauerstoff ein explosives Gasgemisch bilden. Forschungsansätze für eine Verbesserung der Energieeffizienz bestehen in der Entwicklung neuer Halbleitermaterialien, in der Verwendung von Nanoteilchen, und in der Anwendung von Oberflächenmodifikationen zur Stabilisierung des angeregten Zustandes.[9]
Effizienzdefinition
Die Effizienz der photokatalytischen Wasserspaltung ist über das Verhältnis von eingestrahlter Sonnenenergie zur produzierten, nutzbaren chemischen Energie definiert. Für die genaue Definition der nutzbaren Energie pro umgesetztem Elektron (Wasserstoffatom) gibt es jedoch mehrere Ansätze, so kann der Brennwert oder die gibbssche freie Energie angesetzt werden. Letzterer Wert ist mit 1,23 eV pro reduziertem Proton der konservativere Wert und wird daher in der Regel verwendet.[10] Die Prognosen, ab welcher Effizienz – Stabilität vorausgesetzt – der Prozess wirtschaftlich interessant werden könnte, sind bisher noch vage und gehen von 5–10 % für den Ansatz mit suspendierten Partikeln und mindestens 15 % für Hocheffizienz-Systeme aus.[11]
Die bisher im Labor erzielten Effizienzen hängen stark vom verwendeten Materialsystem ab und reichen von 5 % für Metalloxid-Systeme[12] bis zu 14 % für die teureren III-V-Verbindungshalbleiter.[13] Eine Effizienz von über 12 % mittels Perovskit wurde 2014 dokumentiert,[14] was im Vergleich zur Gesamteffizienz photovoltaischer Elektrolyse, mit Wasserstoff als Langzeit-Energiespeicher einen sehr hohen Wert darstellt. Gleichzeitig stellen diese Systeme eine attraktive Option für den Einstieg in eine wasserstoffbasierte Energieinfrastruktur dar, indem sie durch kompakte Erzeugungszentren mit Zugang zu hoher Sonnenleistung und Salzwasser eine hohe Wirtschaftlichkeit versprechen.
Einzelnachweise
- A. Fujishima, K. Honda: Electrochemical Photolysis of Water at a Semiconductor Electrode In: Nature. Vol. 238, 1972, S. 37–38.
- Shunichi Fukuzumi, Yusuke Yamada, Masaki Yoneda, Kentaro Mase: Seawater usable for production and consumption of hydrogen peroxide as a solar fuel. In: Nature Communications. Band 7, 4. Mai 2016, ISSN 2041-1723, S. 11470, doi:10.1038/ncomms11470 (nature.com [abgerufen am 17. August 2019]).
- M. G. Walter, E. L. Warren, J. R. McKone, S. W. Boettcher, Q. Mi, E. A. Santori, und N. S. Lewis: Solar Water Splitting Cells In: Chem. Rev. 110, 2010, S. 6446–6473.
- M. G. Walter, E. L. Warren, J. R. McKone, S. W. Boettcher, Q. Mi, E. A. Santori, und N. S. Lewis: Solar Water Splitting Cells In: Chem. Rev. 110, 2010, S. 6448 Kap. 2.
- C. A. Grimes Light, Water, Hydrogen – The Solar Generation of Hydrogen by Water Photoelectrolysis Kap. 3.
- M. G. Walter, E. L. Warren, J. R. McKone, S. W. Boettcher, Q. Mi, E. A. Santori, und N. S. Lewis: Solar Water Splitting Cells In: Chem. Rev. 110, 2010, S. 6452 Kap. 2.3.
- H. Kato, K. Asakura und A. Kudo, Highly Efficient Water Splitting into H-2 and O-2 over Lanthanum-Doped NaTaO3 Photocatalysts with High Crystallinity and Surface Nanostructure, J. Am. Chem. Soc., 2003, 125 (10), 3082-3089.
- K. Maeda, K. Teramura, D. L. Lu, T. Takata, N. Saito, Y. Inoue und K. Domen, Characterization of Rh-Cr mixed-oxide nanoparticles dispersed on (Ga1-xZnx)(N1-xOx) as a cocatalyst for visible-light-driven overall water splitting, J. Phys. Chem. B, 2006, 110 (28), 13753-13758.
- F. E. Osterloh, Nanoscale Effects in Water Splitting Photocatalysis, Top. Curr. Chem., 2015, doi:10.1007/128_2015_633.
- Z. Chen, T. F. Jaramillo, T. G. Deutsch, A. Kleiman-Shwarsctein, A. J. Forman, N. Gaillard, R. Garland, K. Takanabe, C. Heske, M. Sunkara, E. W. McFarland, K. Domen, E. L. Miller, J. A. Turner und H. N. Dinh: Accelerating materials development for photoelectrochemical hydrogen production: Standards for methods, definitions, and reporting protocols In: J. Mater. Res. 25, 2010, S. 3–16, doi:10.1557/JMR.2010.0020.
- B. A. Pinaud, J. D. Benck, L. C. Seitz, A. J. Forman, Z. Chen, T. G. Deutsch, B. D. James, K. N. Baum, G. N. Baum, S. Ardo, H. Wang, E. Miller und T. F. Jaramillo: Technical and economic feasibility of centralized facilities for solar hydrogen production via photocatalysis and photoelectrochemistry In: Energy Environ. Sci. 6, 2013, S. 1983–2002, doi:10.1039/C3EE40831K.
- F. F. Abdi, L. Han, A. H. M. Smets, M. Zeman, B. Dam, R. van de Krol: Efficient solar water splitting by enhanced charge separation in a bismuth vanadate-silicon tandem photoelectrode. In: Nature Communications. 4, 29. Juli 2013. doi:10.1038/ncomms3195. Abgerufen am 25. Dezember 2015.
- M. M. May, H.-J. Lewerenz, D. Lackner, F. Dimroth, T. Hannappel: Efficient direct solar-to-hydrogen conversion by in situ interface transformation of a tandem structure. In: Nature Communications. 6, 15. September 2015. doi:10.1038/ncomms9286. Abgerufen am 25. Dezember 2015.
- Michael Grätzel, Hong Jin Fan, S. David Tilley, Nam-Gyu Park, Mohammad Khaja Nazeeruddin: Water photolysis at 12.3% efficiency via perovskite photovoltaics and Earth-abundant catalysts. In: Science. Band 345, Nr. 6204, 26. September 2014, ISSN 0036-8075, S. 1593–1596, doi:10.1126/science.1258307, PMID 25258076 (sciencemag.org [abgerufen am 17. August 2019]).