Thiophen-2-carbaldehyd
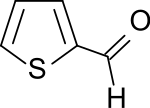
Thiophen-2-carbaldehyd ist ein Fünfring-Heteroaromat mit einem Schwefelatom und einer benachbarten Aldehydgruppe in 2-Stellung. Das 2-Formylthiophen ist Ausgangsstoff für mehrere wichtige Arzneistoffe.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thiophen-2-carbaldehyd | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H4OS | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 112,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,5920 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
2-Thiophencarboxaldehyd kommt in Camembert (0,4 mg/kg) und in Kaffee (bis zu 1,8 mg/kg) natürlich vor.[4]
Bereits im Jahr 1885 wurde über die Bildung von 2-Thiophenaldehyd bei der thermischen Zersetzung von 2-Thienylglyoxylsäure (aus 2-Acetylthiophen durch alkalische Oxidation mit Kaliumpermanganat) unter CO2-Abspaltung berichtet.[5][6]
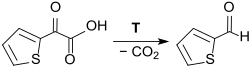
Für die chemische Synthese von 2-Thienylaldehyd gibt es zwei ausgearbeitete Laborvorschriften in Organic Syntheses, ausgehend von (dem stark haut- und tränenreizenden und zur explosionsartigen Zersetzung neigenden) 2-Chlormethylthiophen[7][8], das mit Hexamethylentetramin zum entsprechenden Ammoniumsalz umgesetzt und dieses anschließend mit Wasserdampf mit Ausbeuten von 48–53 % zum Aldehyd zersetzt wird.
Eine jüngere Vorschrift[9][10] beschreibt die Vilsmeier-Reaktion (einer elektrophilen aromatischen Substitution) an dem elektronenreichen Aromaten Thiophen mit N-Methylformanilid und Phosphoroxychlorid und Zersetzung des gebildeten Salzes mit Wasser in 71–74 % Ausbeute.
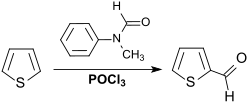
Die Produktausbeute erreicht 87 %, wenn die Reaktionstemperaturen bei 55–65 °C gehalten und der Aldehyd durch Wasserdampfdestillation isoliert werden.[11]
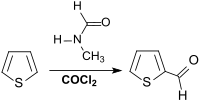
In der Patentliteratur ist die Reaktion von Thiophen mit Dimethylformamid DMF und Phosgen angegeben, bei der 2-Thiophenaldehyd in 98 %iger Ausbeute erhalten und die teure Entsorgung phosphathaltiger Abwässer vermieden wird.
Elektronenreiche Aromaten wie Thiophen reagieren in Gegenwart von Lewis-Säuren, wie z. B. Zinn(IV)-chlorid SnCl4 oder Titan(IV)-chlorid TiCl4 mit (Dichlormethyl)methylether als Formylierungsagens in einer nach Alfred Rieche als Rieche-Formylierung benannten Reaktion zu Thiophen-2-carbaldehyd.[12]
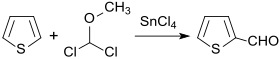
Das intermediär gebildete α-Methoxythienylchlorid spaltet bei der wässrig-sauren Aufarbeitung HCl ab und bildet in 90 %iger Ausbeute 2-Formylthiophen.
Eigenschaften
Thiophen-2-carbaldehyd ähnelt dem Benzolderivat Benzaldehyd und ist in der älteren Literatur als ein „farbloses, wasserhelles Öl von angenehmem, ganz an Bittermandelöl erinnerndem, Geruch“ beschrieben.[5] Wegen bereits in Spuren geruchsintensiver Zersetzungsprodukte wird der Aldehyd meist als stechend übelriechende farblose Flüssigkeit charakterisiert, die sich an der Luft gelb bis braun verfärbt und daher unter Stickstoff oder mit Hydrochinon als Oxidationsinhibitor aufbewahrt werden sollte.
Anwendungen
2-Thiophenaldehyd als Baustein für APIs
Teniposid ist ein halbsynthetisches Podophyllotoxinglycosid, bei dem Thiophen-2-carbaldehyd halbacetalisch an den Glucose-Rest gebunden ist, um die cytotoxische Nebenwirkungen des Zytostatikums zu reduzieren.[13]
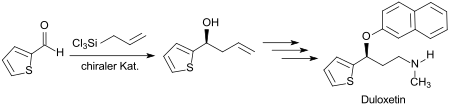
Eine Syntheseroute für das Antidepressivum Duloxetin geht aus von 2-Thiophenaldehyd, der auf der ersten Stufe in Gegenwart einer als starke Lewis-Base und als enantioselektiver Katalysator wirkenden Bipyridin-di-N-oxids mit Allyltrichlorsilan mit > 97 % ee allyliert wird.[14]
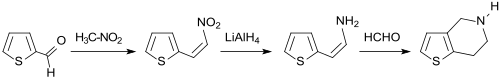
Ein kritischer Molekülbaustein (engl. building block) für die Thrombozytenaggregationshemmer Ticlopidin und Clopidogrel ist ein zweikerniges heterocyclisches Ringsystem, in dem das fünfgliedrige Thiophen mit einem sechsgliedrigen Tetrahydropyridin-Ring zum 4,5,6,7-Tetrahydrothieno[3,2-c]pyridin anelliert ist. Dazu wird Thiophen-2-aldehyd in einer Henry-Reaktion mit Nitromethan im Alkalischen zum entsprechenden Nitroaldol umgesetzt, das beim Ansäuern – analog zu β-Nitrostyrol – Wasser eliminiert und 2-(2-Nitrovinyl)thiophen bildet. Das α,β-ungesättigte Nitroalken reagiert mit Natriumborhydrid NaBH4 zum Amin 2-(2-Aminoethyl)thiophen und dieses in einer Pictet-Spengler-Reaktion mit Formaldehyd zur Formiminoverbindung, die beim Schütteln mit verdünnter Salzsäure zum Zielprodukt cyclisiert.[15]
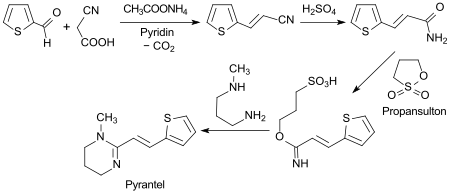
Eine Standardsynthese des Anthelmintikums Pyrantel startet mit einer Aldolkondensation von Thiophen-2-carbaldehyd mit Cyanessigsäure zum 3-(2-Thienyl)acrylnitril.[16]
Synthesevarianten der weniger gebräuchlichen Pharmawirkstoffe Azosemide, Eprosartan und Tenylidone basieren ebenfalls auf Thiophen-2-carbaldehyd.
Einfache Derivate von 2-Thiophenaldehyd
2-Hydroxymethylthiophen entsteht bei der Cannizzaro-Reaktion von 2-Thiophenaldehyd mit Formaldehyd[17] mit 59 %iger Ausbeute oder bei der Reduktion mit Natriumborhydrid in Wasser (96 %).

Oxidation von 2-Thiophenaldehyd mit Sauerstoff an einem Eisen(III)-Molybdän-Kontakt liefert unter schonenden Bedingungen Thiophen-2-carbonsäure in hoher Ausbeute (92 %)[18]

Das aus Thiophen-2-carbonsäure und Kupfer(I)-oxid Cu2O gebildete Cu(I)-thiophen-2-carboxylat (CuTC)[19] eignet sich – in Kombination mit Tetrakis(triphenylphosphin)palladium(0)) – als Katalysator für die Verknüpfung von Arylhalogeniden (Ullmann-Reaktion). CuTC cokatalysiert auch die Kreuzkupplung von Aryliodiden bzw. Alkenyliodiden und Boronsäuren und stellt eine Alternative zur Suzuki-Kupplung dar.[20]
Literatur
- Salo Gronowitz, Anna-Britta Hörnfeldt: Thiophenes., Elsevier Ltd., Kidlington, UK 2004, ISBN 0-12-303953-3, S. 71.
- Jürgen Engel, Axel Kleemann, Bernhard Krischer, Dietmar Reichert: Pharmaceutical Substances: Syntheses, Patents and Applications of the most relevant APIs, 5th Edition, Thieme, Stuttgart, 2009, ISBN 978-3-1317-9275-4.
Einzelnachweise
- Eintrag zu 2-Thiophencarboxaldehyde (stabilized with HQ) bei TCI Europe, abgerufen am 30. Juni 2020.
- Datenblatt Thiophene-2-carboxaldehyde bei AlfaAesar, abgerufen am 30. Juni 2020 (PDF) (JavaScript erforderlich).
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 64.
- Scientific Opinion on Flavouring Group Evaluation 21, Revision 2 (FGE.21Rev2). In: Thiazoles, thiophene, thiazoline and thienyl derivatives from chemical group 29. Miscellaneous substances from chemical group 30. EFSA European Food Safety Authority, 12. Oktober 2011, abgerufen am 1. Juli 2020.
- A. Peter: Untersuchungen über das β-Acetotiënon und seine Derivate. In: Ber. Dtsch. Chem. Ges. Band 18, Nr. 1, 1885, S. 537–542, doi:10.1002/cber.188501801117.
- A. Biedermann: Ueber Thiophenaldehyd und die dem Benzylalkohol entsprechende Verbindung der Thiophenreihe. In: Ber. Dtsch. Chem. Ges. Band 19, Nr. 1, 1886, S. 636–640, doi:10.1002/cber.188601901144.
- K.B. Wiberg, H.F. McShane: 2-Chloromethylhiophene In: Organic Syntheses. 29, 1949, S. 31, doi:10.15227/orgsyn.029.0031; Coll. Vol. 3, 1955, S. 197 (PDF).
- K.B. Wiberg: 2-Thiophenaldehyde In: Organic Syntheses. doi:10.15227/orgsyn.000.0005; Coll. Vol. 3, 1955, S. 811 (PDF).
- W.J. King, F.F. Nord: Preparation of thiophene-2-aldehyde and some substituted thiophene aldehydes. In: J. Org. Chem. Band 13, Nr. 5, 1948, S. 635–640, doi:10.1021/jo01163a003.
- A.W. Weston, R.J. Michaels, Jr.: 2-Thenaldehyde In: Organic Syntheses. 31, 1951, S. 108, doi:10.15227/orgsyn.031.0108; Coll. Vol. 4, 1963, S. 915 (PDF).
- Patent US2741622: Preparation of thiophene-2-aldehyde. Angemeldet am 3. Dezember 1951, veröffentlicht am 10. April 1956, Anmelder: Monsanto Chemical Co., Erfinder: D.J. Brockmeyer, F.C. Meyer.
- A. Rieche, H. Gross, E. Höft: Über α-Halogenäther. IV. Synthesen aromatischer Aldehyde mit Dichlormethylalkyläthern. In: Chem. Ber. Band 93, Nr. 1, 1960, S. 88–94, doi:10.1002/cber.19600930115.
- H. Stähelin, A. von Wartburg: From podophyllotoxin glucoside to etoposide. In: Prog. Drug Res. Band 33, 1989, S. 169–266, doi:10.1007/978-3-0348-9146_8.
- P. Motloch, I. Valterová, M. Kotora: Enantioselektive allylation of thiophene-2-carbaldehyde: Formal total synthesis of Duloxetine. In: Adv. Synth. Catal. Band 356, Nr. 1, 2014, S. 199–204, doi:10.1002/adsc.201300849.
- Patent EP342118A1: 2-(2-nitrovinyl)thiophene reduction and synthesis of thieno(3,2-c)pyridine derivatives. Angemeldet am 9. Mai 1989, veröffentlicht am 15. November 1989, Anmelder: Sanofi, Erfinder: E. Lodewijk, H.N. Khatri.
- Jürgen Engel, Axel Kleemann, Bernhard Krischer, Dietmar Reichert: Pharmaceutical Substances: Syntheses, Patents and Applications of the most relevant APIs, 5th Edition. Thieme, Stuttgart 2009, ISBN 978-3-13-179275-4, S. 1160.
- F.W. Dunn, K. Dittmer: A microbial synthesis of 2-thiophenecarbinol. In: J. Am. Chem. Soc. Band 68, Nr. 12, 1946, S. 2561–2562, doi:10.1021/ja01216a040.
- H. Yu, S. Ru, G. Dai, Y. Zhai, H. Lin, S. Han, Y. Wei: An efficient iron(III)-catalyzed aerobic oxidation of aldehydes in water for the green preparation of acrboxylic acids. In: Angew. Chem. Int. Ed. Band 56, Nr. 14, 2017, S. 3867–3871, doi:10.1002/anie.201612225.
- A. Innitzer: Copper(I) Thiophene-2-carboxylate. In: Synlett. Band 15, 2005, S. 2405–2406, doi:10.1055/s-2005-872681.
- C. Savarin, L.S. Liebeskind: Nonbasic, room temperature, palladium-catalyzed coupling of aryl and alkenyl iodides with boronic acids mediated by copper(I) thiophene-2-carboxylate (CuTC). In: Org. Lett. Band 3, Nr. 14, 2001, S. 2149–2152, doi:10.1021/ol010060p.
